Staphylococcus aureus Resistente à Meticilina (MRSA) e Vancomicina
A infecção por Staphylococcus aureus resistente à meticilina (MRSA) é causa importante de mortalidade e morbidade no hospital. O tratamento gera dúvidas, especialmente com relação a vancomicina e sua monitorização. Na revisão do mês, abordamos infecções por MRSA, seu tratamento e monitorização de vancomicina.
O que é MRSA?
O Staphylococcus aureus (SA) possui duas formas principais de resistência que são importantes para entender o seu tratamento.
A primeira forma de resistência é a produção de beta-lactamases (BL), que são enzimas que inativam antibióticos da classe dos beta-lactâmicos. A BL produzida pelo SA inibe as penicilinas como benzilpenicilina, amoxicilina e ampicilina. Algumas penicilinas desenvolvidas posteriormente não são inibidas por essa BL. A primeira delas foi a meticilina, substituída posteriormente pela oxacilina e flucloxacilina [1]. Surgiram em seguida as cefalosporinas, antibióticos que também são resistentes a essa BL. Essa é a justificativa para usar oxacilina ou cefalexina como antibióticos de escolha para SA.
O segundo mecanismo de resistência é a produção de uma proteína ligadora de penicilina modificada (do inglês penicillin binding protein, origem da sigla PBP). A PBP é o sítio de ação dos beta-lactâmicos e a modificação da PBP reduz a afinidade da ligação com o antibiótico. Isso torna o SA resistente à meticilina, motivo do nome MRSA. Esse mecanismo confere ao mesmo tempo resistência à oxacilina, por isso o MRSA também é chamado de "oxa-R", e a todos os outros beta lactâmicos incluindo as cefalosporinas e os carbapenêmicos. A exceção são as cefalosporinas de quinta geração: ceftaroline (disponível no Brasil) e ceftobiprole.
O SA resistente à vancomicina, chamado de VRSA, é raro mundialmente [2].
MRSA da comunidade e MRSA associado aos cuidados de saúde
O MRSA pode ser dividido em dois grupos:
- CA-MRSA: MRSA adquirido na comunidade (community-associated MRSA)
- HA-MRSA: MRSA associado aos cuidados de saúde (health-care-associated MRSA).
A infecção pelo HA-MRSA está associada a dispositivos invasivos como cateter venoso, sonda vesical e tubo orotraqueal. Internação prolongada, estadia em UTI e hemodiálise são fatores de risco comuns dessa infecção. A tabela 1 traz os principais fatores de risco para HA-MRSA. Os tipos de infecção mais comuns por HA-MRSA são infecção de corrente sanguínea e pneumonia. A infecção de pele e partes moles é menos comum, mas pode ocorrer no contexto de pós-operatório [1].
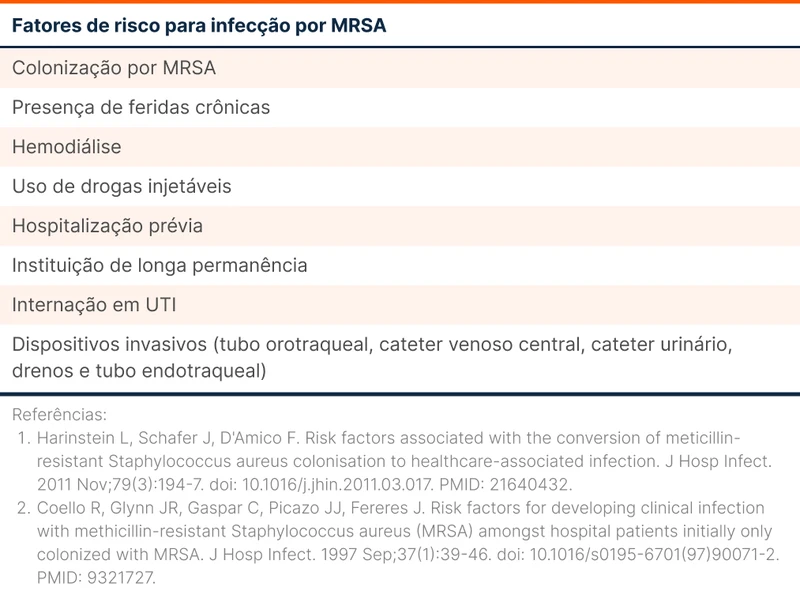
A infecção por CA-MRSA ocorre em pacientes que não tiveram contato com serviços de saúde. Foram descritos surtos em pacientes jovens e saudáveis em times esportivos, unidades militares e presídios. A infecção é primordialmente de pele e partes moles com formação de pus e abscessos. O CA-MRSA também está associado a infecções invasivas como fasceíte necrosante [1, 3].
Essa diferenciação entre CA-MRSA e HA-MRSA traz dois pontos principais. O primeiro é que geralmente a gravidade da doença não significa resistência a antimicrobianos. Assim, uma infecção mais grave não indica necessariamente o uso de antibioticoterapia de amplo espectro. Contudo, no caso de CA-MRSA, a resistência está associada a doenças mais invasivas. Em infecções graves de pele e partes moles da comunidade existe recomendação de cobertura empírica para MRSA [3, 4].
O segundo ponto é que existe uma diferença de sensibilidade a antimicrobianos entre HA-MRSA e CA-MRSA. O CA-MRSA geralmente é sensível a doxiciclina, sulfametoxazol/trimetoprima e clindamicina. Assim, em infecções de pele e partes moles leves com suspeita de MRSA esses agentes podem ser utilizados empiricamente.
A diferenciação clara do perfil de CA-MRSA e HA-MRSA e a incidência de CA-MRSA em infecções de pele e partes moles é baseada em dados internacionais. Qual é a real incidência de CA-MRSA no Brasil? No momento não temos estudos robustos para reponder essa questão [5, 6].
Bacteremia por MRSA
O SA está associado a diversas infecções como infecções musculoesqueléticas (osteomielite, piomiosite, artrite séptica), infecções endovasculares (corrente sanguínea associada a cateter e endocardite), infecções de pele e partes moles (abscessos cutâneos, fasceíte necrosante), pneumonia, ventriculite e outras [7].
Em um paciente em investigação infecciosa em que há crescimento de SA em hemocultura, dois pontos devem ser considerados:
- O resultado da hemocultura não deve ser encarado como contaminação.
- Todos os pacientes com bacteremia por SA devem ser investigados para endocardite com ecocardiograma [8, 9].
Essa recomendação é baseada em estudos de pacientes com bacteremia por SA em que foi realizado ecocardiograma e feito o diagnóstico de endocardite mesmo em pacientes que não tinham sinais e sintomas sugestivos de endocardite [10-12].

O método da ecocardiografia é motivo de discussão. O ecocardiograma transesofágico é mais sensível para o diagnóstico de endocardite, mas está associado com maior custo e risco [10, 11, 13, 14]. Alguns escores foram criados para tentar predizer o risco de endocardite e a necessidade de realização de ecocardiograma transesofágico [15, 16]. Desses escores o mais sensível é o VIRSTA (tabela 2) com sensibilidade de 96,7% e valor preditivo negativo de 99,5% para excluir endocardite. Contudo, ponderando o risco de não diagnosticar endocardite e o risco do procedimento, alguns autores criticam o uso desses escores, enfatizando o ecocardiograma para todos [17].
Tratamento de MRSA
Antibióticos com ação contra MRSA, dosagem, efeitos colaterais e indicações estão listados na tabela 3.
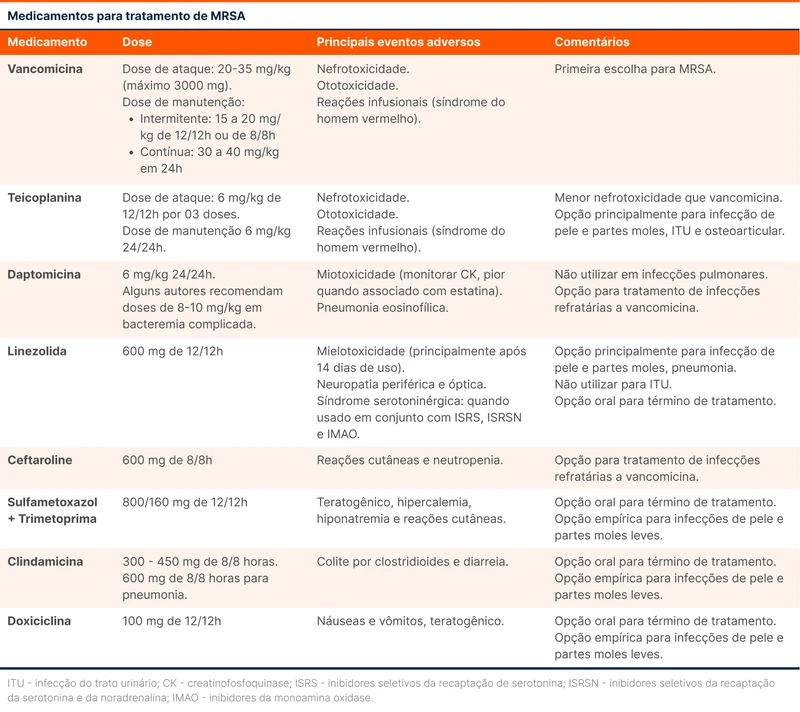
A principal escolha no tratamento de infecções por MRSA é a vancomicina [7, 8]. Existem poucos estudos comparando as terapias contra MRSA. O surgimento de novas drogas trouxe o debate sobre qual medicação deve ser a primeira linha no tratamento do MRSA [18, 19]. Há um estudo em andamento comparando diversos esquemas de tratamento para SA que pode trazer alguns esclarecimentos nessa área.
Vancomicina é um glicopeptídeo e a principal escolha para tratamento de MRSA. Os principais efeitos colaterais são nefrotoxicidade, ototoxicidade e reação infusional da vancomicina (previamente conhecida como síndrome do homem vermelho). Diversos estudos associaram o uso simultâneo de vancomicina e piperacilina/tazobactam com disfunção renal [20, 21]. Esses estudos usaram como medida de função renal a creatinina, cuja excreção tubular é reduzida pela piperacilina/tazobactam. Essa redução da excreção pode elevar a creatinina sem uma lesão renal verdadeira, um fenômeno conhecido como pseudo disfunção renal. Em 2022 foi publicado um artigo que usou cistatina C e outros biomarcadores para essa avaliação [22]. O estudo não encontrou evidência de que a associação desses antibióticos esteja relacionada com piora da função renal.
Teicoplanina é um glicopeptídeo semelhante à vancomicina, podendo ser usado uma vez ao dia. Estudos comparando teicoplanina e vancomicina sugerem eficácia semelhante entre os dois, menor nefrotoxicidade e menos reações infusionais com a teicoplanina [23].
Daptomicina é um lipopeptídeo, sendo uma alternativa à vancomicina para o tratamento de bacteremia e endocardite por MRSA. Não deve ser usada para pneumonia, pois é inativada pelo surfactante pulmonar. Em pacientes com endocardite e embolia séptica pulmonar, os poucos estudos sugerem que daptomicina pode ser usada, mas falhas de tratamento já foram relatadas [24]. O principais efeitos colaterais são miopatia, rabdomiólise e pneumonia eosinofílica [25, 26].
Linezolida pertencente à classe das oxazolidinonas, tem apresentação oral e endovenosa. O uso é indicado especialmente em pacientes com pneumonia e infecção de pele e partes moles por MRSA. O principal efeito colateral é mielotoxicidade que ocorre com mais frequência após 14 dias de tratamento. O surgimento de citopenias durante o uso de linezolida deve levantar essa suspeita. Outros efeitos colaterais são neuropatia periférica, neuropatia óptica e acidose lática. Existe o risco de síndrome serotoninérgica em pacientes em uso de antidepressivos, apesar de uma revisão recente sugerir que o uso concomitante é seguro [27].
Ceftaroline é uma cefalosporina de quinta geração que ainda possui evidência limitada no tratamento de MRSA. É uma alternativa para terapia de resgate após falha de tratamento [28, 29]. Os principais efeitos colaterais são reações cutâneas (exantema, prurido e urticária), náuseas e vômitos. Em pacientes em uso prolongado existe o risco de neutropenia [30].
Sulfametoxazol/trimetoprima, doxiciclina e clindamicina são opções orais viáveis para o tratamento, especialmente de infecções de pele e partes moles.
Quando escolher uma alternativa à vancomicina?
As situações em que deve-se considerar um tratamento alternativo à vancomicina são:
- Intolerância ou alergia
- Falha de tratamento
- Concentração inibitória mínima (CIM ou MIC) de vancomicina de 2,0 mcg/mL
O tratamento de bacteremia por SA tem alta probabilidade de falha. Em um estudo as falhas ocorreram em 50% dos casos [31].
A definição de falha varia com os estudos. A diretriz de tratamento de MRSA da Infectious Disease Society of America (IDSA) define falha como persistência de bacteremia ao redor do sétimo dia ou antes, caso haja deterioração clínica . O tempo de 7 dias tem origem na mediana de resolução de bacteremia, que é de 7 a 9 dias [8].
Antes de definir falha de tratamento, alguns fatores devem ser considerados:
- Existe um foco infeccioso que pode ser controlado com um procedimento?
- A resposta clínica está adequada? Algumas infecções demoram a responder, como endocardite
- Monitorização sérica de vancomicina: a droga sempre ficou em nível terapêutico?
- O SA isolado na cultura é suscetível ao antibiótico escolhido?
As alternativas no caso de falha de tratamento estão na tabela 4. Tanto terapia combinada quanto monoterapia são opções descritas nesse tipo de situação, mas não há estudos comparando essas duas estratégias.

Alguns estudos associaram CIM a vancomicina maiores que 1 mcg/mL com piores desfechos em pacientes com MRSA [32-34]. Apesar disso, não há dados que demonstrem que outros antimicrobianos são mais adequados nesse cenário. Assim, a depender da evolução, uma alternativa à vancomicina pode ser considerada.
Monitorização de vancomicina
Existem 2 objetivos para monitorização de vancomicina: garantir dose adequada para o tratamento (evitando subdose) e impedir nefrotoxicidade. Em 2020 foi publicada uma diretriz sobre dosagem e monitorização de vancomicina pela IDSA em conjunto com outras organizações [34]. A publicação traz recomendações sobre quando e como monitorar.
A monitorização de vancomicina é recomendada em pacientes com infecções invasivas graves por MRSA, excluindo infecções de pele e partes moles sem bacteremia e infecções do trato urinário. Além dessa indicação, pacientes com programação de usarem vancomicina por mais de 3 a 5 dias ou com disfunção renal/alto risco de disfunção renal também devem ter nível sérico monitorizado, independe do agente tratado (estafilococo, enterococo ou outros). Para compreender como funciona a monitorização é preciso entender o ajuste de medicações por parâmetros farmacocinéticos (pharmacokinetic ou PK) e farmacodinâmicos (pharmacodynamic ou PD).
O principal parâmetro de PD usado é a CIM (concentração inibitória mínima), amplamente conhecido e disponível. Idealmente, a concentração sérica de um antimicrobiano deve ser maior ou igual a CIM.
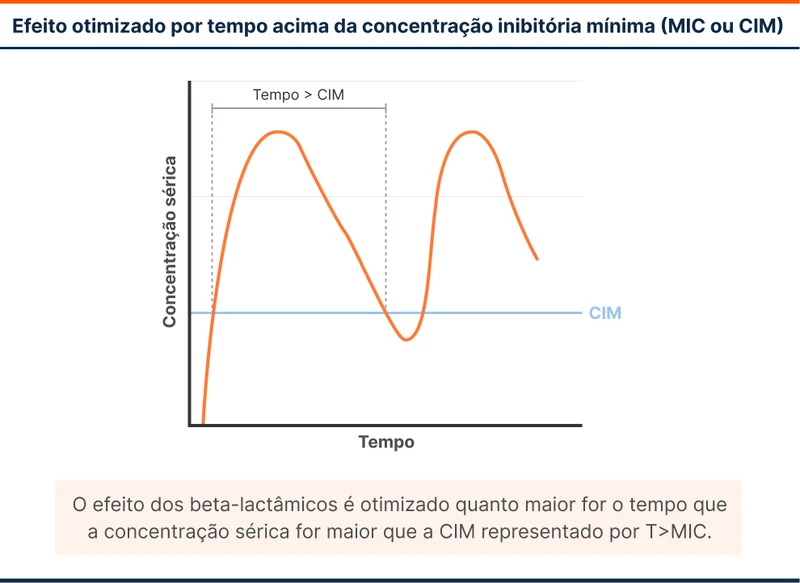
Os parâmetros de PK são particulares de cada antibiótico. Os beta-lactâmicos, por exemplo, têm seu melhor efeito se a concentração sérica for maior que a CIM por mais tempo (figura 1). Já os aminoglicosídeos têm seu melhor efeito dependendo da concentração máxima que atingem (figura 2). Essas diferenças resultam em estratégias distintas de infusão: os aminoglicosídeos são infundidos em dose única, objetivando atingir a concentração máxima mais alta possível, enquanto os beta-lactâmicos são infundidos em tempos prolongados para manter concentração acima da CIM por mais tempo.
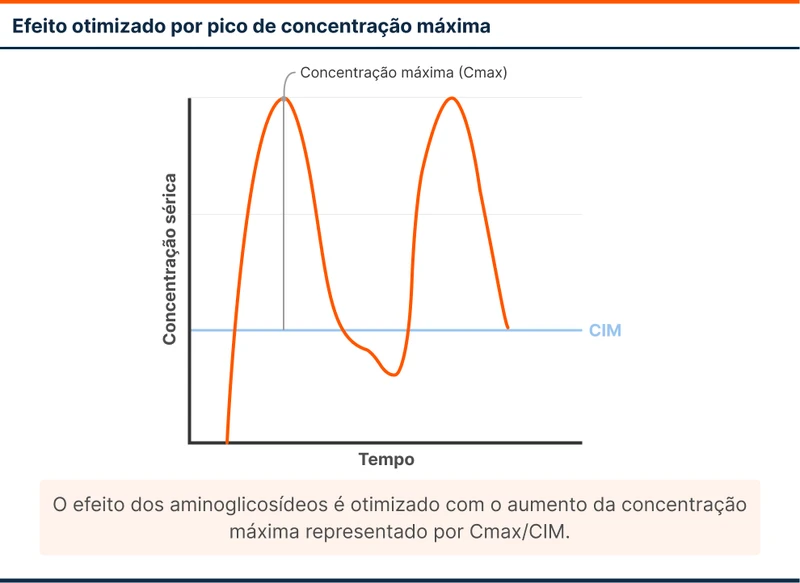
A vancomicina tem o seu melhor efeito combinando tempo acima da CIM e concentração (figura 3). Para representar graficamente esse conceito, calcula-se a área sob a curva do gráfico em 24 horas. A fórmula é representada como AUC24/CIM (AUC24 é área sob a curva em 24 horas). Esse valor idealmente deve se manter entre 400-600.
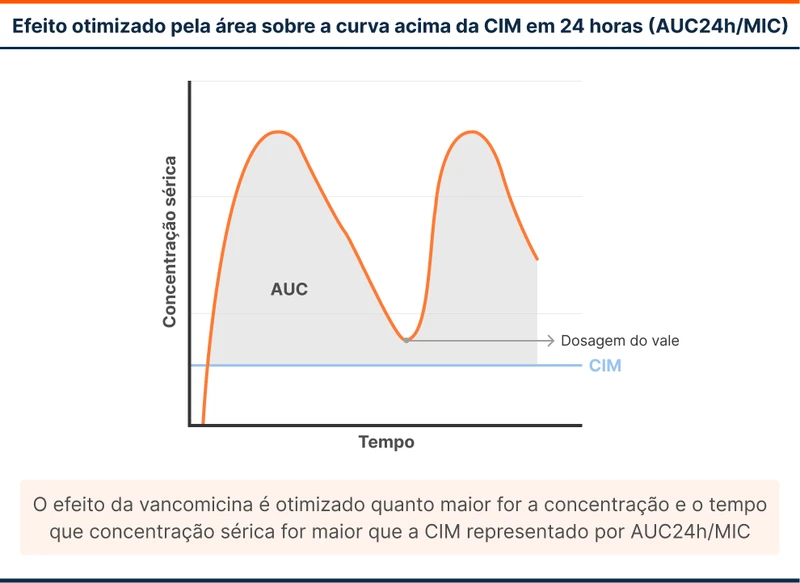
Classicamente a monitorização de vancomicina é feita com dosagem de níveis séricos de vancomicina 1 a 2 horas antes da quarta dose. A aferição imediatamente antes da próxima dose é chamada de dosagem “no vale”, sendo realizada antes da quarta dose pois é o momento que a droga atingiu o equilíbrio. A dose é ajustada para manter a concentração de 15-20mg/mL, pois esses valores se correlacionam com AUC24/CIM de 400-600. Atualmente essa correlação é questionada e novas estratégias foram desenvolvidas.
A diretriz de monitorização de vancomicina de 2020 orienta não utilizar o método clássico e sugere duas estratégias. A primeira é o cálculo da AUC24/CIM realizando 2 coletas e aplicando fórmulas de farmacocinética. A segunda usa programas de software Bayesianos para realizar esse cálculo utilizando 1 ou 2 amostras. O segundo método é preferível segundo a diretriz. Apesar de parecer complexo, o segundo método é fácil de ser aplicado. Existem diversos sites que possuem essas fórmulas - confira um exemplo de fórmulas de monitorização de vancocinemia aqui.
É necessário realizar a coleta antes da próxima dose, mas a amostra pode ser feita nas primeiras 24 a 48 horas, outra vantagem do método. Após preencher os dados do paciente e a concentração sérica de vancomicina, já é feito o cálculo da AUC24/CIM e sugerido o ajuste de dose.
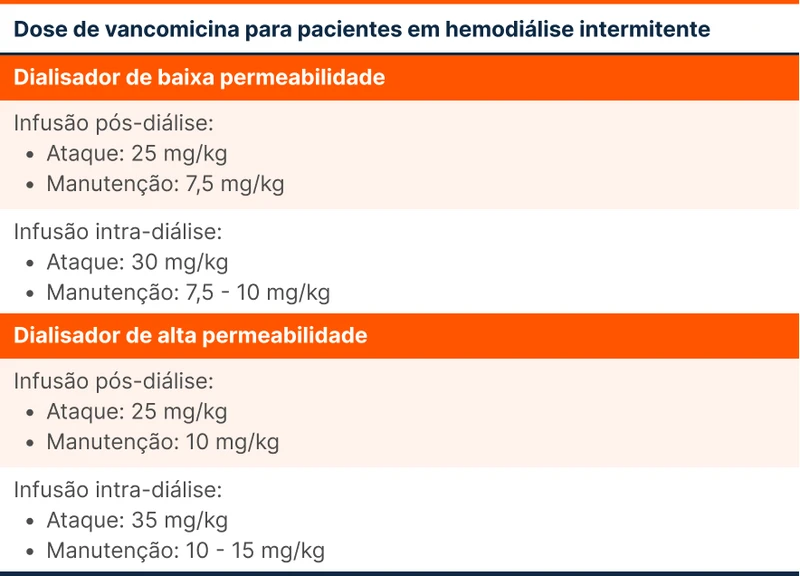
Para pacientes em hemodiálise é recomendado que seja feita dose de ataque e dose de manutenção conforme permeabilidade (tabela 5). A monitorização deve ser feita com coleta de concentração sérica de vancomicina pré-diálise com alvo de 15 - 20mg/mL.
Aproveite e leia:
Infecções Associadas a Cateter Intravascular
As infecções associadas a cateter intravascular são complicações graves. Representam a segunda causa mais comum de infecção adquirida em UTI no Brasil, atrás apenas de pneumonia associada à ventilação mecânica. Essa revisão aborda os principais conceitos, diagnóstico, tratamento e prevenção de infecções associadas a cateteres intravasculares.
Bacteremia por Staphylococcus aureus
A bacteremia por Staphylococcus aureus tem uma mortalidade de 10 a 30%. Indicação de ecocardiograma, necessidade de repetir hemoculturas e tempo de tratamento são dúvidas frequentes. Este tópico revisa as manifestações, abordagem inicial e tratamento dessa condição.
Corticoides na Pneumonia Adquirida na Comunidade
A pneumonia adquirida na comunidade (PAC) é responsável por mais de 600 mil internações anuais no Brasil. A estratificação de risco ajuda a guiar o tratamento. Atualmente, o uso de corticoides como medida terapêutica em PAC grave é controverso. Em março de 2023, o estudo CAPE COD, publicado no New England Journal of Medicine (NEJM), analisou o uso de corticoides na PAC grave e aproveitamos para revisar o assunto.
Diretriz de 2023 de Prognóstico Neurológico Pós Parada Cardiorrespiratória
O prognóstico neurológico pós parada cardiorrespiratória (PCR) é um desafio comum na terapia intensiva. Em março de 2023, a Neurocritical Care Society publicou uma diretriz de recomendações para a avaliação do prognóstico neurológico em pacientes que permanecem comatosos após PCR. Revisamos este tema neste tópico.
Tratamento de Bacteremia por Gram-Negativos
Houve um aumento global da incidência de bacteremia por gram-negativos nos últimos anos, associada com maior mortalidade e morbidade. Em 2023 foi publicada uma revisão sistemática e meta-análise comparando 7 e 14 dias de tratamento antimicrobiano nessa condição. Esse tópico revisa o tratamento de bacteremia por gram-negativos.
