Caso Clínico #7
O caso clínico abaixo é apresentado em partes. O negrito é a descrição do caso, as partes que não estão em negrito são os comentários. Ao final, você encontrará a resolução e os pontos de aprendizagem resumidos.
Um homem de 65 anos começa a queixar-se de dispneia há 5 meses. O sintoma ocorre aos esforços, quando caminha cerca de 300 metros. Relata também ortopneia e edema intermitente de membros inferiores. Negava dor torácica, dispneia paroxística noturna e chiados no peito.
Procurou atendimento na unidade básica de saúde, onde foi solicitada uma radiografia de tórax, que evidenciou um aumento da área cardíaca. Realizou também um ecocardiograma que mostrava um coração com espessura de paredes aumentadas, átrio esquerdo aumentado e uma fração de ejeção de 73%. Foi diagnosticado com insuficiência cardíaca e iniciado tratamento com carvedilol e losartana.
O paciente é natural de Sergipe e procedente de São Paulo, motorista de aplicativo, casado. Tem antecedentes de hipertensão e dislipidemia e era ex-tabagista (carga tabágica de 17 maços-ano).
O diagnóstico diferencial de dispneia gira em torno de doenças cardiopulmonares, sempre considerando causas alternativas como anemia. A presença de edema e ortopneia fortalecem a hipótese de insuficiência cardíaca (IC) como explicação para o caso. A suspeita de IC é sempre clínica, posteriormente confirmada por exames complementares.
Os achados do paciente estão presentes nos critérios de Framingham de diagnóstico de insuficiência cardíaca, mostrados na tabela 1 [1]. Deve-se ter cuidado, pois os sintomas dos critérios menores não podem ser explicados por uma causa alternativa. Existe outro critério de Framingham, este outro para avaliação de risco cardiovascular, que é diferente do critério para insuficiência cardíaca.

Eletrocardiograma e radiografia são exames de baixo custo que ajudam na suspeita de insuficiência cardíaca. O aumento da área cardíaca na radiografia do paciente é mais uma evidência nesse sentido. Um eletrocardiograma normal torna a hipótese de IC improvável - 98% de valor preditivo negativo de não existir disfunção do ventrículo esquerdo (VE) [2]. A presença de fibrilação atrial aumenta significativamente a chance de o paciente ter IC. Além de afastar ou sugerir IC, o eletrocardiograma auxilia na determinação da etiologia. A presença de ondas Q sugere a possibilidade de cardiomiopatia isquêmica.
O ecocardiograma permite subclassificar a IC de acordo com a fração de ejeção do ventrículo esquerdo (FEVE) no momento do diagnóstico em:
- ICFEr (IC de fração de ejeção reduzida): FEVE < 40%
- ICFEp (IC de fração de ejeção preservada): FEVE > 50%
- ICFElr (IC de fração de ejeção levemente reduzida ou mid-range ou intermediária): FEVE 40 - 50%
A FEVE que determina a classificação da IC deve ser aferida ao diagnóstico. Após esse período, alguns pacientes com ICFEr podem apresentar uma melhora da FEVE, mas devem continuar sendo tratados como ICFEr.
Quando a FEVE é preservada, deve-se ter o cuidado de diferenciar um paciente com ICFEP de um que simplesmente não possui IC, pois ambos compartilham a mesma faixa de fração de ejeção. Assim, o diagnóstico da ICFEp possui algumas recomendações específicas, resumidas no seguinte fluxograma da Diretriz Brasileira de Insuficiência Cardíaca da Sociedade Brasileira de Cardiologia (fluxograma 1) [3].
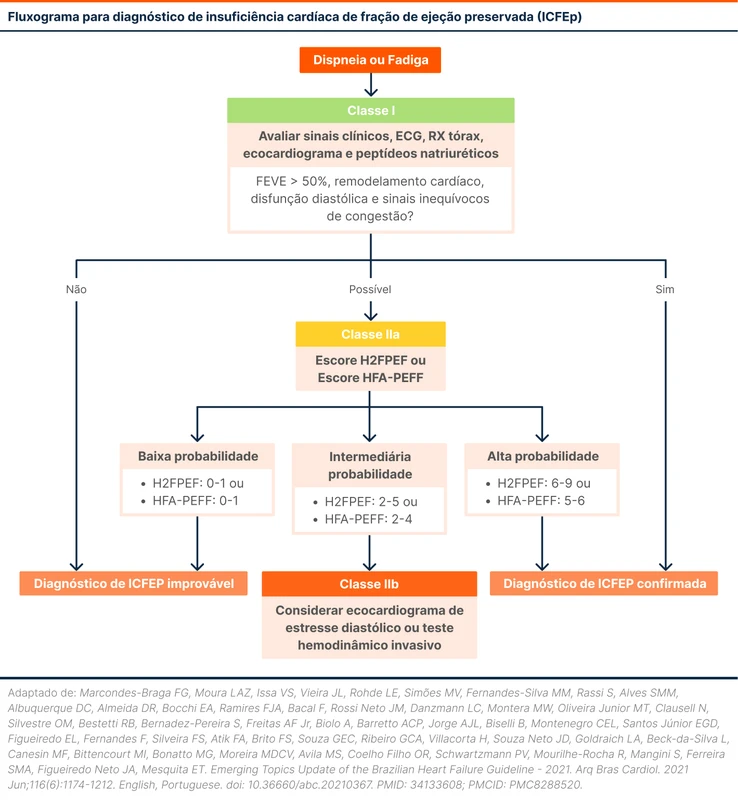
Inicialmente, para o diagnóstico da ICFEP, além anamnese e exame físico, são também relevantes:
- Eletrocardiograma
- Radiografia de tórax
- BNP ou NT-pro-BNP
- Ecocardiograma
O ecocardiograma pode mostrar os seguintes achados que contribuem com o diagnóstico de ICFEP:
- Hipertrofia concêntrica
- Aumento atrial
- Pressão sistólica na artéria pulmonar (PSAP) elevada - medida indireta sugestiva de hipertensão pulmonar
- Disfunção diastólica moderada ou severa
A avaliação da função diastólica na ecocardiografia é feita pela análise do fluxo sanguíneo pela valva mitral e do relaxamento da parede do miocárdio durante a diástole. A diástole é a principal fase do ciclo cardíaco alterada na ICFEp. Disfunções diastólicas de grau 1 (discretas) não costumam ser suficientes para causar uma clínica de IC. A presença de fibrilação atrial, extrassístoles muito frequentes e frequência cardíaca acelerada podem impedir o ecocardiografista de fazer a análise da função diastólica.
Nos casos clássicos de IC com eletrocardiograma com sobrecarga de câmaras ou fibrilação atrial, radiografia de tórax com sinais de congestão, BNP ou NT-pro-BNP elevado e ecocardiograma sugestivo, o diagnóstico de ICFEP está feito.
É relativamente comum encontrar cenários em que os achados não são tão típicos. Nestes casos, pode-se utilizar dois escores auxiliares: o H2FPEF e HFA-PEFF.
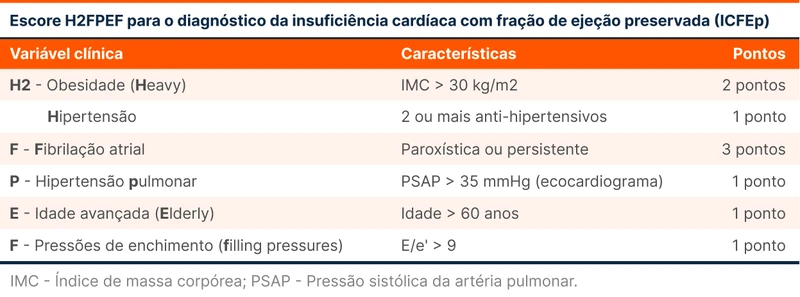
O H2FPEF traz diversas características clínicas que aumentam a probabilidade de ICFEP (tabela 2). Já o escore HFA-PEFF mescla achados ecocardiográficos com valores de peptídeos natriuréticos (tabela 3). A interpretação resumida destes escores é a seguinte:
- H2FPEF de 6-9 ou HFA-PEFF de 5-6: Confirma o diagnóstico de ICFEP.
- H2FPEF de 2-5 ou HFA-PEFF de 2-4: Diagnóstico duvidoso de ICFEP. Para maior certeza, pode-se recorrer a exames menos disponíveis, como ecocardiograma com estresse diastólico e testes hemodinâmicos invasivos.
- H2FPEF ou HFA-PEFF de 0-1: Exclui o diagnóstico de ICFEP [3]

A ICFEP deve ser separada de outras causas de IC que também tem FEVE na faixa da normalidade. Valvopatias, doenças do pericárdio, cardiomiopatias restritivas, IC de alto débito entre outras etiologias podem causar uma síndrome clínica de IC e tem FE normal, mas devem ser distinguidas de ICFEP, pois tem manejo e prognóstico diferentes.
Até pouco tempo atrás, o manejo da ICFEP se baseava em:
- Controle de comorbidades
- Reabilitação cardiopulmonar
- Controle de hipervolemia com diuréticos de alça
- Espironolactona, que no estudo TOP-CAT reduziu internações por descompensação da doença [4, 5].
Recentemente, os estudos EMPEROR-PRESERVED e DELIVER encontraram que os iSGLT2 empagliflozina e dapagliflozina reduziram o desfecho composto de mortalidade e internação por IC [6, 7]. Isso ocorreu mesmo em não diabéticos. O benefício se deu especialmente pela redução de internações por IC.
Existe polêmica na indicação do sacubitril-valsartana na ICFEP. O estudo PARAGON-HF não encontrou redução do desfecho composto de mortalidade e hospitalizações por IC nesta população [8]. Contudo, teve um achado de significância estatística limítrofe de redução de hospitalizações por IC isoladamente (10 vs. 12 por 100 pacientes-ano; RR 0,85, 95% IC 0,72-1,00). Uma crítica importante é que os resultados podem estar contaminados por pacientes com IC e FEVE levemente reduzida (FEVE entre 45% e 50%) que também foram incluídos neste estudo.
Há 3 meses, o paciente passou a apresentar parestesias e hipoestesias nas pontas dos dedos das mãos e nos pés até metade da perna. Também relatou o surgimento espontâneo de equimoses nas extremidades, gengivorragia espontânea e fezes escurecidas e mal-cheirosas.
Há 20 dias, após episódios de vômitos com aspecto de borra-de-café, procurou atendimento em um pronto-socorro, onde foi constatada hemoglobina de 4,9 g/dL. Nesta ocasião, recebeu 3 concentrados de hemácias e foi submetido a uma endoscopia digestiva alta, evidenciando pangastrite e bulboduodenite intensas. Recebeu alta para investigação ambulatorial.
Alguns dias depois, retornou ao pronto-socorro por queixa de mal-estar generalizado, astenia, palpitações e cefaleia, sendo prescrita dipirona intramuscular. Logo após a aplicação da medicação na região glútea, o paciente apresentou dor e aumento de volume local importantes. Realizou ultrassonografia que evidenciou um extenso hematoma no local. Foi internado para investigação hematológica e transferido a um hospital quaternário.
As parestesias e hipoestesias de distribuição em extremidades lembram um padrão de polineuropatia periférica sensitiva. Muitas causas de polineuropatia são comprimento dependentes, ou seja, afetam inicialmente os nervos mais longos das extremidades. A presença de comprometimento motor será melhor avaliada no exame físico.
Na suspeita de polineuropatia com quadro leve e uma etiologia clara (diabetes, quimioterapia, álcool, deficiência de vitamina B12) não é necessário uma investigação extensa. Contudo, quando o quadro é grave, rapidamente progressivo ou com características atípicas (assimetria, predomínio motor, fenômenos autonômicos) é preciso uma investigação mais aprofundada.
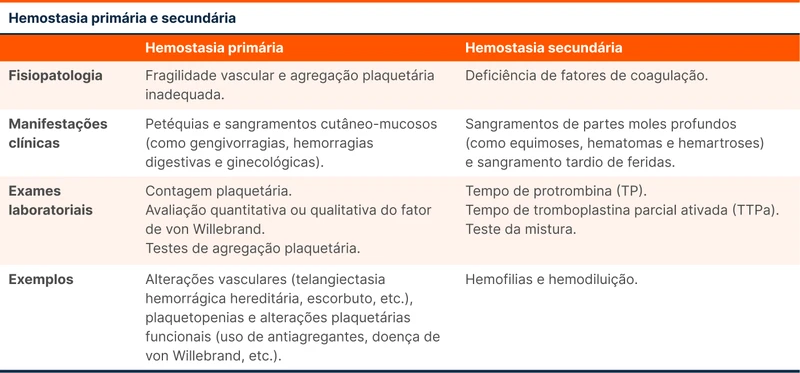
O paciente apresentou também várias manifestações diferentes de distúrbios de hemostasia: equimoses, gengivorragia, melena, hematêmese e hematoma profundo. As coagulopatias podem ser divididas em alterações da hemostasia primária e secundária, com diferenças fisiopatológicas, clínicas e laboratoriais.
A hemostasia primária é responsável pelos primeiros passos da coagulação, incluindo a ação da vasculatura e a agregação das plaquetas. Os distúrbios dessa etapa se manifestam como sangramentos cutâneo-mucosos como petéquias, gengivorragias, hemorragias digestivas e ginecológicas. Os exames laboratoriais indicativos de alterações na hemostasia primária incluem a contagem plaquetária, testes de agregação plaquetária e dosagem funcional ou quantitativa do fator de von Willebrand. Alguns exemplos desse grupo incluem alterações vasculares como telangiectasia hemorrágica hereditária e escorbuto, doenças que causam trombocitopenia como púrpura trombocitopênica imune e leucemias, e alterações plaquetárias funcionais como o uso de aspirina, inibidores da P2Y12 e doença de von Willebrand.
A hemostasia secundária é a etapa da coagulação que envolve a ativação dos fatores de coagulação e reforça a estabilidade do trombo pela formação de redes de fibrina. Os sintomas mais comuns de problemas nessa etapa são os sangramentos cutâneos e músculo-esqueléticos profundos como equimoses, hematomas e hemartroses, além do sangramento tardio de feridas. Os exames laboratoriais mais utilizados para identificar alterações nessa fase são o tempo de protrombina (TP) e o tempo de tromboplastina parcial ativada (TTPa). Alguns exemplos de doenças que afetam a hemostasia secundária são as hemofilias e a hemodiluição.
É difícil encaixar o paciente em um desses grupos, uma vez que apresenta evidência de comprometimento das duas etapas. A doença de von Willebrand pode causar comprometimento misto, sendo uma potencial explicação para essa apresentação. Apesar de na maioria das vezes ser uma doença hereditária, a doença de von Willebrand também pode ser adquirida.
À admissão no hospital quaternário, o exame físico revelava pressão arterial em decúbito de 160/90 mmHg e em ortostase após 3 minutos de 135/70 mmHg, evidenciando importante hipotensão ortostática. Os demais sinais vitais estavam normais.
Estava hipocorado 3+/4+ e hidratado. No exame neurológico apresentava o reflexo aquileu abolido bilateralmente e paresia grau 4 de predomínio distal. Ausculta cardíaca e respiratória sem alterações com uma turgência jugular a 45º e refluxo hepatojugular presente. No abdome, apresentava hepatomegalia indolor leve. Extremidades com múltiplas equimoses em diferentes fases de evolução, sem petéquias e com edema simétrico e com cacifo 1+ e hematoma doloroso do glúteo até a metade da coxa esquerda.
Os exames laboratoriais iniciais mostraram uma hemoglobina de 7,8 g/dL, com VCM e HCM normais, contagem de reticulócitos elevada de 120.000/microL, leucócitos de 8.050/mm³ e plaquetas de 365.000/mm³, creatinina de 3,62 mg/dL, ureia 114 mg/dL, sódio 139 mEq/L, potássio de 4,5 mEq/L e NT-pro-BNP 1467 pg/mL.
Para a investigação de neuropatia periférica foram solicitados: hemoglobina glicada, dosagem de B12, ácido fólico, perfil tireoidiano e sorologias (HIV, hepatites virais e sífilis), todos sem alterações.
Em relação aos exames para investigação inicial de distúrbios da hemostasia, a relação paciente-controle do TTPA era de 1,05 e o INR de 1,46.
Plaquetopenia é a principal causa de distúrbio da hemostasia primária. Contudo, distúrbios funcionais das plaquetas também podem ocorrer, mesmo com contagem de plaquetas dentro da normalidade. Essa é uma possibilidade aqui, já que os exames mostram uma disfunção renal importante e uremia pode comprometer a função plaquetária.
A hemostasia secundária está acometida, com o INR elevado mostrando comprometimento da via extrínseca. O próximo passo é quantificar os fatores da via afetada - fatores II, VII, IX e X - e avaliar a presença de um inibidor com o teste da mistura.
Inibidores adquiridos dos fatores da coagulação são anticorpos que atrapalham a atividade ou aumentam a degradação dos fatores da coagulação. Esses inibidores podem ocorrer como um fenômeno autoimune. Distúrbios da hemostasia secundária adquiridos em adultos devem levantar a suspeita de inibidores da coagulação.
No teste da mistura, o soro do paciente é misturado com um soro normal e se repete os tempos de coagulação (TP e TTPA). Se o tempo de coagulação corrigir após a mistura, isso sugere deficiência de fatores que foi resolvida com o soro normal. Se o tempo de coagulação persistir alterado após a mistura, a suspeita é de um inibidor dos fatores de coagulação que também compromete os fatores do soro normal.
Os sinais vitais mostram uma significativa hipotensão ortostática, definida por [9]:
- Diminuição ≥ 20 mmHg de pressão sistólica entre as medidas em decúbito e em ortostase após 3 minutos e/ou
- Diminuição ≥ 10 mmHg de pressão diastólica entre as medidas em decúbito e em ortostase após 3 minutos.
As etiologias principais de hipotensão ortostática são medicamentos, hipovolemia ou disautonomia. Considerando a clínica sugestiva de polineuropatia, a hipotensão ortostática pode ser uma manifestação de disautonomia. O exame neurológico reforça a hipótese inicial de polineuropatia com os achados de hiporreflexia e fraqueza distal. A eletroneuromiografia é útil nesse contexto de investigação etiológica de polineuropatia em que não há uma causa clara e existem indícios de uma doença sistêmica.
Pela lesão renal aguda, inicialmente um exame do sedimento urinário e ultrassonografia de rins e vias urinárias ajudam na investigação inicial. Além disso, a presença de urgências dialíticas deve ser buscada ativamente em uma lesão renal aguda com essa gravidade. Mais detalhes sobre a abordagem de lesão renal aguda aqui.
Como havia sinais sugestivos de distúrbios da hemostasia primária, foi solicitado o teste de agregabilidade plaquetária que veio reduzida para adrenalina e ADP, com dosagem quantitativa e qualitativa do fator de von Willebrand normais. Para a investigação da hemostasia secundária, foi solicitado o teste da mistura, com correção do tempo de coagulação após a mistura. Por isso foram dosados os fatores X, VII, IX e II (os componentes da via extrínseca), com o resultado de um fator X baixo isolado.
Posteriormente, foi solicitada uma eletroneuromiografia com resultado de polineuropatia sensitivo-motora axonal e sinais de comprometimento autonômico simpático (sudomotor) e parassimpático (cardiovagal). Quanto à disfunção renal, foi solicitado ultrassom de rins e vias urinárias que mostravam rins de tamanho normal sem sinais de hidronefrose. O exame de urina evidenciava proteinúria sem hematúria, que quando quantificada resultou em 2 g/dia.
Os exames mostram comprometimento da agregabilidade plaquetária inespecífica e deficiência não-imune do fator X, conforme as hipóteses. A suspeita clínica de polineuropatia periférica sensitiva-motora-autonômica também foi corroborada.
A ultrassonografia mostra rins de tamanho normal. Existem algumas situações que podem resultar em nefropatia com rins de tamanho normal ou aumentado:
- Diabetes mellitus
- Doença renal policística
- Mieloma múltiplo
- Amiloidose
- Hidronefrose
- Nefropatia falcêmica
- Nefropatia por HIV
As causas de proteinúria podem ser classificadas em 4 grupos:
- Overflow - por excesso de proteínas no plasma, geralmente por paraproteinemias
- Glomerular
- Túbulo-intersticial
- Pós-renal
Segundo as literaturas mais tradicionais, valores de proteinúria maiores que 500-1.000 mg/dia provavelmente tem origem glomerular.
A hipótese mais forte para conciliar todos os achados do caso é de amiloidose. Essa condição classicamente faz deficiência do fator X isoladamente, além de justificar a lesão renal com proteinúria, insuficiência cardíaca e polineuropatia. É importante sinalizar ao ecocardiografista que essa é uma hipótese, para que ele procure sinais específicos dessa etiologia. A biópsia de coxim adiposo auxilia a confirmar o diagnóstico.
Foi solicitado um novo ecocardiograma alertando o examinador da suspeita clínica de amiloidose. O resultado foi de fração de ejeção de 55%, aumento biatrial, hipertrofia biventricular, strain longitudinal global reduzido, notadamente nos segmentos basal e médio, e preservado em segmentos apicais (sinal da cereja do bolo ou cereja no topo), e miocárdio cintilante, achados típicos de cardiomiopatia amiloidótica.
Amiloidose é o termo para a situação em que há deposição extracelular de proteínas anormais em locais do corpo. Existem vários tipos de amiloidose com apresentação clínica distinta a depender do tipo de proteína amilóide e do orgão/tecido infiltrado. Uma característica em comum é que na biópsia de sítios acometidos, tais proteínas conferem uma birrefringência em verde-maçã quando coradas pelo vermelho do Congo.
As amiloidoses podem ser divididas em localizadas e sistêmicas. A doença de Alzheimer é considerada uma forma de amiloidose cerebral pelo acúmulo da proteína beta-amiloide. Outra forma de amiloidose localizada é a amiloidose cutânea. Entre as amiloidoses sistêmicas destacam-se três:
- Amiloidose AL: amiloidose sistêmica mais comum. Causada por uma gamopatia monoclonal, mais comumente uma gamopatia monoclonal de significado indeterminado, em que as imunoglobulinas se depositam em diversos sistemas.
- Amiloidose AA: causado pelo acúmulo da proteína amiloide A, um reagente de fase aguda produzido ao longo de anos por doenças inflamatórias crônicas, como osteomielites crônicas, espondiloartropatias não-tratadas, artrite reumatóide e outras doenças.
- Amiloidose ATTR mutada é responsável pelo quadro clássico de cardiomiopatia amiloidótica no idoso.
Algumas das manifestações sistêmicas da amiloidose são:
- Cardíaco: insuficiência cardíaca restritiva (que se comporta como uma ICFEP), com clássicos achados no ecocardiograma de miocárdio cintilante e strain longitudinal global com redução de strain em segmentos basais e médios e preservado na região apical (sinal da cereja no topo ou bandeira do Japão).
- Neurológico: Polineuropatia sensitivo-motora-autonômica de padrão axonal. As disautonomias podem ser significativas e debilitantes.
- Pele: Equimoses periorbitárias (sinal do guaxinim) e macroglossia.
- Rim: Glomerulopatia classicamente causando síndrome nefrótica.
- Hematológico: As proteínas amilóides dispersas no plasma podem recobrir as plaquetas levando a um déficit de agregabilidade plaquetária e disfunção de hemostasia primária. Quanto à hemostasia secundária, essas proteínas amiloides podem afetar o fator X, levando à sua destruição e a déficit de hemostasia secundária.
As proteínas amilóides devem ser identificadas por meio de biópsia de um tecido acometido. No caso das amiloidoses sistêmicas, como o depósito dessas proteínas é difuso, pode-se tentar biopsiar um coxim adiposo, geralmente periumbilical. No caso específico da cardiomiopatia amiloidótica, achados de cardioressonância e cintilografia miocárdica com pirofosfato podem auxiliar no diagnóstico.
Foram solicitados eletroforese de proteínas séricas e urinárias com imunofixação e dosagem de cadeias leves livre no soro. O resultado foi de dosagem de cadeia lambda livre de 20.249 e Kappa livre de 35,4; pico monoclonal em gama na eletroforese de proteínas urinárias, com imunofixação sérica e urinária com cadeia lambda monoclonal. Foi realizada uma biópsia de coxim adiposo que resultou positiva para depósitos amiloides corados pelo vermelho do Congo. O paciente recebeu o diagnóstico de amiloidose AL e foi encaminhado a um centro oncológico para receber tratamento com quimioterapia.
Alguns pontos de aprendizagem sobre o caso que você não pode esquecer:
- O diagnóstico de ICFEP envolve: anamnese, exame físico, eletrocardiograma, radiografia de tórax, BNP/NT-pro-BNP e ecocardiograma. Em casos típicos, esses dados são suficientes para o diagnóstico, mas naqueles duvidosos os escores H2FPEF ou HFA-PEFF podem ajudar.
- O tratamento da ICFEP se baseia em: controle de hipervolemia, controle de comorbidades, reabilitação cardiopulmonar e intervenções farmacológicas (espironolactona e/ou iSGLT2).
- As diáteses hemorrágicas podem ser subclassificadas em distúrbios da hemostasia primária (distúrbios vasculares, plaquetopenia ou disfunção plaquetária) ou secundária (alterações de fatores de coagulação, imunes ou não). Distúrbios da hemostasia secundária iniciando em adultos devem levantar a suspeita de um inibidor.
- Os exames complementares mais importantes na investigação dos distúrbios da hemostasia primária são: contagem de plaquetas e agregabilidade plaquetária. Já os da hemostasia secundária são: TP, TTPa, teste da mistura e dosagem de fatores específicos.
- Amiloidose é o termo para a situação em que há deposição extracelular de proteínas anormais em vários órgãos/tecidos. Na biópsia, as proteínas amilóides têm birrefringência verde-maçã quando coradas pelo vermelho do Congo. A amiloidose AL é a amiloidose sistêmica mais comum e é secundária a uma gamopatia monoclonal. Cardiomiopatia restritiva, polineuropatia, coagulopatia e síndrome nefrótica são manifestações possíveis.
Aproveite e leia:
Infecções Associadas a Cateter Intravascular
As infecções associadas a cateter intravascular são complicações graves. Representam a segunda causa mais comum de infecção adquirida em UTI no Brasil, atrás apenas de pneumonia associada à ventilação mecânica. Essa revisão aborda os principais conceitos, diagnóstico, tratamento e prevenção de infecções associadas a cateteres intravasculares.
Tratamento de Hiponatremia e Mielinólise Pontina
Hiponatremia grave sintomática pode ocasionar complicações ameaçadoras à vida através de edema cerebral. Elevações acima de 12 mEq/L em 24 horas foram classicamente associadas com o surgimento da síndrome de desmielinização osmótica e mielinólise pontina. Em setembro de 2023, um estudo retrospectivo lançado na revista NEJM Evidence comparou diferentes estratégias de correção e avaliou mortalidade, tempo de hospitalização e ocorrência de mielinólise pontina. Este tópico revisa o tratamento de hiponatremia grave, mielinólise pontina e os resultados deste estudo.
Novo Paradigma de Infarto: Oclusão Coronariana Aguda
Uma nova classificação propõe distinguir o infarto agudo do miocárdio conforme a presença ou ausência de oclusão coronariana, em contraste com a abordagem tradicional baseada no supradesnivelamento do segmento ST. Duas publicações recentes reforçam essa proposta. Este tópico explora essa nova perspectiva.
Amiloidose: Manifestações Clínicas e Diagnóstico
Clinicamente, amiloidose representa um grupo de doenças que ocorrem pelo acúmulo de proteínas no extracelular, podendo levar a disfunção orgânica. Em maio de 2024, uma coorte americana extraiu os dados de 1401 pacientes para avaliar quais sintomas já se encontravam aparentes antes do diagnóstico. Este tópico aborda os principais tipos de amiloidose, suas características e como realizar a investigação.
Complicações Não Infecciosas do HIV
Com o maior acesso à terapia anti-retroviral (TARV) para pessoas com HIV, espera-se um aumento na expectativa de vida e redução de complicações infecciosas. Contudo, complicações não-infecciosas relacionadas à doença também podem ocorrer e precisam de reconhecimento. Em maio de 2022, tivemos um revisão sobre o tema na revista Medicine e falamos um pouco sobre o acometimento cardiovascular, pulmonar e renal aqui:
