Urgências Dialíticas
A terapia renal substitutiva (TRS) é o tratamento para disfunção renal grave e pode ser realizada como hemodiálise, diálise peritoneal ou transplante renal. Na injúria renal aguda (IRA) e nas urgências dialíticas, utiliza-se a diálise como terapia de escolha [1]. Esta revisão aborda as urgências dialíticas e aspectos de diálise na IRA.
Quais são as urgências dialíticas?
As seguintes urgências dialíticas são bem estabelecidas [1]:
- Hipercalemia refratária
- Hipervolemia refratária
- Acidose metabólica grave
- Manifestações de uremia: encefalopatia e pericardite
- Intoxicações
Em um estudo brasileiro com 17 mil pacientes, as três principais etiologias de IRA levando a diálise foram sepse, hipovolemia e grandes cirurgias. O motivo mais comum para indicar TRS foi azotemia, mas sem especificação do valor da ureia. Oligúria foi um preditor de maior mortalidade. Pacientes com doença renal crônica têm maior chance de necessitar de TRS durante uma IRA.
Hipercalemia refratária
Níveis elevados de potássio podem ocasionar paralisia muscular e arritmias cardíacas graves (fibrilação ventricular e assistolia) [2]. Hipercalemia é considerada grave quando ocorrem manifestações eletrocardiográficas ou quando K sérico > 6,5 mEq/L.
O primeiro passo ao detectar hipercalemia é excluir pseudohipercalemia. Em seguida, deve-se ao mesmo tempo procurar a causa do distúrbio (veja a figura 1) e começar medidas para reduzir os níveis de potássio.

O tratamento para hipercalemia deve ser iniciado imediatamente quando há alteração eletrocardiográfica ou K sérico > 6,5 mEq/L. A persistência dessas situações mesmo após as medidas clínicas é uma indicação de diálise de urgência [3, 4].
As principais alterações eletrocardiográficas da hipercalemia são (tabela 1):
- Onda T em pico - costuma ser a primeira manifestação
- Aumento do intervalo PR
- Alargamento do QRS
- Desaparecimento da onda P
- Padrão senoidal - antecede a fibrilação ventricular
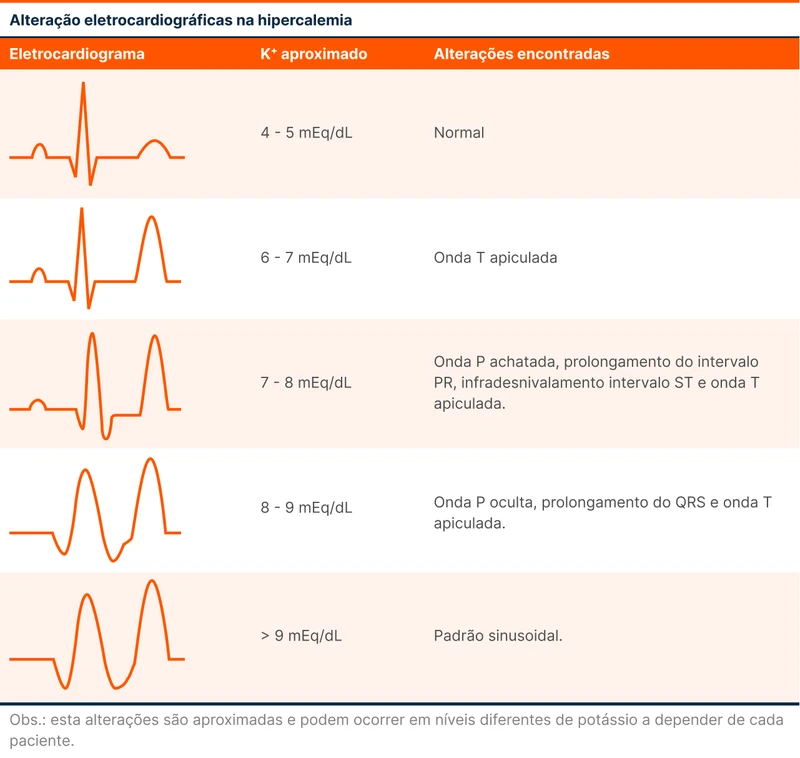
A identificação dessas manifestações pode antecipar o diagnóstico de hipercalemia antes do resultado do exame de sangue, especialmente em pacientes de alto risco para essa condição. Quase sempre uma alteração eletrocardiográfica precede um evento arrítmico grave.
O tratamento da hipercalemia pode ser organizado de acordo com sua finalidade (tabela 2):
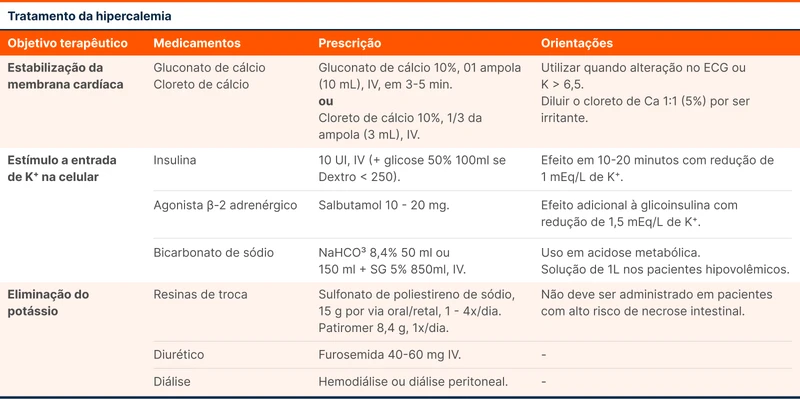
Estabilização da membrana cardíaca
O cálcio intravenoso é usado para estabilizar a excitabilidade do cardiomiócito, reduzindo o risco de arritmia. Está recomendado quando ocorrem alterações eletrocardiográficas ou se o K+ > 6,5 mEq/L [1]. Esse tratamento não reduz os níveis de potássio.
O cálcio pode ser administrado como gluconato ou cloreto de cálcio. A dose do gluconato de cálcio 10% é de 10 ml (1000 mg), que pode ser diluído em 100ml de soro glicosado. A infusão deve ser realizada com monitorização cardíaca contínua e pode ser repetida após 5 minutos caso as alterações eletrocardiográficas persistam. O cloreto de cálcio tem maior concentração de cálcio elementar - três vezes a do gluconato - e causa maior irritação no local de infusão. A dose é de 5 a 10 ml da solução a 10% (500 a 1.000 mg) [5].
Após a infusão, o efeito começa em poucos minutos e dura de 30 a 60 minutos. As doses podem ser repetidas se a urgência persistir. O cálcio não deve ser feito no mesmo acesso que soluções bicarbonatas, pois há risco de precipitação de carbonato de cálcio.
Entrada do potássio na célula
A insulina promove a entrada do K+ para dentro da célula estimulando a atividade da bomba Na-K-ATPase. Caso a glicemia esteja ≥ 250 mg/dL, a insulina pode ser administrada isolada e a glicemia monitorizada de 1/1h nas primeiras 6 horas após a administração. Em caso de glicemia < 250 mg/dL, a insulina deve ser administrada junto com glicose - conhecida como solução polarizante ou glicoinsulina. Não existe uma maneira definitiva de fazer essa solução, mas uma opção é associar dez unidades de insulina de ação rápida com 50 gramas de glicose [5].
Os agonistas do receptor beta-2 também induzem a entrada de K+ na célula aumentando a atividade da bomba Na-K-ATPase. Uma opção bastante disponível é o salbutamol. A dose preconizada é de 10 a 20 mg via nebulização [6]. Taquicardia e doença coronariana são contraindicações relativas, podendo ser feito metade da dose. A terbutalina subcutânea é uma alternativa quando o salbutamol não está disponível [7].
Após a infusão de insulina, o nível sérico de K+ começa a cair em 15 minutos, com redução estimada de 0,6 - 1,0 mEq/L entre 30 a 60 minutos. Essa redução é potencializada combinando com o salbutamol, com redução de 1,2 - 1,5 quando as duas medicações são feitas. O pico de efeito das medidas ocorre em 1 a 2 horas, momento em que um novo potássio pode ser medido para avaliar a resposta. O efeito da glicoinsulina tem duração de 4 a 6 horas.
O bicarbonato de sódio também induz a entrada de potássio na célula, mas o benefício é limitado a situações de acidose metabólica. Recomenda-se administrá-lo junto a uma solução hipotônica nos pacientes que toleram volume adicional. Um exemplo é uma solução com 75 ml bicarbonato de sódio 8,45% e 425 ml de soro glicosado 5%. A infusão de bicarbonato de sódio hipertônico deve ser usada com cautela devido à hipernatremia [8].
Eliminação do potássio
As medidas para eliminar o K+ são os diuréticos, os trocadores catiônicos intestinais e a diálise.
Os trocadores intestinais como o patiromer e o poliestireno sulfonato de sódio (sorcal®) são utilizados no controle crônico do K+. O patiromer reduz cerca de 0,4 mEq/L em quatro horas e pode ser usado no cenário agudo, porém ainda não disponível no Brasil [9].
Representados principalmente pela furosemida, os diuréticos de alça aumentam a excreção renal de potássio. Quando o paciente está hipervolêmico, a furosemida reduz a hipercalemia e garante maior excreção de líquido corporal. Nos pacientes hipovolêmicos, o fluxo distal de sódio precisa ser mantido para ocorrer a excreção do K+. Nesse contexto, a furosemida deve ser administrada após reposição volêmica com solução isotônica [10, 11].
A diálise consegue normalizar os níveis de potássio em quatro horas de tratamento. É o método de escolha na hipercalemia grave refratária e/ou nos pacientes com injúria renal oligúrica/anúrica associada. Deve-se considerar a diálise mais cedo se a causa da IRA é irreversível a curto prazo ou se existe influxo contínuo de potássio para a circulação - como na rabdomiólise e na lise tumoral [11].
As medidas que movem o potássio para o intracelular podem reduzir a eficácia da diálise ao diminuírem a disponibilidade de potássio no espaço extracelular. Além disso, pode ocorrer um rebote mais pronunciado de hipercalemia ao fim da diálise [12, 13].
Hipervolemia refratária
Os diuréticos são o tratamento inicial nesse cenário. Essas medicações são organizadas pelo seu mecanismo de ação (tabela 3) [10].
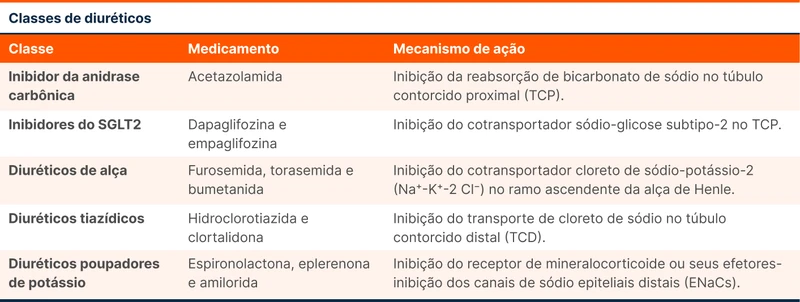
Os diuréticos de alça têm ação diurética rápida e grande efeito no controle do balanço hídrico. Na insuficiência cardíaca (IC) descompensada em hipervolemia, recomenda-se iniciar a furosemida em doses baixas e titular progressivamente a dose de acordo com o débito urinário e balanço hídrico. Nos pacientes usuários prévios de furosemida, a dose de bolus intravenosa recomendada é 2 a 2,5 vezes a dose utilizada em casa. Não parece existir diferença significativa entre a furosemida em bolus versus infusão contínua [10, 14]. Veja mais sobre diuréticos na IC no tópico "Diureticoterapia na Insuficiência Cardíaca Aguda".
Uma das estratégias para otimizar o controle volêmico é a associação de diuréticos. A estratégia de “bloqueio sequencial do néfron” consiste no uso simultâneo de tiazídicos, diuréticos poupadores de K+ e inibidores da anidrase carbônica para otimizar a natriurese e diurese. Essa terapêutica é utilizada no paciente com IC já em uso do diurético de alça mas com resposta inadequada - situação de resistência ao diurético [14, 15].
Nos pacientes hipervolêmicos, a diálise muitas vezes é iniciada quando há anúria persistente (> 24 horas), ausência de resposta aos diuréticos ou quando existe resposta parcial que é incapaz de compensar a sobrecarga hídrica.
Acidose metabólica grave e refratária
A conduta varia conforme a causa da acidose. A reposição de bicarbonato é indicada nas acidoses metabólicas de ânion gap (AG) normal independente do pH e nas acidoses de AG aumentado com acidemia grave [16-18].
Em pacientes em UTI com disfunção orgânica (escore SOFA ≥ 4), lactato ≥ 2 mmol/L e acidemia grave (pH ≤ 7,20, PaCO2 ≤ 45 mmHg e HCO3 ≤ 20 mmol/L), o estudo BICAR-ICU não encontrou benefício no uso do bicarbonato no desfecho primário de mortalidade e disfunção orgânica. Contudo, na análise pré-especificada do subgrupo de pacientes com IRA grave, houve diferença significativa favorecendo o grupo bicarbonato [19].
A TRS é indicada quando há acidose metabólica grave (ph < 7,1), sem resposta a reposição de bicarbonato e/ou quando há efeitos colaterais desse tratamento, em especial a hipernatremia e hipervolemia. Na acidose lática, a TRS é uma medida de suporte até a resolução da causa da hiperlactatemia e não há um valor padrão para início da diálise. Uma exceção dentro das acidoses láticas é a acidose por metformina, situação em que a diálise deve ser iniciada o mais cedo possível [1].
Manifestações de uremia: encefalopatia e pericardite
A IRA grave associa-se a valores elevados de ureia sérica. Não há um valor exato de ureia para início de diálise. A sua elevação pode ocorrer por outros fatores além da injúria renal, como sangramento gastrointestinal e uso de corticoide em altas doses [20, 21].
A encefalopatia urêmica pode se manifestar como alteração do estado mental, convulsões e asterixis (flapping). O diagnóstico é de exclusão e geralmente não ocorre com taxa de filtração glomerular (TFG) > 5 ml/min/1,73 m² [22]. Uremia também pode ocasionar náuseas, vômitos e anorexia, manifestações que também podem motivar diálise no contexto agudo, porém sem o caráter de urgência que sintomas neurológicos mais graves exigem.
Pericardite urêmica também é uma indicação de diálise de urgência. A chance de reversão da pericardite é maior nos pacientes agudos quando comparados com os pacientes crônicos com pericardite urêmica [23].
Intoxicação exógena
Substâncias exógenas ingeridas acidentalmente ou intencionalmente podem ocasionar prejuízos clínicos como distúrbios hidroeletrolíticos, injúria renal, arritmias e até parada cardiorrespiratória. Terapias extracorpóreas como a hemodiálise são usadas para remoção dessas substâncias e atenuar a toxicidade (tabela 4) [24, 25].

Cada intoxicação tem particularidades e recomenda-se sempre a discussão do caso junto a equipe de nefrologia e o centro de assistência toxicológica (CEATOX). A tabela 4 destaca cinco agentes de grande relevância clínica que podem ser removidos por hemodiálise. Esse veja este link do EXTRIP (grupo de tratamento extracorpóreo de intoxicações).
Teste de estresse com furosemida
Não é simples prognosticar uma IRA. O prognóstico acurado auxilia na tomada de decisão quanto a começar ou não a hemodiálise. O teste de estresse com furosemida é uma ferramenta para ajudar a prever a evolução da IRA.
O teste consiste na administração intravenosa de 1,0 ou 1,5 mg/kg de furosemida (dose de 1,5 nos usuários prévios de furosemida) em pacientes com IRA. A resposta adequada é de 200 ml de diurese duas horas após a medicação e representa uma reserva funcional tubular. Quando não há essa resposta, a IRA tem maior chance de evoluir para hemodiálise [26-28].
Momento de iniciar a diálise
Excluindo as urgências dialíticas, ainda não foi estabelecido o momento ideal de início da TRS na IRA. Deve-se considerar a etiologia da IRA e a probabilidade de recuperação da doença de base e da função renal, a disfunção de outros órgãos e a possibilidade de piora da injúria renal. Um dos fatores prognósticos principais é um teste de estresse a furosemida negativo, indicando déficit de função tubular [28-33].
Modalidades de diálise
Entre as modalidades de TRS, não há diferença de mortalidade entre a hemodiálise intermitente e a contínua. A hemodiálise contínua gera melhor preservação da perfusão cerebral e menor remoção de fluídos por tempo, sendo melhor tolerada pelos pacientes neurocríticos e os instáveis hemodinamicamente [34-36].
Na hemodiálise intermitente, a remoção das substâncias é mais rápida que na diálise contínua, sendo vantagem usá-la para remoção de toxinas e pequenos solutos. A escolha da terapia depende da disponibilidade do método, familiaridade dos profissionais e das condições do paciente. A hemodiálise intermitente é a mais utilizada na urgência [37].
A diálise peritoneal (DP) está sendo mais utilizada nos casos de emergência. Algumas dificuldades são a limitação de profissionais habilitados à passagem do cateter de DP, familiaridade dos serviços com a DP e a disponibilidade dos materiais desse método [38-40].
A diálise peritoneal (DP) consegue a depuração das moléculas de K+, ureia e água de forma rápida por essas substâncias rapidamente se moverem pela membrana peritoneal. Isso possibilita a DP ser usada na IRA, ainda com vantagem por melhor tolerância dos pacientes instáveis, por não necessitar de anticoagulação (benefício no alto risco de sangramento) e menor chance de complicações como a síndrome do desequilíbrio osmótico. A DP pode ser realizada com a cicladora ou manualmente, de forma contínua ou intermitente, com ciclos curtos e frequentes para o controle metabólico em 24 a 48 horas [40-42].
Acessos
Para realização dos métodos extracorpóreos, há necessidade de um acesso vascular em uma veia profunda. O KDIGO (Kidney Disease Improving Global Outcomes) recomenda a veia jugular interna direita como primeira escolha, seguido pela veia femoral. A veia jugular esquerda é a terceira opção. A veia subclávia é a última escolha pelo risco de estenose local da veia e posterior comprometimento à confecção de uma fístula arteriovenosa naquele membro [1].
Nos pacientes com IRA sem DRC associada e com maior probabilidade de recuperação da função renal, recomenda-se o cateter de curta permanência. Já em pacientes com maior probabilidade de permanecer em diálise, deve-se passar o cateter tunelizado pelo menor risco de infecção [43, 44].
Monitorização
A avaliação da função renal deve ser realizada com o controle da diurese e exames que guiam a prescrição de diálise. Deve-se monitorizar a creatinina, ureia e eletrólitos pelo menos antes de cada sessão de hemodiálise.
Exames pós-diálise devem ser coletados pelo menos duas horas após o término da sessão, para que ocorra redistribuição das substâncias entre o plasma e os compartimentos intracelulares.
Desmame
No contexto de diálise na IRA, a recuperação da função renal pode ocorrer com a resolução dos problemas clínicos adjacentes. O controle da diurese e evolução dos exames devem ser avaliados diariamente. Em pacientes em diálise contínua, a descontinuação da diálise ocorre em mais de 80% quando há uma diurese maior que 400 mL/dia nos pacientes sem diurético e maior que 2300 mL/dia nos pacientes em uso de diuréticos [45].
Aproveite e leia:
Eletrocardiograma nos Distúrbios Eletrolíticos
Os principais distúrbios eletrolíticos que afetam o eletrocardiograma (ECG) são os distúrbios do potássio, cálcio e magnésio. Essas alterações vão desde achados clinicamente insignificantes até arritmias ameaçadoras à vida. O ECG fornece informações imediatas e respalda condutas de emergência, sem necessidade de aguardar os resultados laboratoriais. O tópico Eletrocardiograma nos Distúrbios Eletrolíticos revisa os principais achados eletrocardiográficos nestas condições.
Encefalopatia Hepática
A encefalopatia hepática é a complicação mais frequente da hepatopatia crônica, está associada a menor sobrevivência e tem alto risco de recorrência. Esta revisão abordará a definição, apresentação clínica, fatores precipitantes e tratamento.
Diureticoterapia na Insuficiência Cardíaca Aguda
Diureticoterapia é a pedra fundamental do tratamento da insuficiência cardíaca (IC) descompensada há mais de 20 anos. Ainda assim, há muitas perguntas sem respostas claras nesse tema. A revisão do mês traz um apanhado do conhecimento atual sobre os diuréticos na IC.
Tratamento da Coronária Não Culpada no Infarto Agudo do Miocárdio
O tratamento do infarto agudo do miocárdio (IAM) envolve a revascularização da coronária acometida. Ainda há dúvidas sobre o manejo de estenoses em coronárias não envolvidas no IAM. O congresso da European Society of Cardiology (ESC) de 2023 trouxe resultados de dois estudos sobre esta situação. Este tópico revisa o tema e traz um resumo dos estudos.
Intercorrências na Hemodiálise
A hemodiálise (HD) é a modalidade de terapia renal substitutiva (TRS) que utiliza a circulação extracorpórea para remover as substâncias dialisáveis e realizar a ultrafiltração (retirada de líquido do organismo). É realizada nos pacientes com injúria renal aguda (IRA) e doença renal crônica (DRC) no contexto hospitalar, nas clínicas de diálise e até em domicílio. As sessões são seguras, mas intercorrências podem acontecer. Esta revisão trata das intercorrências mais importantes durante a hemodiálise.
