Terapia com Células CAR-T
A Nature Reviews publicou uma revisão recente sobre resultados da inovadora terapia com células CAR-T, acrônimo para chimeric antigen receptor (receptor quimérico de antígeno, CAR) e T de linfócitos T [1]. Esse tópico explica o que é esse tratamento e para quais doenças está sendo utilizado.
O que é a terapia com células CAR-T?
As células CAR-T são linfócitos modificados através de engenharia genética. O processo começa com a retirada de sangue do paciente e isolamento de seus linfócitos T em laboratório. Uma vez isolados, um novo segmento de DNA é introduzido nas células T através de um vetor viral. Esse novo segmento codifica uma proteína que funcionará como receptor na superfície celular. Esse receptor tem duas partes com origens diferentes: uma extracelular, com alta afinidade para reconhecer um antígeno do tumor; uma intracelular, capaz de ativar o linfócito se houver reconhecimento do antígeno. Por esse novo receptor ser uma proteína formada pela junção de genes que codificam proteínas distintas, ele é chamado de quimérico ou proteína de fusão.
Esse procedimento dá a capacidade de destruição de células que expressam os alvos antigênicos escolhidos. Quando são infundidos de volta ao paciente, os linfócitos passam a atacar as células do tumor. Esse vídeo do Instituto Butantan explica o procedimento. Nas semanas anteriores à terapia, o paciente precisa receber quimioterapia para depletar os linfócitos e permitir que as células CAR-T consigam se proliferar no organismo. A quimioterapia mais efetiva e a dose ainda são desconhecidas, mas o esquema mais usado é fludarabina associada a ciclofosfamida.
Quais doenças podem ser tratadas com a terapia CAR-T?
Atualmente, há quatro terapias CAR-T direcionadas para CD19 e duas para o antígeno BCMA aprovadas pelo Food and Drug Administration (FDA, órgão dos EUA de controle dos medicamentos).
A terapia com células CAR-T direcionadas ao CD19, expressado por células B malignas, demonstrou bons resultados para pacientes com neoplasias malignas de células B refratárias ou recidivadas. Mais recentemente, a terapia CAR-T direcionada para o BCMA teve resultados favoráveis para pacientes com mieloma múltiplo. As terapias CAR-T aprovadas pelo FDA estão na tabela 1.
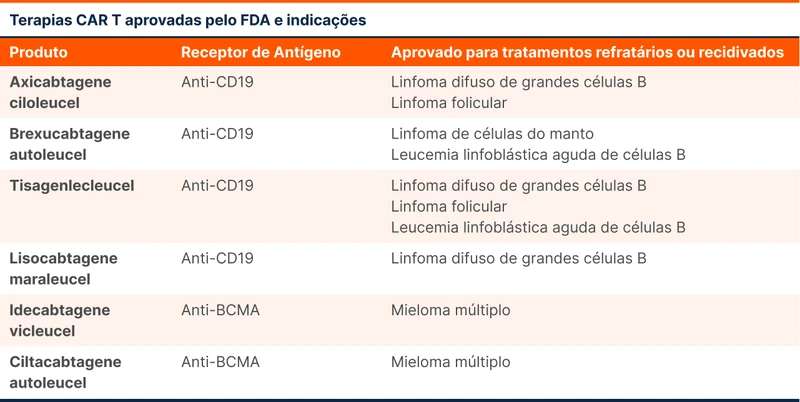
Para os linfomas de células B, a resposta geral é de 44 a 91% dos pacientes e a resposta completa ocorre entre 28 a 68% após dois anos da terapia. Todos os estudos mostram que alguns pacientes mantêm resposta mesmo após dois anos do tratamento sem tratamentos de consolidação associados. As taxas de remissão completa de longo prazo são em torno de 76% para quem teve resposta completa inicialmente [2]. Outro estudo indica remissão de 60% após cinco anos da terapia, entre os que atingiram remissão completa inicialmente [3]. Esses resultados indicam que alguns pacientes com linfoma de células B refratários ou recidivados possivelmente estão curados da doença.
Para mieloma múltiplo há menos dados por ser uma indicação mais nova. Os dados até o momento indicam que esses pacientes podem ter remissões prolongadas mas seguem com risco de progressão da doença ao longo do tempo.

Colocamos alguns fatores associados a remissões duráveis na tabela 2.
Quais são os efeitos colaterais do tratamento CAR-T?
A terapia CAR-T pode levar a eventos adversos agudos ou de longo prazo. Entre os eventos agudos estão a síndrome de liberação de citocinas, neurotoxicidade, citopenias e infecções. Em relação aos efeitos de longo prazo, destacam-se a aplasia medular por depleção de linfócitos B, hipogamaglobulinemia e infecções.
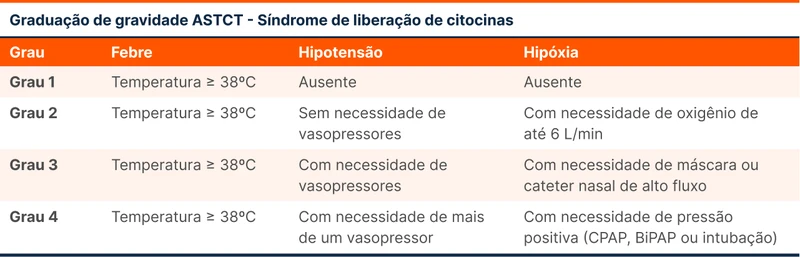
A terapia CAR-T causa uma potente resposta imune, responsável pelo sucesso no tratamento das neoplasias. Essa mesma resposta pode levar a liberação intensa de citocinas e inflamação sistêmica com risco de vida, situação conhecida como síndrome de liberação de citocinas [4]. Febre, mialgia e fadiga são os sintomas mais comuns. Choque por extravasamento capilar, hipóxia e disfunções orgânicas ocorrem nos casos graves. A graduação de gravidade dos quadros está na tabela 3 [5]. O tratamento padrão para quadros graves é a imunossupressão com tocilizumabe com ou sem a adição de corticoides.
Anemia, trombocitopenia e neutropenia são toxicidades agudas comuns e podem permanecer por mais de três meses após a infusão. O risco de infecção aumenta em quem recebe CAR-T, principalmente no primeiro mês da infusão, mas menos do que o esperado com outras terapias com múltiplas linhas de quimioterapia.
O CD19 também é expressado em células B que não são malignas e o BCMA em plasmócitos não malignos. Isso significa que a longo prazo pode ocorrer depleção dessas células, mesmo anos após a infusão. A depleção da imunoglobulinas é uma consequência disso e pode persistir por anos em pacientes que recebem terapia direcionada ao CD19. Isso também ocorre na terapia com alvo no BCMA. Os pacientes que desenvolvem hipogamaglobulinemia recebem reposição de imunoglobulinas, apesar de não existirem dados que indiquem se isso deve ser feito para todos os pacientes ou não.
Atualmente, não há evidências que indiquem que a terapia CAR-T possa aumentar o risco de malignidades secundárias.
Aproveite e leia:
Plasmaférese
Plasmaférese é a remoção extracorpórea do plasma sanguíneo com troca por um fluido de reposição. Esse procedimento é realizado para tratamento de doenças neurológicas, hematológicas e renais. Este tópico aborda aspectos técnicos e revisa as principais indicações.
Reposição de Ferro na Insuficiência Cardíaca
Pacientes com insuficiência cardíaca (IC) tem altas taxas de deficiência de ferro. Rastrear e tratar ferropenia em pacientes com IC pode levar a melhores desfechos. No congresso da American Heart Association (AHA) de novembro de 2022, foi publicado o estudo IRONMAN, que avaliou infusão de ferro intravenoso em pacientes com IC e ferropenia. Aproveitamos para revisar o tema neste tópico.
Antibióticos nos Cuidados Paliativos
O tratamento de infecções em pacientes em fase final de vida gera dúvidas. Uma revisão da Infectious Diseases Society of America (IDSA) sobre uso de antibióticos em cuidados paliativos foi publicada em fevereiro de 2024. Este tópico traz os principais aspectos sobre o tema.
Linfoma de Burkitt
O linfoma de Burkitt é um linfoma agressivo com manifestações clínicas expressivas. Aproveitando uma revisão recente do New England Journal of Medicine, vamos passar pelos principais pontos dessa doença.
Tromboembolismo no Paciente com Câncer
Em 2021 a American Society of Hematology publicou uma diretriz sobre tromboembolismo venoso (TEV) em pacientes com câncer. Um tema comum na prática hospitalar e ambulatorial. Vamos checar as principais recomendações.
