Reações Transfusionais
Variando de autolimitadas até ameaçadoras à vida, as reações transfusionais são comuns na prática hospitalar. Essa revisão aborda as principais reações e a conduta diante delas. Uma referência nacional para o tema é o "Guia para uso de Hemocomponentes" do Ministério da Saúde [1].
Definições
O primeiro conceito é a distinção entre hemocomponentes e hemoderivados.
- Hemocomponentes: produzidos nos centros de hemoterapia a partir de sangue total tratado por processos físicos, como centrifugação e congelamento. Exemplos: concentrados de hemácias, concentrados de plaquetas, plasma fresco congelado e crioprecipitado.
- Hemoderivados: produzidos a partir de fracionamento a nível industrial de amostras de plasma, com o objetivo de concentrar determinada(s) substâncias desejadas. Exemplos: albumina humana, concentrado de complexo protrombínico e concentrado de fator VIII.
Esta revisão aborda exclusivamente as reações transfusionais dos hemocomponentes.
As reações transfusionais podem ser organizadas em imediatas/agudas e tardias. As reações agudas são aquelas em que o quadro clínico surge em até 24 horas do início da transfusão. A maioria das reações agudas ocorre durante a transfusão, especialmente nos primeiros 15 minutos. Nas reações tardias os sinais e sintomas se iniciam após 24 horas da transfusão.

A reação alérgica ao hemocomponente é a reação mais comum. Em segundo lugar vem a reação febril não hemolítica e em terceiro a TACO (comentada mais à frente). Todas as outras são mais raras, ocorrendo em menos de 0,1% dos casos.
Abordagem inicial
O atendimento inicial do paciente com reação transfusional pode ser organizado em uma sequência de seis passos.
- Pausar a infusão do hemocomponente. Essa conduta fornece tempo para entender o tipo de reação e evita piora do quadro com mais volume de hemocomponente. A bolsa e o equipo não devem ser descartados, pois podem ser úteis para o diagnóstico da reação. Por exemplo, na suspeita de contaminação bacteriana da bolsa, podem ser coletadas culturas do hemocomponente da bolsa ou do equipo.
- Avaliação do quadro clínico e sinais vitais.
- Checar a identificação do paciente e da bolsa. Essa checagem deve ser feita com pelo menos duas maneiras diferentes de identificação. Exemplos: nome do paciente, data de nascimento, prontuário e nome da mãe.
- Contactar o banco de sangue. Médicos especialistas podem auxiliar na investigação diagnóstica e no manejo da reação transfusional.
- Conduta específica baseada no sintoma guia do paciente. Discutida na próxima seção "Abordagem sindrômica".
- Notificar reação transfusional.
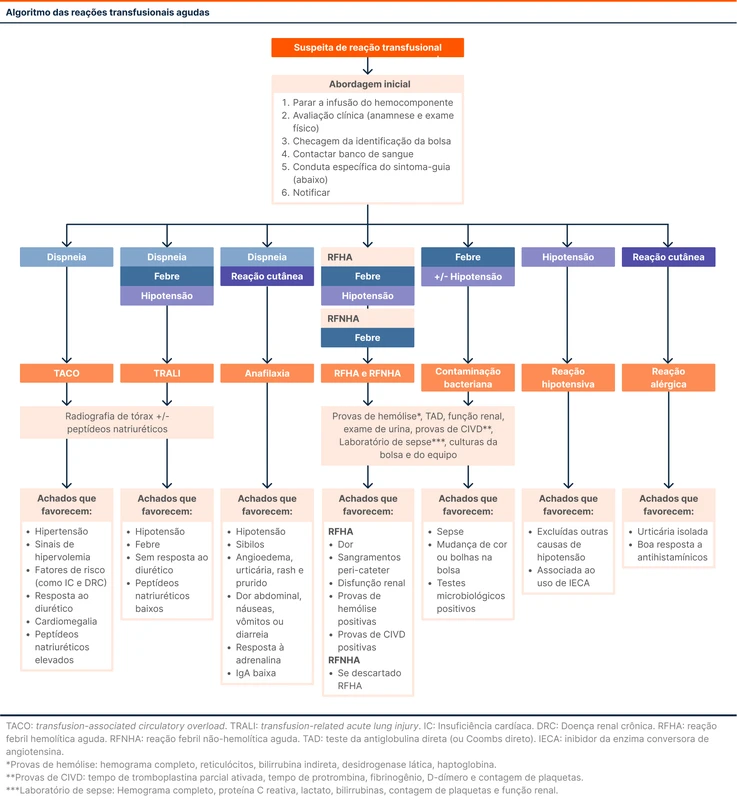
Após a abordagem inicial, as condutas seguintes são determinadas pelo quadro clínico. Existem quatro sintomas guia mais comuns nas reações transfusionais: dispneia, febre, hipotensão e reações cutâneas (veja fluxograma 1).
Dispneia
Quatro reações transfusionais podem ter a dispneia como manifestação mais intensa: TACO, TRALI, anafilaxia e reação transfusional dispneica. As três primeiras são as mais graves e devem ser pensadas primeiro. A reação transfusional dispneica é uma dispneia idiopática que ocorre durante a transfusão e que deve ser considerada após exclusão das outras condições.
TACO:
TACO é a sigla para transfusion-associated circulatory overload - do inglês, sobrecarga circulatória associada à transfusão. O nome é descritivo e nessa situação o hemocomponente funciona como uma carga volêmica adicional. Todas as situações que diminuem a tolerância a fluidos são fatores de risco para TACO: insuficiência cardíaca, idade avançada, transfusões de grandes volumes, balanço hídrico positivo prévio e insuficiência renal.
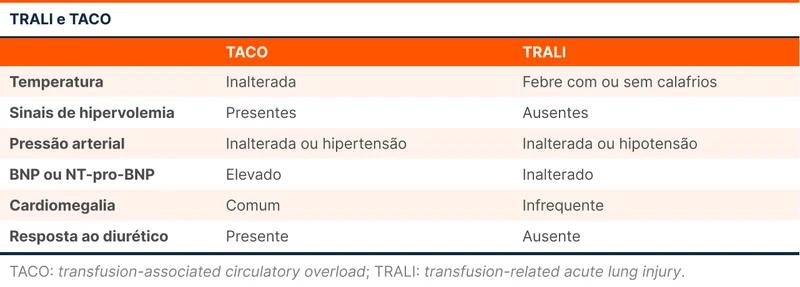
O diagnóstico de TACO é clínico. Além de dispneia por edema pulmonar, sinais de hipervolemia favorecem a hipótese, como: crepitações, edema periférico, turgência jugular, hepatomegalia e hipertensão. Radiografia de tórax com sinais de congestão e elevação de BNP ou NT-pro-BNP podem ajudar em casos duvidosos (veja mais no tópico Peptídeos Natriuréticos).
O manejo envolve pausar a infusão e tratar o edema pulmonar. A principal medicação para descongestão é a furosemida e a dose é individualizada, podendo-se utilizar protocolos similares aos do edema agudo de pulmão (veja mais no tópico Diureticoterapia na Insuficiência Cardíaca Aguda). Oxigênio e ventilação não invasiva devem ser usados se necessário.
Todas as medidas que evitam hipervolemia ajudam a prevenir TACO. Prescrever diuréticos antes da infusão do hemocomponente pode ser necessário. Em pacientes em hemodiálise, prefere-se a infusão antes ou durante a sessão de hemodiálise. Quando a tolerância a fluidos é muito reduzida, uma opção é solicitar o hemocomponente em alíquotas - ou seja, fracioná-lo em bolsas menores. Isso permite fazer a transfusão mais lentamente, já que cada hemocomponente tem um tempo máximo para ser administrado - em caso de hemácias, por exemplo, no máximo quatro horas.
TRALI:
TRALI é a sigla para transfusion-related acute lung injury - do inglês, lesão pulmonar aguda relacionada à transfusão. É um tipo de edema pulmonar não cardiogênico relacionado à transfusão, levando a insuficiência respiratória hipoxêmica. A hipótese para o mecanismo da TRALI é que anticorpos anti-HLA ou anti-neutrófilos do doador presentes no hemocomponente se ligam a antígenos nos vasos pulmonares. Os complexos antígeno-anticorpo causam lesão do parênquima pulmonar em um padrão similar a síndrome da angústia respiratória do adulto (SARA).
O quadro clínico geralmente se inicia nas primeiras seis horas após o início da transfusão. Além de dispnéia, febre com ou sem calafrios e hipotensão podem ocorrer. O diagnóstico é clínico e se baseia na presença de SARA sem outro fator causal aparente. A definição de SARA segue conforme os critérios de Berlim:
- Lesão pulmonar em um período de até sete dias
- Infiltrado pulmonar alveolar bilateral
- Relação PaO2/FiO2 < 300
- Quadro clínico não completamente explicado por hipervolemia ou insuficiência cardíaca
Quando existe outra causa de SARA além da transfusão, o diagnóstico de TRALI não pode ser definido com certeza. A temporalidade também ajuda, já que a presença de sintomas respiratórios antes da transfusão coloca o diagnóstico em dúvida. Alguns centros podem realizar dosagem de anticorpos anti-HLA na bolsa de hemocomponente para auxílio diagnóstico. A diferenciação com TACO pode ser difícil, apesar de TACO ser muito mais prevalente que TRALI. Um comparativo pode ser visto na tabela 2.
O tratamento envolve pausar transfusão e iniciar medidas de suporte para SARA conforme as diretrizes dessa condição. Para saber mais,veja os episódios Episódio 92 - SDRA Parte 1 - Abordagem Inicial e Episódio 92 - SDRA Parte 2 - Tratamento.
Em relação à prevenção, os bancos de sangue brasileiros não utilizam doações de pessoas com fatores de risco para produção de anticorpos anti-HLA ou anti-neutrófilos.
Anafilaxia:
Reação de hipersensibilidade do tipo I. Proteínas presentes na bolsa de hemocomponente causam a anafilaxia no paciente. Essa reação é mais comum em pessoas com deficiência de IgA, pois essa população pode desenvolver anticorpos anti-IgA e reagir com IgA da bolsa.
Costuma ocorrer bem no começo da transfusão. O quadro clínico é o habitual de anafilaxia, geralmente envolvendo manifestações em pelo menos dois dos quatro sistemas abaixo:
- Cutâneas: rash, urticária, prurido e angioedema.
- Respiratórias: dispneia, broncoespasmo e broncorreia.
- Gastrointestinais: náuseas, vômitos, dor abdominal e diarreia.
- Cardiovasculares: hipotensão arterial, síncope e pré-síncope.
Como nas outras situações, o diagnóstico é clínico. Além de pausar a infusão, deve-se administrar adrenalina intramuscular na dose de 0,3 a 0,5 mg a cada 5 minutos até controle do quadro. Podem ser também administrados anti-histamínicos, broncodilatadores e corticoides, mas estes não devem atrasar a adrenalina.
Em pacientes com anafilaxia transfusional devem ser pesquisadas deficiência de IgA e presença de anticorpos anti-IgA. Se houver deficiência de IgA, está indicada a transfusão de hemocomponentes lavados. Os hemocomponentes lavados passam por múltiplas lavagens com cloreto de sódio, com o objetivo de diminuir a quantidade de IgA na bolsa.
Para revisão direcionada de anafilaxia, veja o Episódio 95: Anafilaxia.
Febre
Entre as reações transfusionais em que a febre é o sintoma guia, destacam-se três: contaminação bacteriana da bolsa, reação febril hemolítica aguda e reação febril não-hemolítica aguda. A TRALI foi discutida na sessão anterior porque o sintoma proeminente é a dispneia, mas também pode cursar com febre.
Contaminação bacteriana:
Consiste na contaminação da bolsa do hemocomponente com bactérias previamente à transfusão. Mais comum em concentrados de plaquetas, que ficam estocados a temperaturas mais elevadas. Os agentes etiológicos são principalmente os Gram positivos, mas há também infecções por Gram negativos.
O quadro clínico é de uma síndrome inflamatória, compatível com infecção de corrente sanguínea. Febre com ou sem calafrios é a marca do quadro, mas sepse pode ocorrer. Alterações no aspecto do hemocomponente podem ser encontradas.
Deve-se solicitar exames para pesquisa de disfunções orgânicas (creatinina, bilirrubinas, gasometria, plaquetas), lactato e culturas do sangue do paciente, do equipo de infusão e da bolsa do hemocomponente. Essas duas últimas culturas geralmente são feitas pelo banco de sangue, por isso não deve-se descartar a bolsa e o equipo até que o banco de sangue oriente. Sempre considerar que as manifestações infecciosas podem ser de outro foco.
A infusão deve ser pausada e antibioticoterapia iniciada.
Reação febril hemolítica aguda:
Ocorre pela exposição do paciente a um antígeno eritrocitário contra o qual já possui anticorpos. Isso acontece mais comumente por erros na identificação ou administração do hemocomponente, resultando na infusão de uma bolsa não compatível com a tipagem ABO do paciente. Também pode ocorrer devido a presença de exposição paciente do receptor a outros antígenos eritrocitários que não são do grupo ABO.
O quadro costuma ser grave. Além da febre com ou sem calafrios, uma manifestação característica é a dor em dorso/lombar, abdome ou sítio de infusão. As dores ocorrem porque a hemólise intravascular libera hemoglobina livre no sangue, capaz de quelar o óxido nítrico e induzir vasoconstrição e espasmos viscerais. Hemoglobinúria (mais visível em pacientes sondados), disfunção renal e coagulação intravascular disseminada também podem surgir. Atentar para sangramento ao redor de óstios de acessos venosos ou intensificação de sangramentos prévios.
O diagnóstico é clínico e laboratorial. Os seguintes exames fazem parte da avaliação inicial:
- Marcadores de hemólise: hemoglobina, reticulócitos, lactato desidrogenase, bilirrubina indireta e haptoglobina.
- Testes da antiglobulina direta e indireta (Coombs), que ajudam a confirmar que o mecanismo da hemólise é imunológico.
- Exame de urina, que sugere hemoglobinúria quando a fita reagente (dipstick) é positiva para sangue, porém não há hematúria na análise do sedimento à microscopia ou análise automatizada.
- Marcadores de coagulação intravascular disseminada: contagem de plaquetas, tempo de protrombina, tempo de tromboplastina parcial ativada, fibrinogênio e D-dímero.
Muitos bancos de sangue realizam nova tipagem ABO, teste da antiglobulina direta, pesquisa de anticorpos irregulares e prova cruzada nas amostras pré-transfusionais do paciente e da bolsa para confirmar erros de identificação do hemocomponente. Este é mais um exemplo da importância de não descartar o hemocomponente e seu equipo até que seja orientado pelo banco de sangue.
Além de cessar a infusão imediatamente, o tratamento envolve hidratação venosa. Não há consenso sobre o volume a ser administrado, mas uma possibilidade é a infusão entre 200 a 300 ml/h de cristalóide, objetivando diurese de cerca de 1 ml/kg/h ou 100 ml/h. A intenção da hidratação é evitar a nefrotoxicidade por pigmentos. Na presença de coagulação intravascular, podem ser necessárias transfusões de plaquetas, plasma fresco congelado ou crioprecipitado.
A prevenção dessa complicação envolve protocolos de dupla checagem de identificação pela equipe antes da instalação do hemocomponente.
Reação febril não hemolítica aguda:
Essa é a reação transfusional febril mais comum. Acredita-se que ocorra por citocinas presentes na bolsa do hemocomponente, causando febre sem maiores consequências ao paciente.
O principal sintoma é febre com ou sem calafrios e ausência de outros sinais que caracterizam os quadros mais graves já descritos. Podem ocorrer náuseas, vômitos e cefaléia.
O diagnóstico é de exclusão e retrospectivo. Outras reações transfusionais mais graves podem se manifestar inicialmente apenas com febre com ou sem calafrios. Apesar de comum, deve-se sempre considerar a possibilidade de reações mais graves antes de assumir o diagnóstico de reação febril não hemolítica.
O manejo envolve cessar a infusão do hemocomponente e administrar antitérmicos.
Em alguns centros, é possível fazer a avaliação clínica e laboratorial rapidamente. Se o tempo necessário para caracterizar o diagnóstico de reação febril não hemolítica for de no máximo quatro horas após a retirada do hemocomponente do banco de sangue, o mesmo hemocomponente pode ter sua infusão reiniciada. Na prática, o tempo necessário para a avaliação clínico-laboratorial frequentemente excede este período, sendo mais comum não retomar a infusão do hemocomponente envolvido.
A filtragem do hemocomponente diminui a chance de reação febril não hemolítica. Em pacientes com dois ou mais episódios de reação febril não hemolítica, está indicada a prescrição de hemocomponentes filtrados - também chamados de hemocomponentes desleucotizados.
Hipotensão
São quatro as principais reações que podem chamar atenção por hipotensão: contaminação bacteriana, anafilaxia, TRALI e reação transfusional hipotensiva. Anafilaxia e TRALI foram discutidas na sessão de dispneia; Contaminação bacteriana foi discutida na sessão de febre.
Reação transfusional hipotensiva:
O mecanismo dessa reação é incerto. É mais comum em pacientes usuários de inibidores da enzima conversora de angiotensina (iECA). Acredita-se que durante a estocagem da bolsa exista produção de bradicinina e que quando infundida pode causar a reação. Os iECA dificultam a degradação da bradicinina, potencialmente explicando o predomínio nesse grupo.
O quadro é de hipotensão isolada e o diagnóstico é de exclusão. Outras reações que cursam com hipotensão devem ser descartadas.
Pode-se optar por suspender ou trocar o iECA por outra droga.
Reações cutâneas
A principal representante desse grupo é a reação alérgica, que é a reação transfusional mais comum. A anafilaxia também pode se manifestar dessa maneira, devendo sempre ser suspeitada. Anafilaxia foi discutida na sessão de dispneia.
Reação alérgica:
É uma reação de hipersensibilidade do tipo I a antígenos do doador aos quais o paciente já era sensibilizado. Ocorre mais comumente em transfusões de plaquetas ou plasma fresco congelado, já que possuem mais plasma e, portanto, mais proteínas plasmáticas potencialmente alergênicas.
Os sintomas cutâneos mais comuns são urticária e prurido. Sinais de anafilaxia devem ser sempre pesquisados e sua ausência ou presença documentados em prontuário.
O tratamento envolve cessar a infusão e administrar um anti-histamínico. Uma opção é a difenidramina via intravenosa na dose de 25 a 50 mg. Se os sintomas forem bem controlados com o anti-histamínico, o que leva em média de 30 a 60 minutos, a infusão pode ser retomada.
Em pacientes com dois ou mais episódios de reação alérgica, alguns autores sugerem a administração preventiva de anti-histamínicos antes da infusão dos próximos hemocomponentes. Não existe evidência sólida que apoie essa conduta, com alguns trabalhos sugerindo não ser efetiva [2]. Em casos refratários à pré-medicação, pode ser administrado hemocomponente lavado.
Reações tardias
A reação febril hemolítica tardia ocorre pelo desenvolvimento de anticorpos contra antígenos presentes nas hemácias do doador. Muitos pacientes são assintomáticos, demonstrando apenas positividade do teste de Coombs. É uma causa de febre não infecciosa entre 1 e 28 dias após a transfusão. Incremento inapropriado do hematócrito e sinais leve de hemólise podem ocorrer.
A conversão sorológica é o evento adverso de infecções adquiridas por meio de transfusão. Mais comum no Brasil antes de 1992 e 1993. Muito rara atualmente.
A doença do enxerto vs. hospedeiro, lembrada em pacientes com transplante de medula, pode ocorrer também após transfusão de hemocomponentes. É um evento raro, grave e multissistêmico. Sintomas como febre, diarreia, alterações cutâneas, hepatomegalia e citopenias podem ocorrer.
A púrpura pós-transfusional simula uma púrpura trombocitopênica imune e deve ser lembrada em plaquetopenias sem causa clara após uma transfusão.
Dúvidas comuns
É permitido transfundir um paciente com febre?
Não existe contraindicação formal, mas preferencialmente deve-se controlar a febre antes da transfusão. A recomendação é porque a febre dificulta a identificação e interpretação de uma reação febril. Em situações de emergência, é autorizado transfundir um paciente febril.
É possível voltar a infundir hemocomponente implicado em uma reação transfusional?
Apenas nos casos de reação alérgica controlada com anti-histamínico, reação febril não-hemolítica ou TACO controlada. Na prática, isso só costuma ser possível no primeiro caso.
É permitido infundir hemocomponentes em locais com menor assistência?
É preferível transfundir em locais que contem com enfermeiro e médico para atendimento de potenciais intercorrências.
Aproveite e leia:
Transfusão de Plaquetas Antes do Acesso Venoso Central
A garantia da agregação plaquetária é essencial para a segurança de procedimentos como a passagem de cateter venoso central. Um estudo publicado no New England Journal of Medicine (NEJM) em maio de 2023 avaliou a transfusão de plaquetas antes da punção de um cateter venoso central. Este tópico revisa as indicações e orientações na transfusão de plaquetas e traz os resultados do estudo.
Tenecteplase no AVC Isquêmico
A trombólise intravenosa é a terapia de reperfusão mais utilizada e disponível para o tratamento do acidente vascular cerebral isquêmico agudo. O uso vem sendo consolidado há aproximadamente 30 anos em estudos com o trombolítico alteplase. A tenecteplase é um trombolítico com a vantagem de ser administrado em bolus e tem sido estudado nesse contexto. Esse tópico revisa a trombólise intravenosa no AVC e traz as evidências de tenecteplase.
Infecções Associadas a Cateter Intravascular
As infecções associadas a cateter intravascular são complicações graves. Representam a segunda causa mais comum de infecção adquirida em UTI no Brasil, atrás apenas de pneumonia associada à ventilação mecânica. Essa revisão aborda os principais conceitos, diagnóstico, tratamento e prevenção de infecções associadas a cateteres intravasculares.
Controle de Glicemia no Paciente Internado
Hiperglicemia hospitalar está associado a piores desfechos e maior risco de complicações. Em julho de 2024, a Sociedade Brasileira de Diabetes (SBD) publicou uma diretriz com recomendações práticas sobre hiperglicemia em pacientes não críticos no hospital. A Society of Critical Care Medicine (SCCM) também trouxe atualizações sobre metas e indicações do controle glicêmico no paciente crítico. Este tópico aborda o controle de glicemia no paciente internado.
Piperacilina-Tazobactam e Cefepima: Uso Empírico e Riscos Associados
Piperacilina-tazobactam e cefepime são as principais opções quando há risco de infecção por bacilos gram-negativos resistentes, incluindo Pseudomonas. Existem discussões sobre a nefrotoxicidade relacionada à piperacilina-tazobactam e a neurotoxicidade do cefepima. O estudo ACORN, apresentado na IDWeek e publicado no Journal of the American Medical Association (JAMA) em outubro de 2023, avaliou esses riscos. Este tópico analisa as evidências prévias e os resultados do ACORN.
