Manejo de Pancreatite Aguda Grave
Pacientes com pancreatite aguda evoluem com sinais de gravidade em 15 a 25% dos casos. A mortalidade da pancreatite grave é de até 50%. Em junho de 2023, foi lançado um artigo na Intensive Care Medicine com dez dicas práticas sobre o manejo da pancreatite grave [1]. Este tópico revisa os principais pontos da publicação.
Como avaliar a gravidade na pancreatite aguda?
A gravidade da pancreatite aguda é definida pelos critérios de Atlanta revisados (veja tabela 1). A presença e a persistência de disfunções orgânicas definem a pancreatite em leve, moderadamente grave e grave. A avaliação de disfunções orgânicas pode ser feita pelo escore de Marshall modificado, que considera disfunção respiratória, cardiovascular e renal.

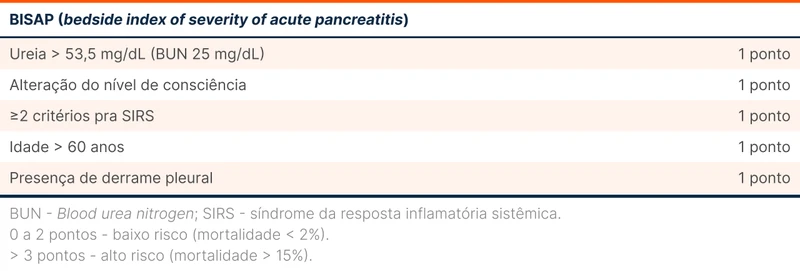
A identificação precoce de paciente sob risco de desenvolver pancreatite grave pode ser feita por escores como APACHE II, SIRS (systemic inflammatory response syndrome), BISAP (bedside index of severity of acute pancreatitis) e Ranson. O BISAP é um escore aplicável nas primeiras 24 horas de doença, à beira leito. Neste escore são avaliados os critérios de SIRS e outras quatro características - idade, alteração neurológica, ureia e derrame pleural (veja tabela 2). Uma pontuação maior ou igual a três está associada a aumento de mortalidade.
Hematócrito maior que 44% é fator de risco independente para desenvolver necrose pancreática [2]. A presença de necrose, principalmente infectada, é um marcador de pior prognóstico.
Pacientes com qualquer disfunção orgânica devem receber monitorização contínua, conforme recomendação da diretriz da World Society of Emergency Surgery de 2019 [3]. Indivíduos com choque, insuficiência respiratória ou outra disfunção persistente por mais de 48 horas devem ser internados em UTI.
Hidratação
Hidratação venosa é recomendada como tratamento inicial na pancreatite aguda, com atenção para ocorrência de sobrecarga volêmica. A orientação atual é de hidratação com 10 mL/Kg em bolus, seguido de 1,5 mL/kg/h por 24 a 48 horas.
Algumas metas de ressuscitação também são recomendadas. Dentre elas, estão [4]:
- Estabilização hemodinâmica - frequência cardíaca menor que 120 bpm e pressão arterial média maior que 65 mmHg.
- Resolução da hemoconcentração - hematócrito menor que 44%.
- Melhora da função renal - débito urinário maior que 0,5 mL/kg/h.
A estratégia de ressuscitação volêmica agressiva (20 mL/kg em bolus seguido de 3 mL/kg/h) está associada a maior risco de congestão e deve ser evitada [5]. Veja mais sobre o assunto no tópico sobre fluidos na pancreatite aguda.
Analgesia
Dor abdominal é um sintoma frequente na pancreatite aguda. Geralmente é necessária a associação de opióides fortes (morfina e fentanil transdérmico ou endovenoso) a outros analgésicos (dipirona, paracetamol e anti-inflamatórios).
O uso precoce de opioides fortes garante melhor controle da dor e evita o escalonamento da terapia analgésica [6]. Apesar de estudos mostrarem espasmo do esfíncter de Oddi com o uso de morfina, não há evidências de desfecho clínico desfavorável com uso de qualquer opióide [7].
Quando iniciar dieta?
Dieta via oral pode ser iniciada nas primeiras 24 horas para pacientes com pancreatite grave que não apresentam sinais de íleo paralítico (náuseas, vômitos e distensão abdominal). Recomenda-se dieta leve hipogordurosa e progressão conforme tolerância.
A analgesia deve ser otimizada após introdução da dieta, se necessário. O aumento isolado de enzimas pancreáticas não deve impedir a progressão da dieta.
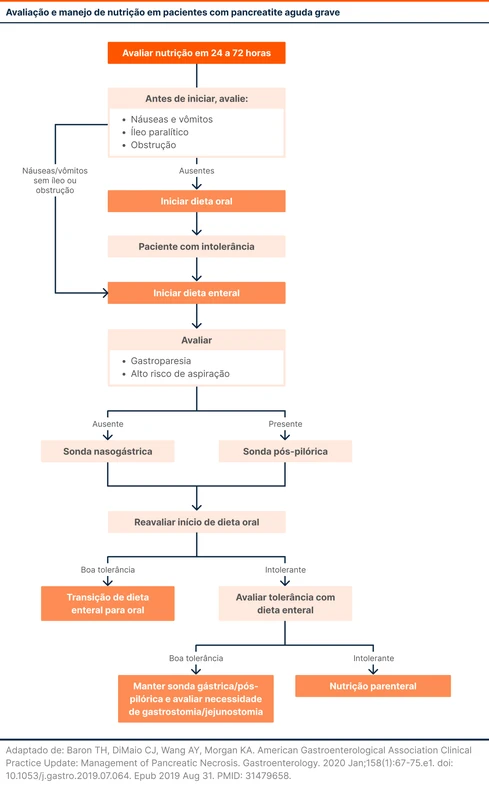
Em pacientes que não toleram a dieta oral, a dieta enteral é preferível ao uso da dieta parenteral. A dieta enteral reduziu risco de mortalidade, infecção hospitalar e tempo de internação, comparada à parenteral [8]. Não há preferência entre sonda gástrica ou pós-pilórica [9]. Veja o fluxograma 1 com um manejo prático de suporte nutricional na pancreatite aguda.
Como manejar necrose pancreática?
Todo paciente com pancreatite aguda grave deve fazer tomografia computadorizada de abdome com contraste ou ressonância magnética com 72 a 96 horas após o início dos sintomas [3]. A tomografia permite avaliar a gravidade usando o escore de Balthazar e detectar complicações.

Necrose pancreática pode ocorrer em até 20% dos pacientes com pancreatite aguda. Inicialmente, o conteúdo necrótico é estéril, mas pode infectar. Não há indicação de antibioticoterapia profilática na presença de necrose sem infecção [10]. A infecção do tecido necrótico costuma ser grave e tende a ocorrer mais tardiamente, por volta de dez dias após o início dos sintomas de pancreatite.
O diagnóstico de necrose infectada é clínico e suspeitado quando há piora no curso da doença. A tomografia pode auxiliar no diagnóstico quando há presença de gás na coleção necrótica pancreática ou peripancreática. Este achado está presente somente em metade dos casos.
Na suspeita de necrose infectada, há indicação de antibioticoterapia empírica com cefalosporina de terceira geração associada a metronidazol, quinolonas ou carbapenêmicos.
A diretriz da American Gastroenterological Association não recomenda drenagem rotineira da coleção para cultura. O procedimento deve ser reservado para pacientes com resposta inadequada à terapia antimicrobiana [11, 12]. Em casos de sepse, deve ser considerada drenagem para controle de foco.
Aproveite e leia:
Caso Clínico #21
Homem de 48 anos procura o pronto-socorro por diarreia e vômitos há um dia.
Oseltamivir na Infecção por Influenza
Oseltamivir é um antiviral recomendado para o tratamento de infecção por influenza em pacientes de alto risco. Em junho de 2023 foi publicada no Journal of the American Medical Association uma revisão sistemática e meta-análise para avaliar o uso de oseltamivir em pacientes ambulatoriais. Esse tópico revisa as evidências do uso dessa medicação.
Tratamento de Constipação Crônica
Constipação crônica tem grande impacto na qualidade de vida. Em junho de 2023, a American Gastroenterological Association e o American College of Gastroenterology publicaram uma diretriz sobre o tratamento farmacológico de constipação crônica idiopática. Este tópico revisa os principais pontos da publicação.
Tratamento de Pneumonia Associada à Ventilação Mecânica
As diretrizes internacionais recomendam antibioticoterapia empírica de amplo espectro para o tratamento de pneumonia associada à ventilação mecânica (PAV). Em abril de 2022 foi publicado no Journal of the American Medical Association (JAMA) o estudo GRACE-VAP que tenta utilizar a coloração de gram para guiar a terapia inicial. Vamos ver o que essa evidência acrescentou e revisar o tema.
Tratamento de Bactérias AmpC, CRAB e Stenotrophomonas maltophilia
O aumento de bactérias multidroga resistentes deixa cada vez mais difícil o manejo de infecções hospitalares. A Sociedade Americana de Doenças Infecciosas (IDSA) publicou um posicionamento sobre o tratamento de enterobactérias produtoras de AmpC, Acinetobacter baumannii produtor de carbapenemase e Stenotrophomonas maltophilia¹. Abaixo os principais pontos do documento.
