Insuficiência Adrenal
A adrenal é responsável por produzir glicocorticoides, mineralocorticoides e androgênios. Esta revisão aborda o diagnóstico e tratamento da insuficiência adrenal (IA), em pacientes estáveis e instáveis (crise adrenal).
Tipos e causas
A insuficiência adrenal (IA) é caracterizada pela deficiência na produção de glicocorticoides, androgênios e/ou mineralocorticoides. Pode ser classificada em:
- Primária: quando a origem do problema está na adrenal
- Central: quando há produção insuficiente de hormônio adrenocorticotrófico (ACTH), seja por alterações hipofisárias (IA secundária) ou hipotalâmicas (IA terciária).

A principal causa de IA central é o uso crônico de corticoides, que reduz a produção e síntese de CRH (hormônio liberador de corticotrofina) no hipotálamo. A tabela 1 e a tabela 2 mostram a relação entre esses hormônios e as principais causas de IA [1].

O paciente com IA pode ter um quadro clínico crônico ou agudo. A apresentação aguda pode evoluir com instabilidade hemodinâmica e confusão mental, situação conhecida como crise adrenal. Duas situações diferentes podem levar a crise adrenal:
- Pacientes com IA crônica que tem agudização dos sintomas após fatores precipitantes, como infecção ou cirurgia.
- Causas que levam a IA rapidamente, sem sintomas crônicos antecedentes, como trauma crânio encefálico ou hemorragia adrenal (geralmente associada a infecções por meningococo ou Haemophilus).
Estável: quando suspeitar?
Os sintomas da IA são inespecíficos, principalmente na apresentação crônica. As manifestações de cada deficiência estão resumidas na tabela 3.
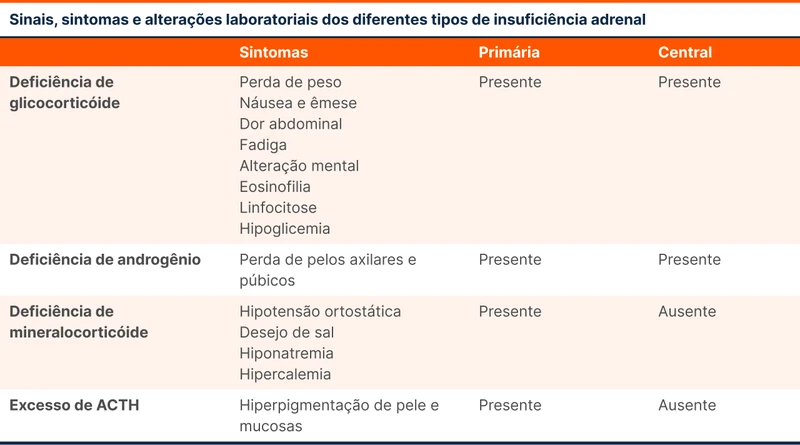
Na IA primária todas as substâncias produzidas pela adrenal são afetadas. Os baixos níveis de cortisol ocasionam aumento da liberação de ACTH pela hipófise. O excesso de ACTH causa hiperpigmentação de pele e mucosas.
Na IA central ocorrem sintomas da deficiência de glicocorticóides e, nas mulheres, deficiência de androgênio. A ação mineralocorticóide se mantém por estímulos independentes do ACTH, especialmente pelo sistema renina-angiotensina-aldosterona. A hiperpigmentação não é esperada, já que a produção de ACTH está comprometida.
Devido à baixa especificidade dos sintomas, a presença de fatores de risco ajuda a aumentar a suspeita de IA. Uso crônico de corticoides ou opióides, neoplasias ou infecções como tuberculose e HIV são fatores que reforçam a hipótese dos sintomas serem de IA.
Estável: como diagnosticar?
Exames iniciais
A dosagem de cortisol matinal e ACTH séricos são os exames iniciais na suspeita de IA. O cortisol tem ciclos pulsáteis e circadianos, e pela manhã deve estar elevado em indivíduos saudáveis. Na IA o cortisol matinal estará baixo. O nível de ACTH ajuda a determinar a causa da IA. São esperados níveis de ACTH duas vezes maiores que o valor de referência na IA primária. Na IA central o ACTH deve estar baixo ou normal.
O cortisol pode ser dosado tanto na sua forma sérica quanto salivar. Em janeiro de 2023, um estudo no New England Journal of Medicine - Evidence encontrou que a dosagem de cortisona salivar (forma inativa do cortisol) foi tão acurada para detecção de IA quanto os testes confirmatórios, se mostrando uma possível alternativa [2].
O valor de referência do cortisol pode variar conforme o reagente ou método de análise usado. Recomenda-se correlacionar os resultados com os valores referenciados pelo laboratório.
As referências são divergentes se valores de cortisol isolados são capazes de excluir ou confirmar IA. Alguns autores orientam a realização de testes confirmatórios em todos os pacientes, enquanto outros recomendam apenas nos casos de resultados intermediários. O fluxograma 1 resume uma das possíveis abordagens diagnósticas.
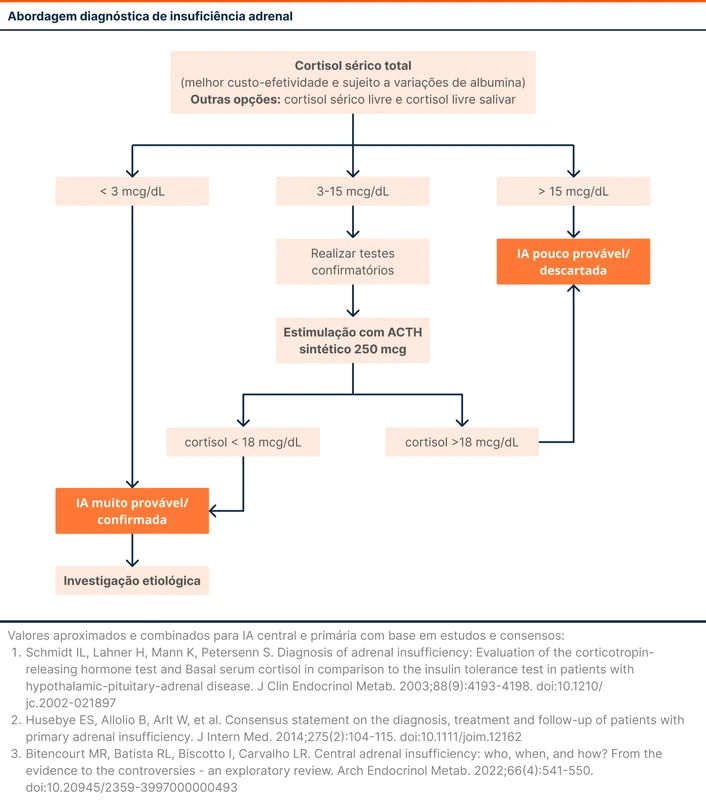
A deficiência de mineralocorticóide pode ser avaliada pela dosagem de renina e aldosterona plasmáticas, quando há suspeita de IA primária.
Testes confirmatórios
Testes confirmatórios pesquisam a produção de glicocorticoide após um estímulo, geralmente ACTH sintético ou hipoglicemia.
Na IA primária, o teste com estimulação de ACTH sintético é o padrão ouro [3].
Na IA central, a acurácia do teste com estimulação de ACTH depende do tempo de duração do quadro. Nos primeiros seis meses, a adrenal mantém responsividade ao ACTH, momento em que o teste ainda não tem boa acurácia. Após seis meses, a glândula sofre atrofia e a acurácia ao teste com estimulação de ACTH melhora. Por esse fator complicador, na IA central o teste de tolerância a insulina é preferido.
O teste de estímulo com ACTH corresponde à dosagem sérica de cortisol após 30 e 60 minutos da administração de ACTH recombinante. Os resultados desse teste não são afetados pela variação diurna do cortisol e podem ser realizados a qualquer momento do dia. Valores de cortisol abaixo do corte de normalidade em qualquer um dos tempos determinam IA. Um pico de cortisol acima de 18 mcg/dL em qualquer momento indica responsividade adrenal e descarta o diagnóstico de IA.
No teste de tolerância à insulina é realizada a indução de hipoglicemia. Em indivíduos saudáveis, a hipoglicemia eleva os níveis de cortisol. A IA é confirmada caso o cortisol permaneça baixo após o estímulo. Esse teste é contraindicado em pacientes com alto risco cardiovascular, convulsões, gestação e doenças cerebrovasculares. Nesses casos, podem ser usados outros testes de estímulo, como os testes com glucagon ou metirapona.
Estável: investigação da causa
A investigação da causa da IA é obrigatória após a confirmação diagnóstica.
Na IA primária, deve-se iniciar a investigação com a pesquisa do anticorpo contra 21-hidroxilase, que confirma o diagnóstico de IA autoimune. Se negativa, a investigação segue com tomografia de adrenais, buscando causas estruturais como infecção, tumores e sangramentos. Caso a etiologia ainda não seja estabelecida, são indicados testes genéticos para diferentes tipos de IA.
A principal causa de IA central é o uso crônico de corticoides.
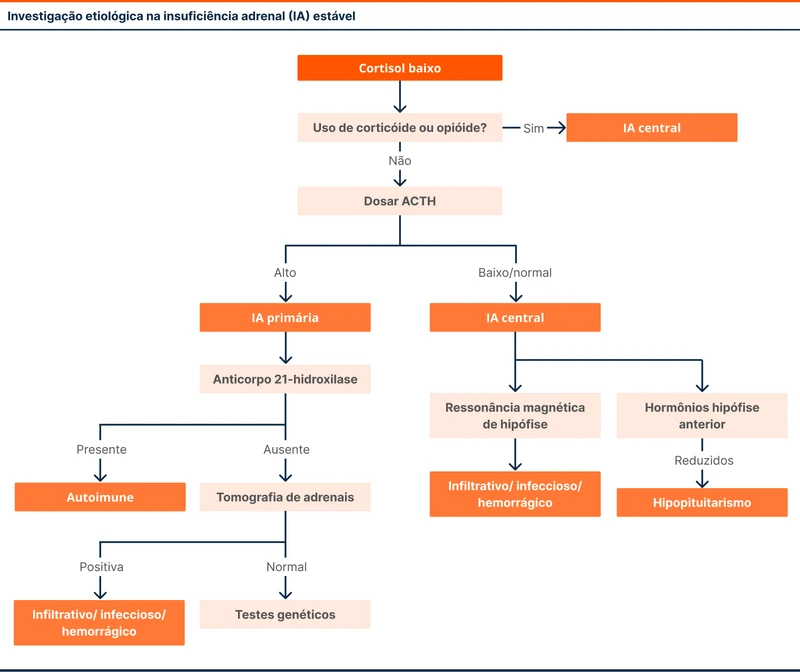
Em pacientes com IA central que não utilizam corticoides, a investigação continua com ressonância magnética da hipófise para detectar tumores ou doenças infiltrativas. Além disso, devem ser dosados outros hormônios hipofisários para avaliação de hipopituitarismo associado. O fluxograma 2 mostra a abordagem da investigação etiológica.
Estável: tratamento
O tratamento da IA se baseia na reposição dos hormônios não produzidos: glicocorticoide, mineralocorticoide e androgênios.
Na IA primária, a reposição é feita com uma substância com ação glicocorticoide e mineralocorticoide. A reposição de androgênio é guiada por sintomas. Na IA central, a reposição é com um agente glicocorticoide, e o benefício de reposição de androgênio é controverso.
A hidrocortisona é o corticoide de escolha para a reposição de glicocorticoide. Esse agente tem fácil titulação, meia vida mais curta, permite a criação de picos fisiológicos e é um glicocorticoide ativo, não necessitando de ativação hepática [3]. Para ação mineralocorticóide, utiliza-se a fludrocortisona.
Outras opções de reposição são prednisolona, prednisona e dexametasona. A prednisolona é preferível por ser forma ativa e a dexametasona é pouco recomendada por difícil titulação de dose. O tratamento do paciente estável é detalhado na tabela 4.
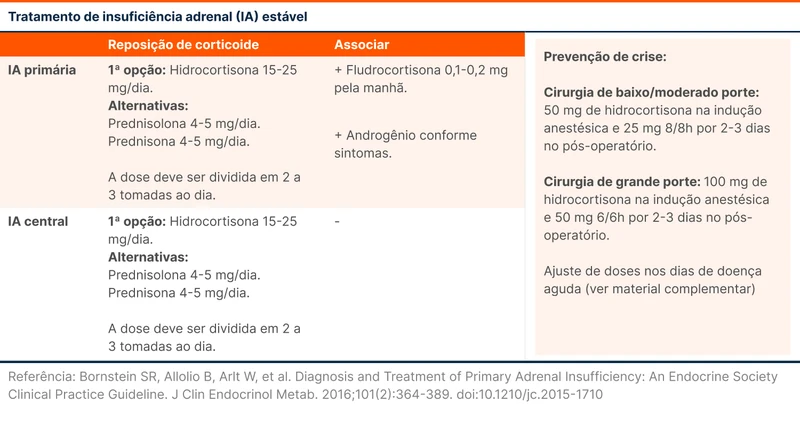
Deve haver acompanhamento especializado para monitoramento e titulação de doses de reposição. O paciente deve ser educado sobre prevenção de crise adrenal e aumento da dose do glicocorticoide em situações de doença, cirurgias e outros eventos estressantes [3]. Veja o material complementar sobre educação do paciente com insuficiência adrenal.
Instável: quando suspeitar?
A ausência de corticoide diante de fatores estressores ou quadros agudos leva a sintomas graves como choque e confusão mental. Essa situação é denominada crise adrenal.
A crise adrenal deve ser uma hipótese em três cenários:
- Sintomas de IA crônica (diagnosticada ou não) associados a um evento desencadeante da crise como infecção, cirurgia ou trauma.
- Uso crônico de corticoide associado a um evento possivelmente desencadeante de crise adrenal ou suspensão abrupta dos corticoides.
- Quadro agudo com achados clínicos e laboratoriais sugestivos de crise adrenal.
Não existem achados específicos de crise adrenal. Os sinais e sintomas são os mesmos da IA estável, porém mais intensos. Algumas alterações laboratoriais podem auxiliar na suspeição.
O achado laboratorial mais comum é a hiponatremia, presente em 90% dos casos de crise adrenal. A hipercalemia ocorre em 50 a 60% dos quadros primários, devido à deficiência de aldosterona. Em pacientes mais graves, sódio e potássio podem estar normais, como consequência de episódios de vômitos que reduzem o potássio e causam desidratação [1]. Hipoglicemia também pode ocorrer, sendo mais comum em crianças.
A ocorrência de vômitos e acidose metabólica de anion gap normal deve aumentar a suspeita de IA. A acidose ocorre possivelmente por acidose tubular renal por conta do hipoaldosteronismo. A maioria das causas de vômito leva à alcalose metabólica, por isso a combinação de vômitos com acidose distingue IA de outras situações.
A combinação de choque e eosinofilia sugere IA. Outras etiologias de choque aumentam o nível de cortisol, o que suprime os eosinófilos. Na crise adrenal, não ocorre essa supressão. Um estudo prospectivo identificou eosinofilia (mais de 3% dos leucócitos) em aproximadamente 81% dos pacientes com crise adrenal [4].
A relação entre neutrófilos e linfócitos (RNL) também pode ser uma pista de IA. Níveis normais de RNL estão entre 1 e 3. Em uma situação de estresse, como infecções e choque, há liberação fisiológica de cortisol e catecolaminas, aumentando a RNL. RNL entre 6 e 9 é esperada em resposta a fatores estressantes leves e acima de 9 em pacientes críticos. A presença de choque em um paciente com RNL normal aumenta a suspeita de IA [5].
Um diagnóstico diferencial de crise adrenal é a insuficiência de corticosteróides relacionada com a doença crítica (ICRDC). Apesar de não haver consenso sobre essa entidade, especula-se que alguns pacientes criticamente doentes por longos períodos possam entrar em um estado de IA central adquirido. A ICRDC é uma suspeita em pacientes críticos que precisam de suporte artificial por diversas semanas, com sinais e sintomas compatíveis com IA, especialmente quando há dependência de drogas vasoativas.
Não há testes laboratoriais validados para o diagnóstico da ICRDC. Não se sabe os níveis apropriados de cortisol no choque, nem o que seria uma resposta adequada ao ACTH. Quando a suspeita é forte, alguns repõem corticoides empiricamente. Após a estabilidade do quadro, deve ser realizado o desmame. É recomendada a avaliação do endocrinologista para diagnóstico de possíveis confundidores. Exames de imagem devem ser realizados para excluir hemorragia adrenal [6].
Instável: como diagnosticar?
Na suspeita de crise adrenal, devem ser coletados cortisol e ACTH séricos. A hipótese é fortalecida com valores baixos de cortisol e afastada com valores altos. O diagnóstico da crise adrenal não deve atrasar o tratamento. O fluxograma 3 mostra a abordagem diagnóstica de IA instável.
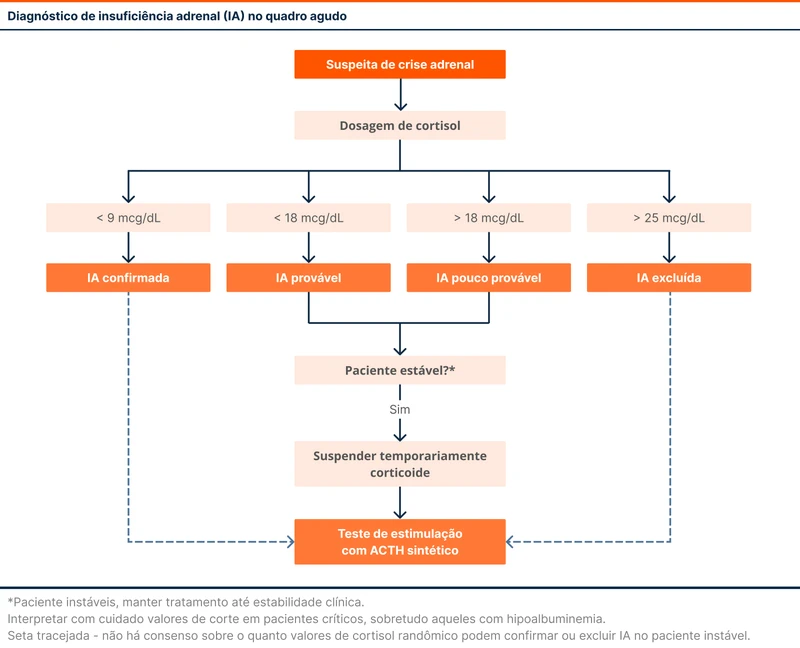
Testes confirmatórios, como estimulação com ACTH sintético, devem ser realizados quando o paciente estiver estável, com suspensão temporária de corticoide. São realizados especialmente nos casos de valores intermediários de cortisol.
Instável: tratamento agudo
O tratamento da crise adrenal deve ser iniciado sempre que houver suspeita da doença. O manejo básico envolve reposição de corticoide e hidratação venosa.
A reposição inicial de corticoide é feita com hidrocortisona 100 mg via intravenosa, em bolus. Essa dose tem como objetivo:
- Saturar a 11 beta-hidroxiesteroide-desidrogenase, responsável por degradar cortisol (forma ativa) em cortisona (forma inativa);
- Agir em receptores mineralocorticoides.
Após essa dose, deve ser mantida hidrocortisona 50 mg a cada seis horas pelas 24 horas seguintes. Depois desse período recomenda-se o desmame até a dose de manutenção (dose correspondente à fisiológica ou conforme sintomas do paciente) [6].
A expansão volêmica é realizada preferencialmente com cloreto de sódio 0,9%. O objetivo é garantir a euvolemia e níveis adequados de sódio.
Não há necessidade de reposição específica de mineralocorticoide na maioria dos casos de crise adrenal. Um resumo das principais recomendações está descrito no fluxograma 4.
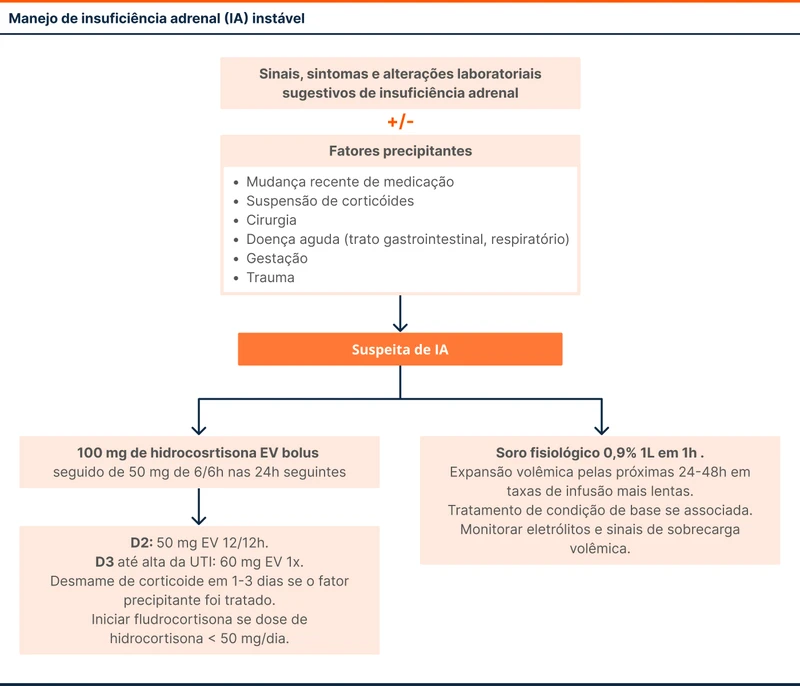
Após a estabilidade do paciente, é possível suspender temporariamente o corticoide para realizar testes confirmatórios. Em pacientes em uso crônico de corticoides é realizada uma estratégia diagnóstica semelhante.
Como desmamar corticoide?
A retirada do corticoide pode causar complicações relacionadas a três situações:
- Recorrência da doença para a qual o corticoide foi prescrito
- Desenvolvimento de sintomas de IA
- Abstinência de corticoide
Por esse motivo, recomenda-se cautela na suspensão de corticoides de uso crônico. Existem muitos esquemas propostos para a retirada ou redução da dose de corticoides. A comparação entre os esquemas é difícil. Alguns estudos propõem redução progressiva e semanal de doses, enquanto outros sugerem manter a mesma dose diária e tomar em dias alternados, gradualmente aumentando o número de dias sem medicamento [7]. Orientações para o paciente estão descritas no material complementar.
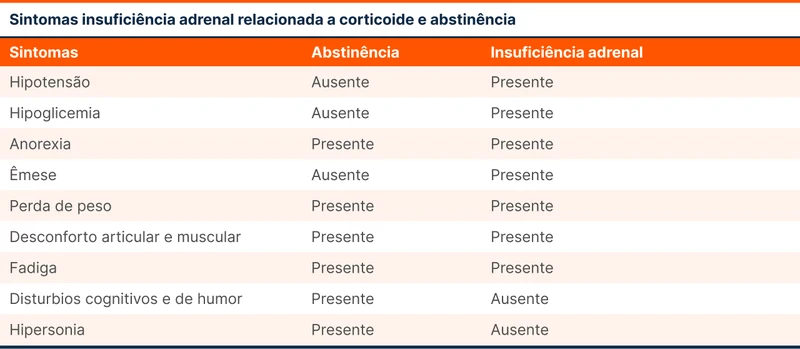
Os sintomas de recorrência da doença vão depender da doença de base. A tabela 5 compara os sintomas de IA com abstinência de corticoide, que podem ser de difícil diferenciação.
Existem três fatores de risco que comumente aumentam a probabilidade de IA relacionada ao uso de corticoide (IARC):
- Uso diário de corticoide sistêmico por mais de duas a quatro semanas
- Múltiplas doses diárias
- Administração no período noturno
O uso crônico de corticoide inalatório por mais de 12 meses também aumenta o risco de IARC [8].
Em pacientes com fatores de risco para IARC o eixo hipotálamo-hipófise deve ser avaliado. Nesse processo, a dose de corticoide é reduzida até equivalentes de 4 a 5 mg de prednisona por dia e mantida por uma a quatro semanas. Após esse período, a medicação é suspensa por 24 a 36 horas e é realizada dosagem do cortisol sérico matinal, conforme fluxograma 5.
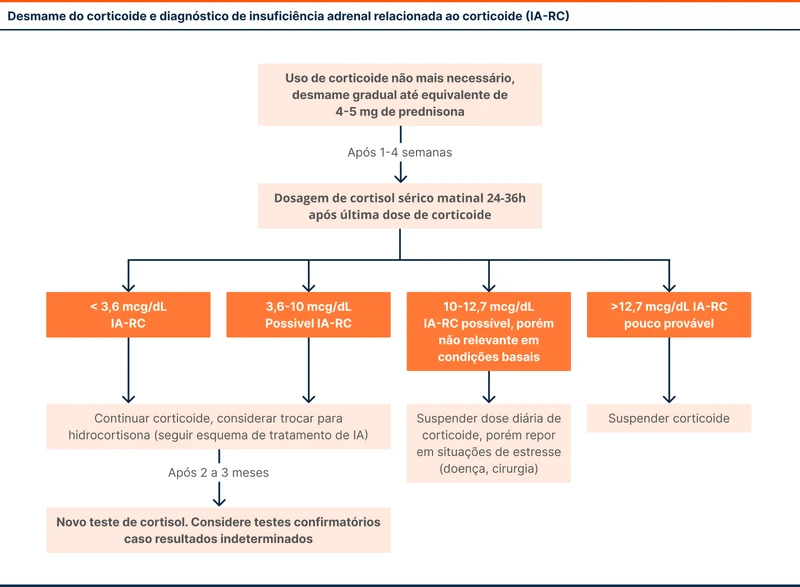
Durante o uso de doses suprafisiológicas de corticoides (acima de 4 a 5 mg de prednisona) é pouco provável que ocorram sintomas de IA. Caso surjam sintomas mesmo com doses mais altas, a possibilidade de abstinência de corticoide como diagnóstico diferencial de IA deve ser lembrada.
O mecanismo da abstinência de corticoide ainda é pouco compreendido. Os sintomas são autolimitados e o tratamento consiste no retorno da dose anterior de corticoide com desmame ainda mais lento. Pode ser necessário manejo específico de sintomas, com antidepressivos, anti-inflamatórios e condicionamento muscular.
Aproveite e leia:
Insuficiência Adrenal Induzida por Corticoides e Desmame de Corticoides
A European Society of Endocrinology e a Endocrine Society publicaram uma diretriz de orientações para diagnóstico e tratamento de insuficiência adrenal induzida por corticoides em abril de 2024. Este tópico revisa o tema e como fazer o desmame de corticoides.
Caso Clínico #17
Uma mulher de 38 anos com episódios recorrentes de hipoglicemia sintomática.
Staphylococcus aureus Resistente à Meticilina (MRSA) e Vancomicina
A infecção por Staphylococcus aureus resistente à meticilina (MRSA) é causa importante de mortalidade e morbidade no hospital. O tratamento gera dúvidas, especialmente com relação a vancomicina e sua monitorização. Na revisão do mês, abordamos infecções por MRSA, seu tratamento e monitorização de vancomicina.
Procalcitonina: Uso Clínico
A procalcitonina é um biomarcador de infecções bacterianas. Seu papel no auxílio diagnóstico e seguimento de infecções bacterianas é muito estudado. Este tópico revisa as evidências e recomendações para o uso da procalcitonina.
Infecção do Trato Urinário Associada a Cateter Vesical
A infecção do trato urinário associada a cateter vesical é uma condição de difícil diagnóstico. Os exames urinários são comumente alterados nessa população, mesmo na ausência de infecção. Os sintomas podem ser difíceis de avaliar, especialmente em pacientes sedados ou com lesão medular. Este tópico aborda o diagnóstico, tratamento e prevenção dessa condição.
