Pé Diabético
O pé diabético é a destruição, ulceração ou infecção do pé de pacientes com diabetes. Essa condição está diretamente associada à neuropatia periférica e a doença vascular periférica. Esta revisão aborda a classificação, diagnóstico e tratamento das complicações associadas ao pé diabético com base em uma revisão publicada em 2023 no Journal of the American Medical Association e na diretriz de pé diabético infectado da International Working Group on the Diabetic Foot (IWGDF) [1, 2].
O que é pé diabético
O pé diabético é um processo complexo que ocorre principalmente por dois caminhos: neuropatia periférica e doença arterial periférica.
A neuropatia periférica diabética tem três tipos de lesão que contribuem com o pé diabético: sensitiva, motora e autonômica. A neuropatia sensitiva leva a perda da sensibilidade protetora, a neuropatia motora causa deformidades e remodelamento do pé e a neuropatia autonômica resulta em ressecamento do pé e formação de fissuras [1].
Essas lesões em conjunto causam deformidades e aumento da pressão em alguns pontos do pé, principalmente na região plantar, como na base do hálux, favorecendo a formação de calos. Esses calos vão evoluir com hematomas e, com a saída da superfície do calo, ocorre a formação de úlceras (figura 1). Artropatia neuropática ou artropatia de Charcot é o processo em que a neuropatia periférica causa degeneração de articulações que sustentam peso nos pés.
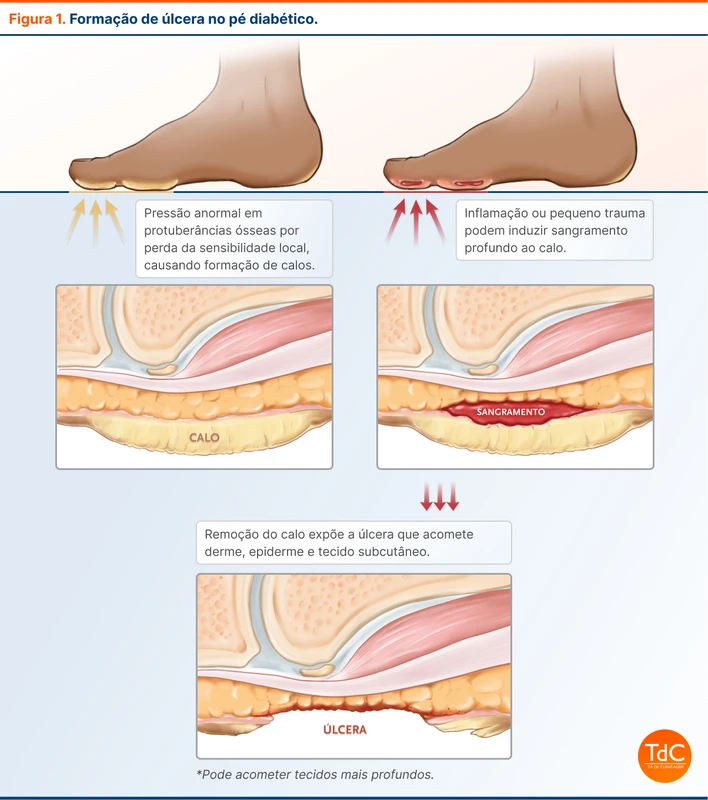
Outro mecanismo é o da doença arterial periférica, causando úlcera através de isquemia e necrose. Além desses dois mecanismos, a diabetes também está diretamente associada à dificuldade de cicatrização. A úlcera pode ser iniciada por processos externos como calçados apertados, lesões ou ferimentos em outros locais do pé.
Classificação da úlcera diabética
A Society for Vascular Surgery propõe a classificação WIfI (Wound, Ischemia and Foot Infection) na avaliação do pé diabético. Esse sistema utiliza três características: úlcera ou gangrena (wound), presença de doença arterial periférica (ischemia) e presença de infecção (foot infection) [3]. É atribuída a cada uma dessas características uma nota de zero a três. Quanto maior a nota, maior o risco (tabela 1).
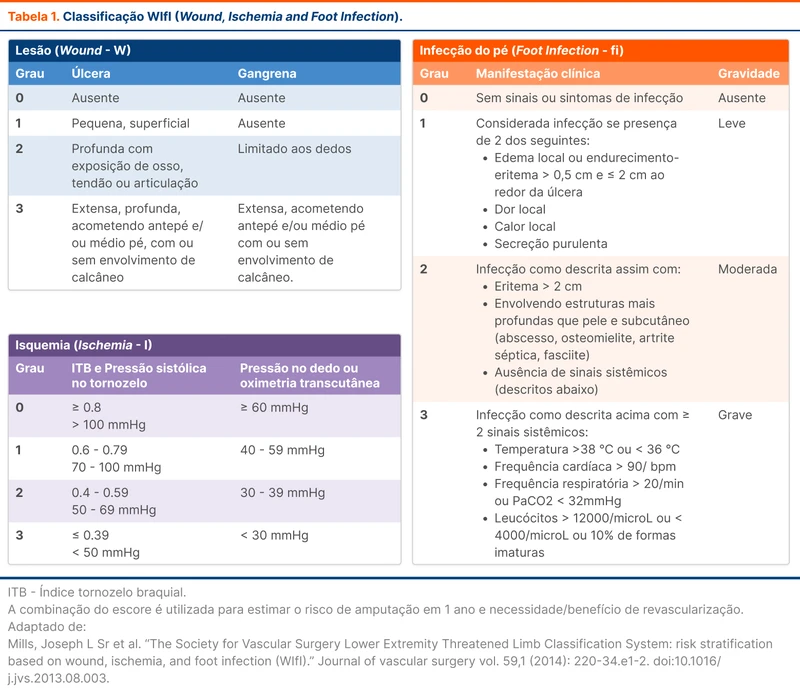
A lesão é analisada principalmente quanto à profundidade e a infecção do pé é avaliada pela extensão dos sinais infecciosos locais e sistêmicos. Já a doença arterial periférica é examinada através de medidas objetivas como índice tornozelo braquial ou a medida da pressão arterial dos dedos do pé.
Essa classificação é utilizada para avaliar dois desfechos: risco de amputação em um ano e chance de benefício/necessidade de revascularização. Com o valor para cada uma das três características, os resultados são colocados em uma tabela que classifica o paciente em muito baixo, baixo, moderado ou alto risco dos desfechos (tabela 2).
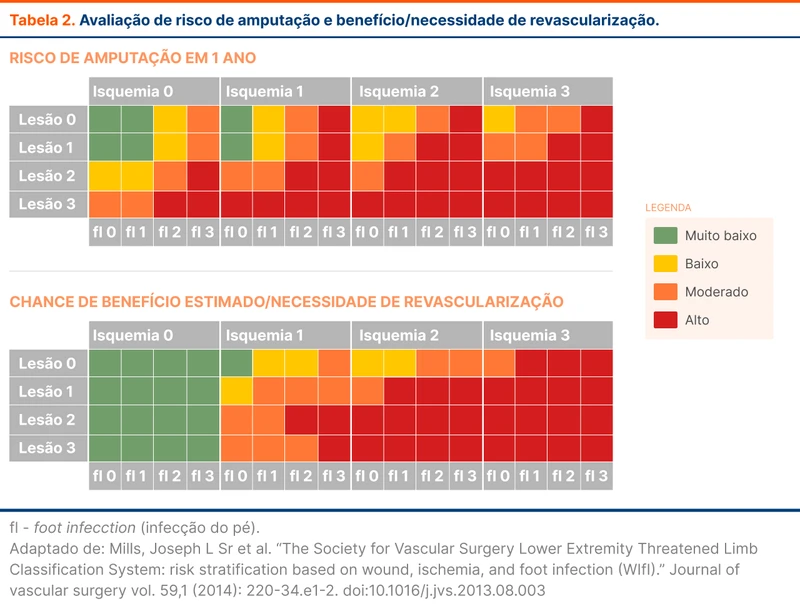
A classificação pode ser usada como guia na avaliação do pé diabético e auxiliar na conduta. Nesse contexto, as úlceras podem se enquadrar em quatro cenários possíveis:
- Sem infecção e sem isquemia
- Com infecção e sem isquemia
- Sem infecção e com isquemia
- Com infecção e com isquemia
A avaliação de isquemia é conforme a classificação WIfI, envolvendo ITB e outras medidas. A avaliação de infecção é mais subjetiva e será discutida no subtópico abaixo.
Diagnóstico de pé diabético infectado
Uma úlcera diabética sempre deve ser avaliada quanto a presença de infecção. A infecção pode ser superficial, envolvendo pele, ou pode ser profunda, chegando até fáscia, músculo, ligamento ou osso.
Os sinais e sintomas de infecção de pele e partes moles em uma úlcera diabética são similares aos de outros locais. Os sintomas principais são calor, hiperemia, dor e edema local. Pode haver endurecimento da lesão, formação de placas, saída de secreção purulenta e formação de abscesso no local.
Alguns confundidores dificultam a identificação de úlceras infectadas nesses pacientes. A neuropatia diabética pode reduzir a sensação de dor local, diminuindo esse sintoma. A própria úlcera pode ter hiperemia perilesional e exsudação. Outros processos, como a artropatia de Charcot, podem se apresentar com edema e hiperemia. Em um estudo de 2006, foram identificados os seguintes fatores associados à infecção: lesões com exposição óssea, com duração maior do que 30 dias, recorrentes, associadas a trauma e presença de doença arterial periférica [4].
A IWGDF em conjunto com a Infectious Disease Society of America (IDSA) recomendam que seja considerado infectado o pé diabético que apresenta dois ou mais dos achados de infecção do WIfI (tabela 1), contanto que sejam excluídas outras causas. Exames complementares como proteína C reativa (PCR), velocidade de hemossedimentação (VHS) e procalcitonina podem auxiliar em casos de dúvida e são recomendados pela diretriz da IWGDF. Úlceras que não cicatrizam há mais de 30 dias, presença de doença arterial periférica e história de trauma local também aumentam a chance de infecção.
A coleta de culturas da lesão pode guiar a escolha do tratamento, mas recomenda-se que seja realizada após a limpeza e debridamento, de forma estéril. Cultura de swab ou de secreção não são recomendados.
A osteomielite é outro tipo de infecção associada ao pé diabético. A presença de úlcera maior ou igual a 2 cm², exposição óssea, "dedos em salsicha" e fístula com saída de secreção purulenta aumentam a chance de osteomielite [5, 6].
Os exames iniciais para diagnóstico de osteomielite são o probe-to-bone e a radiografia. O probe-to-bone é um teste em que o examinador utiliza um objeto estéril com ponta arredondada e encosta na úlcera para sentir o osso (veja este veja este vídeo sobre avaliação de infecção de úlcera). Caso sinta o osso, a prova é considerada positiva. Uma revisão sistemática de 2016 estimou a sensibilidade e especificidade da técnica em 87% e 83%, respectivamente [7]. Algumas alterações radiográficas são altamente sugestivas de osteomielite (tabela 3). Contudo, os achados podem estar ausentes na osteomielite aguda.

O quadro clínico, o probe-to-bone e a radiografia não são suficientes para excluir ou confirmar a osteomielite isoladamente e devem ser utilizados em conjunto. Em caso de dúvida, recomenda-se o uso de provas inflamatórias - PCR, VHS e procalcitonina. Por último, se a dúvida clínica persistir, o próximo passo é a realização de ressonância magnética. Em pacientes em que esse teste não pode ser realizado, outra opção é o PET/CT com leucócitos marcados.
O padrão ouro do diagnóstico de osteomielite é a realização de biópsia e cultura de tecido ósseo e devem ser realizados sempre que possível. A antibioticoterapia pode estar associada a falsos negativos da cultura. Assim, se possível, a coleta deve ser feita antes do início do tratamento. Existe dúvida sobre a via de coleta da amostra (pela lesão ou através pele intacta). Alguns autores recomendam evitar a coleta pela lesão por risco de contaminação. Em casos de cultura do tecido ósseo negativa, a análise histológica do tecido ajuda a determinar se há osteomielite de fato.
Tratamento de pé diabético infectado: antimicrobianos
O tratamento de pé diabético infectado é dividido em infecção de pele e partes moles e osteomielite e varia conforme a gravidade da infecção.
Infecção de pele e partes moles
Os microorganismos mais encontrados nessas infecções são o Staphylococcus aureus, incluindo os resistentes a meticilina (MRSA), e o Streptococcus pyogenes, semelhante às infecções em pacientes sem diabetes, apesar de muitas vezes a infecção poder ser polimicrobiana [8, 9]. Para pacientes com infecções leves, a diretriz da IWGDF recomenda cobertura para cocos gram-positivos apenas. Em pacientes com exposição recente à antibióticos, recomenda-se a adição de cobertura para gram-negativos e cobertura para MRSA em pacientes com fatores de risco (discutido no tópico Staphylococcus aureus Resistente à Meticilina (MRSA) e Vancomicina). A tabela 4 reúne os esquemas de tratamento em diversas situações.
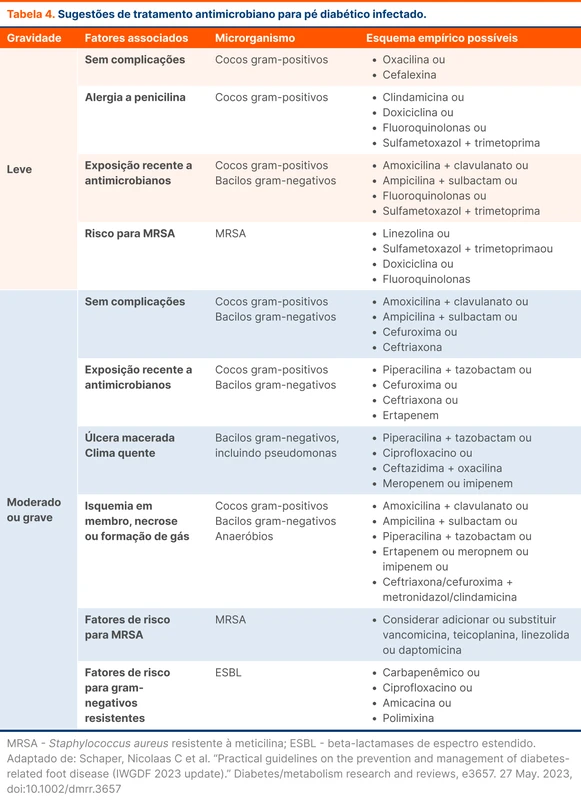
Existe uma discussão atual sobre o papel da Pseudomonas aeruginosa nessas infecções. Alguns estudos encontraram que pacientes que não realizaram tratamento contra Pseudomonas obtiveram taxas de cura semelhantes aos que usaram antibioticoterapia anti-pseudomonas (como piperacilina/tazobactam, ceftazidima, cefepima, meropenem e ciprofloxacino) [10, 11]. Por outro lado, esse microrganismo foi associado a infecções em pé diabético em locais com climas tropicais e subtropicais [12]. A recomendação é de tratamento empírico contra Pseudomonas em pacientes com infecção moderada a grave em locais úmidos ou quentes ou que apresentam cultura prévia positiva para o agente nas últimas semanas. Algumas referências também sugerem essa cobertura em lesões que tiveram exposição à água [13].
Já o tratamento de microorganismos anaeróbios é recomendado em pacientes com infecção moderada a grave com presença de isquemia, necrose ou presença de gás.
A duração do tratamento é de uma a duas semanas em infecções leves e de duas a quatro semanas em infecções moderadas ou graves. Se o paciente realizou debridamento local, trata-se por dez dias após o procedimento.
Osteomielite

A escolha de antibioticoterapia é semelhante à infecção de pele e partes moles, mas a duração é diferente e depende do cenário. Quando parte do osso é retirada, recomenda-se a cultura das margens restantes. Caso a cultura das margens seja negativa, o tratamento deve ser mantido por três a cinco dias. Já se a cultura for positiva, o tratamento é recomendado por três semanas. Caso não tenha sido realizado algum procedimento, a orientação é de seis semanas (tabela 5).
Tratamento de pé diabético infectado: cirurgia, revascularização e outros cuidados
A diretriz de 2023 da IWGDF recomenda que toda úlcera diabética infectada deve ser avaliada por equipe cirúrgica. A avaliação cirúrgica deve identificar se há necessidade de dois procedimentos: limpeza/desbridamento e revascularização em presença de doença arterial periférica.
Limpeza, desbridamento e drenagem
É a retirada de tecido necrótico, desvitalizado, incluindo tecido ósseo, se necessário. A indicação deve ser feita em conjunto com a equipe cirúrgica. Estudos retrospectivos sugerem que a abordagem cirúrgica em até 72 horas está associada a menor taxa de amputação se comparada a 3 a 6 dias. Caso seja realizado o procedimento cirúrgico, recomenda-se a coleta de culturas de tecidos profundos com material estéril para guiar o tratamento.
Revascularização
É recomendada a avaliação de cirurgia vascular para verificar a necessidade de revascularização. Estudos demonstram cicatrização mais rápida de úlceras em pacientes que realizaram revascularização nos primeiros 14 a 56 dias [14, 15]. A escolha de angioplastia, bypass ou amputação vai depender das características clínicas do paciente (veja mais neste tópico).
Outros cuidados
Poucos estudos avaliaram tipos de curativos no pé diabético. A escolha dos produtos aplicados em curativos vai depender das características da lesão. Em lesões com pouca exsudação, a revisão do JAMA sugere o uso de curativos com hidrogel. O alginato e a hidrofibra podem ser usados para lesões mais exsudativas. O uso de antibióticos tópicos não são recomendados para tratamento de pé diabético infectado. Em úlceras de difícil cicatrização, podem ser usados curativos embebidos com octosulfato de sacarose, já estudado em ensaio clínico randomizado [16].
A oxigenoterapia hiperbárica é recomendada para pacientes com úlceras associadas a doença arterial periférica. No cenário de infecção ou de úlcera não isquêmica, os trabalhos não mostraram melhor cicatrização [17].
A terapia de pressão negativa (curativo a vácuo) é recomendada em pacientes com úlceras diabéticas pós cirúrgicas. Em pacientes com úlceras não cirúrgicas, não há recomendação [17].
A diminuição do peso sobre a úlcera é uma forma de facilitar a cicatrização. Para isso, podem ser usadas órteses que diminuem a pressão na região plantar.
Prevenção e rastreio
Pacientes com diabetes devem ser avaliados periodicamente para a presença de três elementos:
- Neuropatia periférica
- Doença vascular periférica
- Presença de úlceras, calos ou alterações estruturais do pé.
Em seu documento de 2022, a American Diabetes Association (ADA) recomenda rastreio anual a partir do diagnóstico de pacientes com diabetes mellitus tipo 2 e rastreio anual cinco anos a partir do diagnóstico em pacientes com diabetes mellitus tipo 1 [18].
O rastreio de neuropatia periférica pode ser feito utilizando testes com monofilamento para avaliar sensibilidade protetora. Um monofilamento é aplicado a um ponto de pé e o paciente deve informar se sentiu ou não. Caso o paciente não sinta a pressão do monofilamento de 10 g (5,07), o teste é considerado alterado (veja este vídeo sobre o teste com monofilamento). Idealmente deve ser feito em pelo menos três regiões do pé. Outras formas de avaliação são avaliação de temperatura, sensibilidade e vibração (utilizando diapasão de 128 Hz).
A ADA recomenda como rastreio inicial a investigação de história de claudicação intermitente, inspeção visual e palpação de pulsos. Contudo, a palpação de pulsos tem baixa sensibilidade (71%) e especificidade (72%) para identificação de doença vascular periférica [1]. Assim, em pacientes com alguma suspeita de doença vascular periférica, recomenda-se a realização do índice tornozelo-braquial.
Em relação à avaliação estrutural do pé, a presença de úlceras, deformidades, calosidades ou outras alterações associadas ao pé diabético deve ser documentada.
Aproveite e leia:
Doença Arterial Periférica: Diretriz AHA/ACC 2024
Em junho de 2024, o American College of Cardiology (ACC) e a American Heart Association (AHA) publicaram uma diretriz sobre manejo da doença arterial periférica. Esse documento substitui a diretriz de 2016. Esta revisão aborda a apresentação clínica, diagnóstico e tratamento dessa condição com base nessa nova publicação.
Hipoglicemia na Diabetes: Diretriz de Manejo Ambulatorial
A hipoglicemia é um dos principais efeitos adversos no tratamento medicamentoso da diabetes. Em fevereiro de 2024, o Journal of the American Medical Association publicou uma sinopse da diretriz de 2023 da Endocrine Society sobre o manejo de pacientes com diabetes e alto risco de hipoglicemia. Este tópico aborda as principais recomendações desses documentos.
Fator Antinuclear (FAN): O Que o Clínico Precisa Saber
O fator antinuclear (FAN), também conhecido como anticorpos antinucleares (ANA), é um importante marcador laboratorial para a triagem e diagnóstico de doenças reumatológicas imunomediadas. Apesar de ampla utilização, a solicitação e a interpretação do exame muitas vezes ocorrem de maneira inadequada. Este tópico revisa o exame, discutindo as principais indicações e a forma correta de interpretá-lo.
Atualização de DPOC: GOLD 2024
Anualmente é publicada a diretriz do Global Initiative for Chronic Obstrutive Lung Disease (GOLD), um programa internacional sobre a prevenção, diagnóstico e tratamento do paciente com doença pulmonar obstrutiva crônica (DPOC). O GOLD 2023 já foi coberto no Guia. Este tópico traz as atualizações do GOLD 2024.
Novos Tratamentos de Tuberculose
O tratamento de tuberculose envolve a combinação de antibióticos por um período prolongado, geralmente seis meses ou mais. Em março de 2023, o estudo TRUNCATE-TB foi publicado no New England Journal of Medicine (NEJM) avaliando estratégias de tratamento mais curtas, de 8 semanas. Aproveitamos a publicação para revisar as novas estratégias de tratamento de tuberculose.
