Caso Clínico #14
O caso clínico abaixo é apresentado em partes. O negrito é a descrição do caso, as partes que não estão em negrito são os comentários. Ao final, você encontrará a resolução e os pontos de aprendizagem resumidos.
Homem de 32 anos procura o pronto-socorro por cefaleia intensa, náuseas e turvação visual há quatro horas da admissão. Nega febre e trauma craniano. Informa estar apresentando há cerca de quatro meses episódios de palpitações, câimbras recorrentes e sensação de fraqueza em membros inferiores. É previamente hígido e nega uso de medicações. Relata história familiar de hipertensão (pai e irmãos com diagnóstico entre 20 e 30 anos). Nega tabagismo.
No exame físico está em regular estado geral e fácies de dor. Pressão arterial (PA) de 228/170 mmHg no membro superior direito e 220x166mmHg no membro superior esquerdo (simétrica em membros superiores), frequência cardíaca 107 bpm, IMC 24,5 kg/m2, exame físico cardíaco, respiratório e abdominal sem alterações. Extremidades sem edemas. Fundo de olho com papiledema bilateral. As medidas de PA foram confirmadas em duas outras medidas e o paciente não apresentava diferença de pulsos entre os membros.
O primeiro passo no paciente com elevação significativa da PA no pronto socorro é avaliar se há uma emergência hipertensiva (EH). As EH são situações clínicas em que há elevação da acentuada da PA sistólica ≥ 180mmHg e/ou diastólica ≥ 110-120 mmHg com lesão aguda e progressiva de órgãos alvo. As EH mais comuns são edema pulmonar e AVC isquêmico. A maioria dos pacientes com elevação da PA no pronto socorro não tem EH. As principais EH são citadas na tabela 1.

Existe um grupo significativo de pacientes com elevação da PA no pronto socorro que não tem sinais evidentes de lesão orgânica. Esses pacientes podem relatar alguns sintomas, como cefaléia, tontura e dor torácica atípica. A existência de causalidade entre HAS e esses sintomas é alvo de controvérsia na literatura. Para esse grupo de pacientes, existe menor consenso sobre a terminologia e o manejo adequados. Em algumas referências, a ocorrência de pressão arterial elevada, acima de 180 na sistólica ou 110 a 120 mmHg na diastólica, sem lesões orgânicas, é denominada de urgência hipertensiva (UH). As urgências hipertensivas são mais comuns do que as EH [1]. A pseudocrise hipertensiva também é um cenário em que há elevação da PA sem lesão orgânica, porém a PA se eleva por um evento emocional, doloroso ou outro tipo de desconforto. As estratégias recomendadas para o manejo desses pacientes carecem de evidências fortes.
As EH e UH são mais comuns em pacientes previamente hipertensos que não utilizam adequadamente medicamentos antihipertensivos [1].
No paciente com suspeita de EH, além da avaliação de sinais e sintomas, exame físico e exames complementares para identificar lesão de órgão alvo, deve-se procurar a causa do evento. Informações úteis incluem a PA habitual do paciente e o uso de medicações e substâncias que também possam elevar a PA. A última diretriz brasileira de manejo de hipertensão recomenda uma rotina mínima de avaliação que inclui eletrocardiograma, radiografia de tórax, marcadores de necrose miocárdica, hemograma completo, ureia, creatinina e potássio [2]. Outros exames complementares podem ser solicitados conforme os sintomas (tabela 2). Na ausência de sintomas de lesão de órgão alvo, o benefício de realizar esses exames para todos os pacientes é incerto. Estudos retrospectivos mostram que a maioria dos resultados laboratoriais, em pacientes sem evidências claras de lesões de órgão alvo, são normais ou apresentam alterações crônicas.

Independente do órgão envolvido, na EH as medidas iniciais incluem internação em UTI e início de terapia anti-hipertensiva intravenosa (ex: nitroprussiato de sódio). As demais intervenções vão diferir de acordo com o sistema/órgão envolvido. Os pacientes com UH devem ser reavaliados em ambiente calmo, em repouso, após controle dos precipitantes. Caso haja persistência de valores elevados ou de sintomas possivelmente atribuíveis à pressão arterial, o manejo pode ser feito com medicamentos orais e a prescrição deve ser ajustada para controle ambulatorial. A UH pode ser tratada ambulatorialmente com retorno precoce em cerca de sete dias.
No paciente do caso, as queixas de cefaleia intensa, náuseas e turvação visual, além do achado de papiledema bilateral, sugerem o diagnóstico de encefalopatia hipertensiva. A encefalopatia hipertensiva é caracterizada por sinais e sintomas de edema cerebral secundário à elevação súbita e/ou mantida da PA, devendo ser manejada como uma EH. Diante dessa suspeita, deve-se internar o paciente em UTI ou mantê-lo na sala de emergência para adequada monitorização e iniciar uma medicação anti-hipertensiva intravenosa. Já existe evidência de lesão de órgão-alvo (fundo de olho com papiledema bilateral), mas também caberia a pesquisa de outros acometimentos. Por isso, para complementar a investigação, devem ser solicitados: ECG, radiografia de tórax, marcadores de necrose miocárdica, hemograma completo, uréia, creatinina, urina 1 e potássio (rotina básica sugerida pela diretriz brasileira de hipertensão), além de uma imagem de sistema nervoso central (tomografia de crânio).
Cada emergência hipertensiva tem seu manejo específico. Na encefalopatia hipertensiva, o objetivo do tratamento é reduzir a PA de forma lenta, uma vez que reduções intensas e rápidas podem provocar hipoperfusão cerebral e perda do mecanismo de autorregulação cerebral. Nas primeiras 24 a 48 h de tratamento, podem ser adicionados anti-hipertensivos orais para melhor controle da PA.
A idade e a intensidade da hipertensão em um paciente previamente hígido sugerem um caso de hipertensão secundária. As principais pistas para suspeitar de hipertensão secundária estão na tabela 3.

As causas de hipertensão secundária podem ser divididas em dois grupos: causas não endócrinas e causas endócrinas. As mais prevalentes em cada um desses grupos são:
Não endócrinas:
- Doença renal crônica
- Hipertensão renovascular
- Síndrome da apneia do sono
Endócrinas:
- Hiperaldosteronismo primário
- Feocromocitoma e paragangliomas
- Distúrbios da tireoide
Outras causas estão na tabela 4.
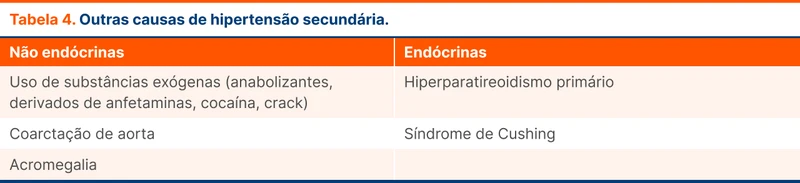
Após a abordagem inicial da EH, para investigação da causa secundária, poderiam ser adicionados:
- Exames laboratoriais: sódio, gasometria venosa, dosagem de aldosterona e renina (ou atividade plasmática de renina), metanefrinas plasmáticas, função tireoidiana (TSH, T4 livre), perfil de cálcio;
- Exames de imagem: USG de rins e vias urinárias, polissonografia.
O paciente foi manejado inicialmente na sala de emergência. Após estabilização, foi encaminhado para a enfermaria da clínica médica para investigação de hipertensão secundária e outras complicações da hipertensão. Foram solicitados exames laboratoriais e alguns exames de imagem. O paciente negava o uso de quaisquer substâncias que poderiam ter efeito na pressão arterial. No momento está em uso de: hidralazina 25 mg 3x/dia, clonidina 0,2 mg/d, verapamil 80mg 12;/12hs, reposição de potassio (KCl - Slow K) 600mg/d.
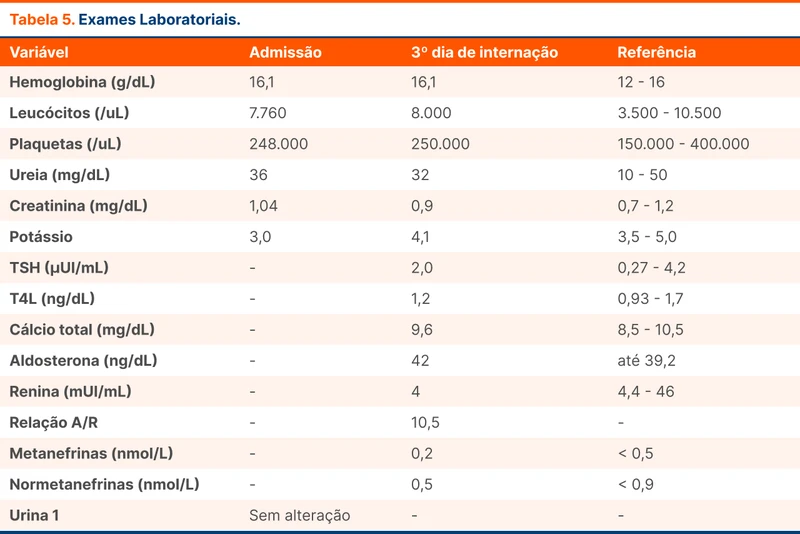
A tomografia de crânio sem contraste, radiografia de tórax, ecocardiograma transtorácico, eletrocardiograma e ultrassonografia com doppler de artérias renais todos não tinham achados relevantes.
A avaliação inicial sugere diagnóstico de hiperaldosteronismo primário (HAP) devido à presença de hipocalemia, renina bloqueada e níveis séricos de aldosterona elevados. O paciente relata a presença de câimbras, sensação de fraqueza em membros inferiores e palpitações, sintomas que poderiam ser explicados pela hipocalemia.
O HAP é uma das causas mais comuns de hipertensão secundária, correspondendo a cerca de 5% dos casos de hipertensão na atenção primária e 10% em casos encaminhados para centros de referência. Em pacientes com hipertensão resistente, a prevalência pode chegar a 14 a 21% [3, 4]. Apesar de relativamente comum, ainda é subdiagnosticada.
O HAP é caracterizado por uma produção inapropriada e autônoma de aldosterona, independente da sobrecarga de sódio e que não é capaz de ser regulada pelos níveis de angiotensina II e de potássio. O excesso de aldosterona leva à retenção de sódio, supressão de renina, hipertensão, doenças cardiovasculares e hipocalemia (em graus variáveis). A hipocalemia não está sempre presente na HAP, ocorrendo em cerca de 9% a 37% dos pacientes (em geral, nos casos mais graves e crônicos).
A importância do diagnóstico é o fato de ser potencialmente curável. Além disso, níveis cronicamente altos de aldosterona, por si só, resultam em maior morbidade e mortalidade cardiovascular para os pacientes com HAP em relação àqueles portadores de hipertensão essencial com os mesmos níveis pressóricos [3].
Os critérios para investigação de HAP são [3]:
- HAS e hipocalemia espontânea ou induzida por diurético.
- HAS e incidentaloma adrenal.
- Pressão arterial > 150 x 100 mmHg em 3 medidas em dias diferentes.
- HAS resistente.
- HAS controlada com 4 ou mais drogas.
- HAS e síndrome da apneia/hipopneia obstrutiva do sono.
- HAS e história familiar de HAS ou doença cerebrovascular em < 40 anos
- Parentes de 1º grau hipertensos de pacientes com HAP
O método mais sensível de rastreio de HAP é calcular a relação entre as dosagens de aldosterona e renina plasmáticas. A renina pode ser medida de duas formas que resulta em valores diferentes: atividade de renina plasmática e concentração de renina. O rastreio de HAP é considerado positivo se:
- Aldosterona ≥ 10 ng/dL E
- Razão aldosterona/concentração de renina ≥ 2 ou aldosterona/atividade de renina plasmática ≥ 20 a 30 (varia conforme a referência)
Os fatores a seguir interferem nos valores desses exames e na interpretação:
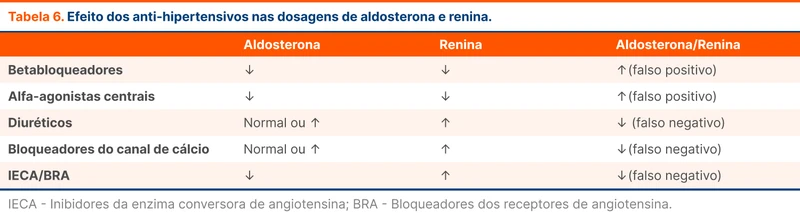
- As dosagens devem ser feitas pela manhã, pelo menos duas horas após o paciente ter se levantado, e 5 a 15 minutos após o paciente estar sentado; dieta irrestrita de sal e, de preferência, com os níveis de K corrigidos (> 4,0 mEq/L);
- Sempre retirar diuréticos, principalmente os antagonistas mineralocorticóides, por pelo menos quatro semanas. Essas drogas podem resultar em valores elevados de renina, aumentando o risco de falso negativo. O rastreio pode ser coletado com outros anti-hipertensivos, mas se o resultado é negativo e o paciente tem um alto nível de suspeição, deve-se repetir o rastreio usando medicações que interferem menos nos níveis de aldosterona e renina (ex: hidralazina, bloqueadores de canais de cálcio não dihidropiridínicos, alfa-bloqueadores e agonistas alfa -2 centrais). O efeito dos anti-hipertensivos nos níveis de aldosterona e renina está disposto na tabela 6;
- Atentar às unidades utilizadas na dosagem de aldosterona e renina (ou atividade plasmática de renina): ng/dl, mUi/ml e ng/ml/h, respectivamente.
Após um rastreio positivo, como o do paciente (relação aldosterona/renina de 10,5), o próximo passo é definir a necessidade de um teste confirmatório. O objetivo desses testes é desbloquear a renina (como o teste da furosemida) ou tentar reduzir os níveis de aldosterona (como o teste da infusão salina). Quando não se consegue tal objetivo, considera-se o teste positivo, confirmando o diagnóstico de HAP. Estão dispensados do teste confirmatório os pacientes que apresentam aldosterona ≥ 20 ng/dl, renina suprimida e hipocalemia. Não existe evidência de superioridade de um teste confirmatório em relação a outro. A escolha depende das características do paciente, custo, rotina do laboratório e experiência local (ex: evitar o teste de infusão salina em pacientes com PA muito descontrolada ou ICC e evitar a furosemida, por exemplo, em pacientes com risco de arritmia).
O último passo diagnóstico é a investigação da causa do HAP. As causas mais comuns são a presença de um aldosteronoma (adenomas adrenais secretores de aldosterona), que correspondem a cerca de 40% dos casos, e a secreção bilateral de aldosterona (geralmente por hiperplasia), correspondendo a 60% dos casos. Menos de 1% dos casos são por condições genéticas (HAP familiar).
Na investigação é necessário um exame de imagem, como uma tomografia de abdômen com protocolo de adrenais, de preferência com cortes finos. Os aldosteronomas serão tratados com adrenalectomia e a doença bilateral receberá tratamento medicamentoso.
Para o caso, a solicitação de testes confirmatórios não é necessária, porque o paciente preenche critérios que o dispensam desses testes (aldosterona ≥ 20 ng/dl, renina suprimida e hipocalemia). Agora deve-se realizar uma imagem de abdome para a elucidação da causa do HAP.
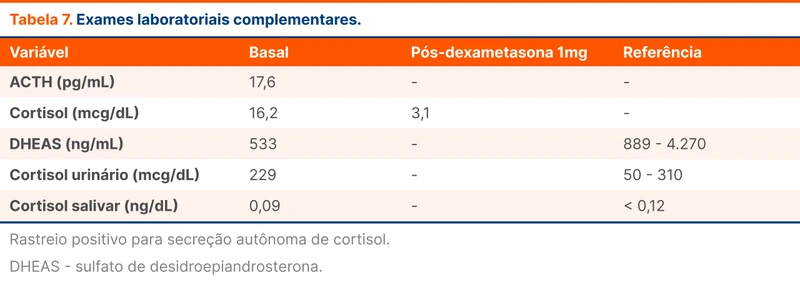
Em todos os indivíduos com HAP deve-se pesquisar a cossecreção de cortisol, que ocorre em 30% dos pacientes. A pesquisa é feita com dosagem de cortisol pós supressão com 1 mg de dexametasona. Se positiva, favorece a necessidade de adrenalectomia nos pacientes com doença unilateral. Adicionalmente, indica a administração de hidrocortisona na indução anestésica para evitar uma crise de insuficiência adrenal, já que a secreção autônoma de cortisol da adrenal acometida pode estar suprimindo o funcionamento da adrenal contralateral. A cossecreção é considerada positiva quando o cortisol pós dexametasona é > 1,8 mcg/dl.
Nos exames de admissão, o paciente apresenta um valor de hemoglobina 16,1 g/dL. Na história clínica, o paciente negava tabagismo. Considerando ainda causas de hipertensão secundária, a possibilidade de síndrome da apneia e hipopneia obstrutiva do sono (SAHOS) é favorecida por esse achado do hemograma. A SAHOS tem prevalência alta na população e estima-se que em hipertensos resistentes sua prevalência pode chegar em até 56% dos pacientes. A SAHOS é inclusive comumente associada a HAP, tanto que ocorrência de HAS e SAHOS é critério de rastreio de HAP [3, 4]. Poderiam ser investigados nesse paciente sintomas de SAHOS, como roncos noturnos, episódios testemunhados de apneia no sono, sonolência diurna e cefaleia matinal, além de utilizar questionários de triagem (Epworth e Stop-Bang) e, se alta suspeição, solicitar-se polissonografia.
Considerando a hipótese de HAP, a equipe responsável pelo caso solicitou uma tomografia de abdome para o paciente (figura 1). O paciente mantinha medidas de PA na enfermaria de cerca de 150/80 mmHg.
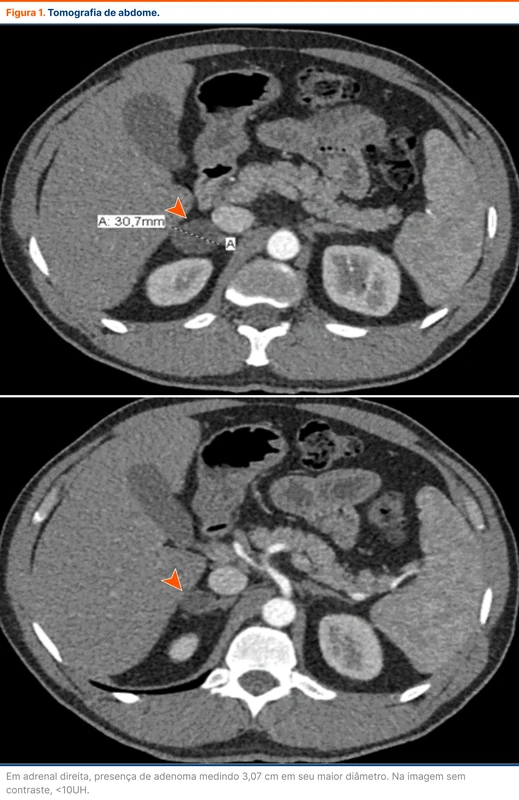
Em adrenal direita, presença de adenoma medindo 3,07 cm em seu maior diâmetro. Na imagem sem contraste, <10UH.
Foram convocadas as equipes de endocrinologia e urologia para seguimento do caso. Diante da imagem, a equipe de endocrinologia acrescentou à prescrição do paciente espironolactona 150 mg/dia para auxiliar no manejo pressórico antes da cirurgia. Também solicitaram outros exames laboratoriais, entre eles cortisol pós dexametasona. A equipe de Urologia agendou a cirurgia do paciente em três a quatro semanas com o plano de realizar adrenalectomia direita por laparoscopia.
A presença de nódulo em adrenal não é um achado definitivo de aldosteronoma. A maioria dos adenomas adrenais são não-funcionantes. Portanto, a adrenalectomia não deve ser indicada apenas por ter um nódulo na tomografia. Além disso, a sensibilidade da tomografia é comprometida quando os nódulos são muito pequenos. Ou seja, um aldosteronoma pode passar despercebido e o paciente ser diagnosticado com uma doença bilateral.
O cateterismo de veias adrenais é considerado o melhor exame para definição da etiologia e direcionamento do tratamento. Sua função é verificar se existe lateralização da produção de aldosterona e, assim, indicar adrenalectomia para os casos de hiperprodução unilateral de aldosterona, situação em que existe possibilidade de cura cirúrgica.
Casos muito suspeitos de adenoma unilateral podem ser submetidos a cirurgia sem a realizacao do cateterismo. Pela Endocrine Society, todos os seguintes criterios devem estar presentes [3]:
- Idade menor de 35-40 anos
- Hipocalemia espontânea
- Aumento expressivo de aldosterona
- Lesão unilateral de adrenais com características de adenoma
- Adrenal contralateral sem anormalidades.
Esses critérios reduzem as chances da imagem corresponder a um adenoma não funcionante, cuja frequência aumenta proporcionalmente com a idade.
A imagem do paciente aponta fortemente para a hipótese diagnóstica de um aldosteronoma na adrenal direita. A adrenalectomia direita está bem indicada e a maior preocupação deve ser o adequado preparo para a cirurgia.
No preparo pré-operatório de adrenalectomia, deve-se objetivar um adequado controle pressórico, correção dos níveis de potássio e o desbloqueio da renina (renina > 10 mUI/mL). Com o intuito de prevenir hipoaldosteronismo hiporreninêmico no pós-operatório, estes objetivos idealmente devem ser atingidos com a utilização de antagonistas mineralocorticóides - espironolactona ou eplerenona. Esse é o motivo para a cirurgia do paciente ser agendada para quatro semanas após a alta.
Antes da cirurgia o paciente deve obrigatoriamente ter alguns pontos checados: níveis de pressão arterial, potássio e renina.
Quando a etiologia do HAP é definida como produção bilateral de aldosterona, o tratamento preconizado é o uso de um esquema anti-hipertensivo com espironolactona (50 a 400 mg/dia). Esse tratamento também pode ser utilizado como alternativa conservadora à adrenalectomia nos pacientes com adenoma produtor de aldosterona que recusam ou não têm condições clínicas de operar. Recomenda-se iniciar com 50 mg e aumentar em 50 mg a cada três a quatro semanas. Por causa dos possíveis efeitos colaterais da espironolactona, pode-se lançar mão de amilorida e hidroclorotiazida na tentativa de reduzir suas doses. Em homens, a mastalgia e ginecomastia podem ser fatores limitantes para a otimização da dose. Esses efeitos não acontecem com uso do eplerenone, sendo uma boa opção principalmente para pacientes do sexo masculino. Além do controle pressórico, o objetivo do tratamento é normalizar o potássio e manter os níveis de renina desbloqueados (≥ 10 a 12 uUi/ml ou APR > 1ng/ml/h), o que esteve associado a redução da incidência cumulativa de eventos cardiovasculares [5].
Na semana da cirurgia, o paciente compareceu ao ambulatório com os exames demonstrando K 4,1, aldosterona 20 ng/dl e renina 14 uUI/mL. Os demais exames pré-operatórios estavam normais.
Foi então submetido a adrenalectomia direita videolaparoscópica. A análise anatomopatológica mostrou adenoma do córtex da suprarrenal medindo 3,5 cm. Em função do rastreio positivo de secreção autônoma de cortisol, administrado hidrocortisona no intra-operatório e mantido corticóide por via oral até o 5º dia de pós-operatório.
Exames na véspera da alta hospitalar: aldosterona 5,3 ng/dL, renina 457 uUI/ml, Na 141 mEq/L e K 4,4 mEq/L, cortisol sérico de 10,3 mcg/dl. Recebeu alta com 25 mg de losartana, que foi suspensa em consultas posteriores.
Após a cirurgia, deve-se manter o paciente sem espironolactona e, se possível, sem outras medicações anti-hipertensivas para que o controle pressórico seja avaliado. Se o paciente se mantiver hipertenso, opta-se pela introdução de bloqueadores de canal cálcio diidropiridínicos (ex: anlodipino); evita-se o uso de IECAs ou BRAs pelo risco de hipoaldosteronismo e hipercalemia. Antes da alta (em geral entre o 3° e 5° dias de PO), dosa-se aldosterona e renina para verificar a cura bioquímica (correção de hipocalemia e normalização dos valores - em geral, aldosterona < 10ng/dl). Recomenda-se nova avaliação hormonal em 30 dias e a cada três meses após a cirurgia, até a definição do sucesso clínico (PA < 140/90 mmHg, sem uso de medicações anti-hipertensivas após 6 meses de seguimento) e bioquímico. Em casos onde há cossecreção de cortisol, deve-se manter o corticoide ambulatorialmente em dose de reposição até que haja recuperação completa do eixo corticotrófico. No caso em questão, não foi necessária a manutenção pois o cortisol antes da alta hospitalar já evidenciava a síntese adequada de cortisol.
O sucesso clínico completo é observado em cerca de 50% dos pacientes (variação entre 35% a 80%), porém, a cura bioquímica resulta em melhora clínica significativa no controle pressórico, com redução do número de medicações anti-hipertensivas.
Alguns pontos de aprendizagem sobre o caso que você não pode esquecer:
- Crises hipertensivas que cursam com lesões agudas e progressivas de órgão-alvo (emergências hipertensivas) estão associadas com grande morbimortalidade e requerem tratamento imediato em UTI. As urgências hipertensivas não estão associadas com desfechos adversos de curto prazo e podem ser manejadas ambulatorialmente;
- Hiperaldosteronismo primário é prevalente e subdiagnosticado. Um quadro clínico pouco evidente retarda em muitos anos o diagnóstico, atrasando um tratamento que tem potencial de cura cirúrgica. Os critérios de rastreio devem ser aplicados para identificar mais pacientes com HAP.
- Após rastreio positivo, submeter os pacientes a testes confirmatórios é necessário para afastar falsos positivos.
- A diferenciação das causas de HAP depende da realização de imagem e, quando necessário, cateterismo de veias adrenais. Se recursos não estiverem disponíveis, sugere-se encaminhar o paciente a centros terciários para que a investigação seja continuada e o tratamento correto definido;
- Se a causa de HAP for um aldosteronoma, o tratamento é adrenalectomia do lado acometido. Se a doença for bilateral, o tratamento anti-hipertensivo deve obrigatoriamente conter um antagonista mineralocorticoide.
Aproveite e leia:
Hiperaldosteronismo Primário
Em abril de 2022, o British Medical Journal (BMJ) lançou uma revisão sobre hiperaldosteronismo primário (HP). Indo da investigação ao tratamento, o artigo coloca em pauta o porquê de ser uma condição tão subdiagnosticada. Trazemos aqui os principais pontos.
Investigação de Nódulo Tireoidiano - Diretriz Europeia de 2023
Cerca de 60% da população adulta tem um ou mais nódulos de tireoide. Em outubro de 2023 a Associação Europeia de Tireoide publicou uma diretriz sobre investigação e manejo dos nódulos da tireoide. Esse tópico resume as principais informações da publicação.
Varfarina: Bulário e Quando Preferir em Relação aos DOACs
A varfarina é um anticoagulante antagonista da vitamina K. Ela atua inibindo os fatores de coagulação dependentes desse nutriente: proteína C, proteína S e fatores de coagulação II, VII, IX e X. Os anticoagulantes orais diretos (DOAC) são a primeira escolha em muitas situações, mas a varfarina ainda tem espaço na prática. Uma recente revisão do Journal of the American College of Cardiology avaliou essa questão e um ensaio clínico de janeiro de 2024 publicado no Circulation estudou a varfarina em indivíduos frágeis. Este tópico revisa o uso atual de varfarina.
Insuficiência Adrenal Induzida por Corticoides e Desmame de Corticoides
A European Society of Endocrinology e a Endocrine Society publicaram uma diretriz de orientações para diagnóstico e tratamento de insuficiência adrenal induzida por corticoides em abril de 2024. Este tópico revisa o tema e como fazer o desmame de corticoides.
Escore de Internação de Síncope
Vários escores já foram desenhados para estimar o risco de eventos adversos no paciente com síncope, porém nenhum é amplamente utilizado. Em abril de 2022, foi publicado no Annals of Internal Medicine o estudo BASEL IX uma grande coorte com validação externa do escore canadense de síncope. Este tópico traz os resultados do estudo e revisa a decisão de internar um paciente por síncope.
