Diagnóstico de Infecção pelo Clostridioides difficile
A infecção pelo Clostridioides difficile (ICD, previamente chamado de Clostridium difficile) é um problema cada vez mais comum. Em setembro de 2023 foi publicado no JAMA o trabalho Multistep Testing Algorithms for Clostridioides difficile Infection, parte da série JAMA Diagnostic Test Interpretation [1]. Este tópico revisa o diagnóstico dessa doença.
O que é a infecção pelo Clostridioides difficile (ICD)
O C. difficile é um bacilo anaeróbio gram-positivo que se prolifera no trato intestinal humano quando há desequilíbrio da flora intestinal. Isso ocorre habitualmente como uma consequência do uso de antibióticos. A colonização - presença assintomática do organismo no intestino - ocorre em até 21% dos pacientes hospitalizados [2]. Fora do intestino, o bacilo fica na sua forma de esporo e sobrevive fora do cólon, resistindo ao calor [3, 4].
Para prevenir novas infecções deve-se realizar a precaução de contato em pacientes infectados. Em caso de surtos, preferir a higienização com água e sabão pela maior eficácia de remover os esporos [2, 4, 5].
Dentro do intestino, a forma vegetativa do bacilo produz as toxinas A e B, causadoras da diarreia da ICD. As fezes costumam ser amolecidas com mais de três evacuações em um dia, às vezes com sangue e muco. Sintomas que podem aparecer no processo infeccioso são febre, hiporexia e dor no abdome inferior [2].

Sinais de gravidade são a presença de leucocitose maior que 15.000 células/microL ou creatinina sérica maior que 1,5 mg/dL [6]. A apresentação mais grave é a colite fulminante. Apesar de rara (menos de 5% dos casos), tem alta mortalidade (35-50%) e é caracterizada pela presença de íleo paralítico, megacólon e instabilidade hemodinâmica [5].
Fatores predisponentes à ICD
O fator de risco clássico é a exposição aos antibióticos. A clindamicina foi o antibiótico com maior risco para colite pseudomembranosa em um estudo de caso controle com cerca de 160 mil casos [7]. Outros antibióticos associados são as cefalosporinas de 3º e 4º geração, os carbapenêmicos e as fluoroquinolonas [5, 7].
Colonização pelo C. difficile também é fator de risco para ICD, assim como infecção prévia. Recorrência pode ocorrer em até 25% dos pacientes e é definida pelo ressurgimento dos sintomas e um teste positivo 2 a 8 semanas após um episódio de ICD confirmada e tratada adequadamente [8].
Mais de 80% dos casos de ICD têm exposição prévia aos cuidados de saúde e a hospitalização, mas existem casos sem esses fatores. Outro fator que aumenta o risco são doenças crônicas, em especial doença inflamatória intestinal, hepatopatia, nefropatia e câncer [5].
Um grupo especial de pacientes com maior incidência de ICD são os transplantados de órgãos sólidos. Nesses pacientes, a pesquisa do C. difficile deve ser realizada no contexto de diarreia independente do uso prévio de antibióticos e de internação. A prevalência chega a ser cinco vezes maior em relação à população geral [9, 10]. Os transplantados de células hematopoéticas também têm uma maior prevalência de ICD, com incidência até nove vezes maior que a população geral.
Testes diagnósticos para ICD
Os testes diagnósticos para infecção pelo C. difficile podem ser organizados pelas suas sensibilidades e especificidades. O PCR e o antígeno glutamato desidrogenase (GDH) têm alta sensibilidade e demonstram a presença do C. difficile, sem diferenciar infecção de colonização. O PCR identifica apenas cepas toxigênicas, tendo assim mais especificidade que o antígeno GDH. Já as toxinas A e B marcam a infecção ativa e têm alta especificidade, mas menor sensibilidade (tabela 2). Pacientes assintomáticos não devem ser testados pela possibilidade de serem colonizados resultando em tratamentos desnecessários.

O artigo do JAMA discute sobre a estratégia de múltiplas etapas para diagnóstico de ICD, que envolve um teste de triagem seguido de um teste de confirmação. Os testes de triagem inicial devem ter alta sensibilidade e alto valor preditivo negativo para excluir a infecção caso o resultado seja negativo. Tanto GDH quanto PCR podem ser usados como testes iniciais, mas o GDH é mais disponível e tem menor custo. Quando o teste de triagem é positivo, a certeza do diagnóstico de infecção ativa deve ser feita pelo teste específico de detecção das toxinas A e B [2, 8]. Essa estratégia é recomendada pelas diretrizes americana de 2018 e europeia de 2016 [5, 11]. Uma adaptação dos algoritmos propostos está no fluxograma 1.
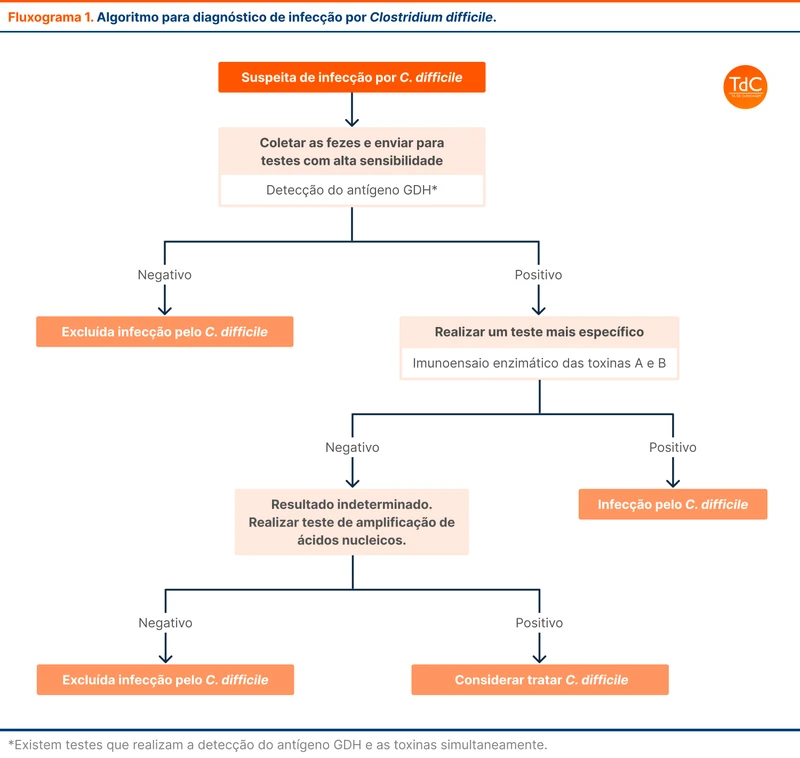
Com o uso dessa estratégia, há três cenários possíveis:
- Teste de triagem (GDH ou PCR) negativo: exclui ICD
- Teste de triagem (GDH ou PCR) e teste de confirmação (toxina A e B) positivos: confirma ICD
- Teste de triagem (GDH ou PCR) positivo e teste de confirmação (toxina A e B) negativo: resultado indeterminado
A interpretação do terceiro cenário é diferente a depender do teste usado inicialmente.
Resultado indeterminado com teste de triagem GDH: nesse cenário o paciente pode ter ICD e a produção de toxina estar abaixo do nível de detecção do teste de toxinas ou o teste identificou colonização por Clostridiodes e a diarreia tem outra causa. O PCR, quando disponível, pode ajudar nesses casos. Se PCR negativo, está excluído ICD, indicando uma provável colonização por cepa não toxigênica. Caso o PCR seja positivo, isso pode indicar ICD ou colonização por cepa toxigênica. Nesse caso, a decisão de tratamento deve ser individualizada, considerando a probabilidade e os riscos da infecção.
Resultado indeterminado com teste de triagem PCR: como descrito acima, esse resultado pode indicar ICD ou colonização por cepa toxigênica. Existe a possibilidade de realização de cultura específica para Clostridiodes, mas sua disponibilidade é baixa. A decisão de tratamento é individualizada e o tratamento deve ser considerado a depender da suspeita clínica.
Por último, em casos selecionados, a colonoscopia pode ser realizada para identificar a presença de colite pseudomembranosa.
Aproveite e leia:
Abordagem à Diarreia Crônica
Diarreia crônica é uma condição frequente e com diversas etiologias, desde etiologias benignas a doenças potencialmente graves. A variedade de causas e formas de investigação pode dificultar uma abordagem diagnóstica estruturada. Este tópico detalha as etapas fundamentais para o diagnóstico diferencial da diarreia crônica, destacando os exames e abordagens necessários.
Lesão Renal Aguda Induzida por Drogas
Medicamentos são uma das principais causas de lesão renal aguda, podendo corresponder de 14 a 26% de todas as causas, a depender da coorte. Essa revisão traz as principais drogas, divididas em 3 principais mecanismos: Lesão Tubular, Nefritite Intersticial e Nefropatia por Cristais. Vamos ver os pontos principais:
Ultrassom à Beira Leito para Diagnóstico de Fasciíte Necrosante
A fasciite necrosante é uma infecção grave e rara. O diagnóstico é difícil porque tem poucos sinais clínicos indicativos ou exames laboratoriais específicos. Em março de 2023 foi publicado no The American Journal of Emergency Medicine uma revisão sistemática sobre o uso da ultrassonografia à beira leito no diagnóstico dessa condição e aproveitamos para revisar o assunto.
Angiodisplasia do Trato Gastrointestinal
Angiodisplasia é uma anomalia vascular encontrada comumente no trato gastrointestinal. É causa frequente de sangramento digestivo baixo e anemia ferropriva em idosos. Dois estudos recentes avaliaram o octreotide e a talidomida no manejo de angiodisplasias. Este tópico revisa o tema e traz os resultados dos estudos.
Fibrilação Atrial Durante Hospitalização
Fibrilação atrial no paciente internado é comum e o manejo tem particularidades quando comparado ao de pacientes ambulatoriais ou em sala de emergência. Em março de 2023, a American Heart Association publicou um posicionamento sobre fibrilação atrial nova em pacientes hospitalizados. Este tópico resume as principais recomendações do documento.
