Fibrilação Atrial
Fibrilação atrial (FA) é a arritmia sustentada mais comum. A prevalência está aumentando em função do crescimento de alguns fatores de risco, da sobrevida de pacientes com doenças cardiovasculares e do envelhecimento populacional. Essa revisão traz as principais recomendações da diretriz americana de FA publicada em dezembro de 2023 pelo American College of Cardiology em conjunto com a American Heart Association [1].
Nova classificação da fibrilação atrial
A diretriz traz uma nova classificação de FA dividida em quatro estágios, com manejo diferente para cada estágio.
- Estágio 1 - em risco de FA
- Estágio 2 - pré FA
- Estágio 3 - FA:
- 3a: FA paroxística (intermitente em que episódios duram menos de 7 dias)
- 3b: FA persistente (contínua em que episódios duram mais do que 7 dias e necessitam de intervenção para reversão)
- 3c: FA persistente de longa data (contínua e que dura mais do que 1 ano)
- 3d: FA após ablação bem sucedida
- Estágio 4 - FA Permanente: quando não há mais tentativas para controle de ritmo
Os estágios 1 e 2 são as principais novidades na classificação atual em comparação com a diretriz americana anterior de 2014 [2]. Já a diretriz da European Society of Cardiology (ESC) de 2020 inicia sua classificação a partir da identificação da arritmia e segue uma estrutura semelhante ao estágio 3 [3].
Os pacientes do estágio 1 (em risco de FA) são os que têm fatores de risco, mas não manifestaram a doença. Fatores de risco não modificáveis são idade, sexo masculino e predisposição genética. Os principais fatores de risco modificáveis e que devem ser abordados são obesidade, sedentarismo, hipertensão, apneia do sono, diabetes e uso de álcool.
Os pacientes em estágio 2 (pré FA) tem evidência estrutural ou elétrica que predispõe ao aparecimento de FA. Por exemplo, aumento atrial, ectopias atriais frequentes, flutter atrial e curtos períodos de taquicardia atrial. A diretriz sugere que esses pacientes podem ser acompanhados de maneira mais próxima, mas não apresenta uma estratégia específica.
A partir do estágio 3 o paciente tem o diagnóstico de FA. O tratamento deve ser focado em três pilares: controle dos sintomas, tratamento dos fatores de risco e prevenção de tromboembolismo.
O manejo dos sintomas pode ser feito de duas formas: controle de ritmo ou controle de frequência. O controle de ritmo é a estratégia de tentar restaurar o ritmo sinusal. O controle de frequência cardíaca (FC) é quando tenta-se manter a resposta ventricular em níveis desejados mesmo estando em FA
Controlar a frequência cardíaca ou controlar o ritmo?
Para muitos pacientes, os desfechos com as duas estratégias são similares. Os estudos AFFIRM e HOT CAFE não encontraram diferença na mortalidade ou no desfecho composto (mortalidade, tromboembolismo e sangramento) entre os dois tratamentos [4, 5].
Apesar disso, as evidências indicam que o controle do ritmo pode ser superior em dois grupos de pacientes: aqueles com diagnóstico recente de FA e aqueles com insuficiência cardíaca com fração de ejeção reduzida (ICFEr).
A diretriz recomenda (2a) o controle de ritmo para pacientes com FA há menos de um ano, baseando-se principalmente no estudo EAST-AFNET 4 [6]. Esse trabalho randomizou 2733 pacientes com FA há menos de um ano, sendo o primeiro episódio em um terço dos pacientes. Houve redução de 25% no desfecho composto de mortalidade, AVC e hospitalizações por insuficiência cardíaca (IC) ou síndrome coronariana aguda nos que controlaram o ritmo, em comparação com controle de frequência.
Estudos observacionais indicam que o controle do ritmo precoce é associado a uma maior chance de manutenção a longo prazo do ritmo sinusal, além da redução da progressão da doença [7, 8].
Para pacientes com FA e ICFEr, o controle de ritmo pode melhorar desfechos como mortalidade e hospitalizações, de acordo com os estudos CABANA e CASTLE-AF [9, 10]. Mesmo com a FC controlada, é recomendado controle de ritmo para avaliar se a FA está contribuindo para redução da fração de ejeção.
Como controlar o ritmo?
O controle de ritmo ocorre em duas etapas:
- Cardioversão (elétrica ou medicamentosa)
- Manutenção do ritmo sinusal
Cardioversão
A cardioversão pode ser elétrica ou medicamentosa e objetiva a reversão do ritmo de FA em sinusal.
A cardioversão elétrica sincronizada é recomendada como uma opção inicial de controle de ritmo. Pode ser feita de maneira planejada em pacientes estáveis ou na urgência em caso de sinais de instabilidade. Quando a indicação é por instabilidade clínica em consequência de FC excessivamente elevada, a cardioversão elétrica deve ser feita de imediato, independente do risco de embolização. O pré tratamento com antiarrítmicos pode ser benéfico para a manutenção do ritmo sinusal após o procedimento.
A cardioversão farmacológica é uma alternativa para pacientes hemodinamicamente estáveis. A principal opção no Brasil é a amiodarona endovenosa, que demora mais tempo para reversão do ritmo do que outros medicamentos. Propafenona pode ser utilizada para pacientes sem doença cardíaca estrutural por via oral, um esquema chamado pill in the pocket [11]. Um quarto dos pacientes apresentam hipotensão transitória ou arritmias como flutter e bradicardia sintomática após cardioversão com propafenona. Além disso, podem ter tontura, dispneia, exacerbação de IC, náuseas, alterações visuais e outras arritmias. Por isso, é sugerido que a primeira cardioversão com propafenona seja realizada em ambiente monitorado. Um betabloqueador geralmente é feito pelo menos 30 minutos antes da propafenona para evitar complicações da cardioversão. Agentes antiarrítmicos citados em referências internacionais que não estão disponíveis no Brasil são ibutilida, flecainida e dofetilida.
Independente do método de cardioversão, existe aumento do risco de embolização após a cardioversão de uma FA com mais de 48 horas de duração. Duas estratégias são sugeridas para minimizar esse risco. Uma delas é anticoagular o paciente (independente do CHA²DS²VASc) por três semanas antes do procedimento. Outra é fazer um exame de imagem (comumente um ecocardiograma transesofágico) antes da cardioversão para averiguar a presença de trombo e realizar o procedimento com segurança. Se não houver trombo, a cardioversão pode ser feita. Se houver trombo, o paciente deve ser anticoagulado por três a seis semanas e um novo ecocardiograma deve ser feito ao final desse período. Se houver resolução do trombo, o paciente pode ser cardiovertido.
Após a cardioversão, o paciente deve ser anticoagulado por quatro semanas, independente do CHA²DS²VASc ou do método da cardioversão.
Manutenção do ritmo sinusal
Após a cardioversão, a manutenção do ritmo sinusal pode ser feita por ablação e por medicamentos antiarrítmicos. Os principais medicamentos para manutenção do ritmo sinusal são amiodarona, sotalol e propafenona.
A amiodarona é amplamente disponível e pode ser utilizada para pacientes com doença cardíaca estrutural. É a primeira opção para pacientes com IC. O paciente deve ter recebido 6 a 10 g de amiodarona até que seja reduzida para dose de manutenção, de 200 mg/dia. O uso a longo prazo está associado a diversas complicações como fibrose pulmonar, hipo ou hipertireoidismo, hepatotoxicidade, alterações de pele, neuropatia periférica, bradicardia sinusal, prolongamento do intervalo QT e torsades de pointes.
Sotalol é uma opção para pacientes com doença cardíaca mas é menos eficaz do que amiodarona para evitar recorrência de FA. Não deve ser prescrito para pacientes com prolongamento do QT, hipocalemia, hipomagnesemia ou bradicardia.
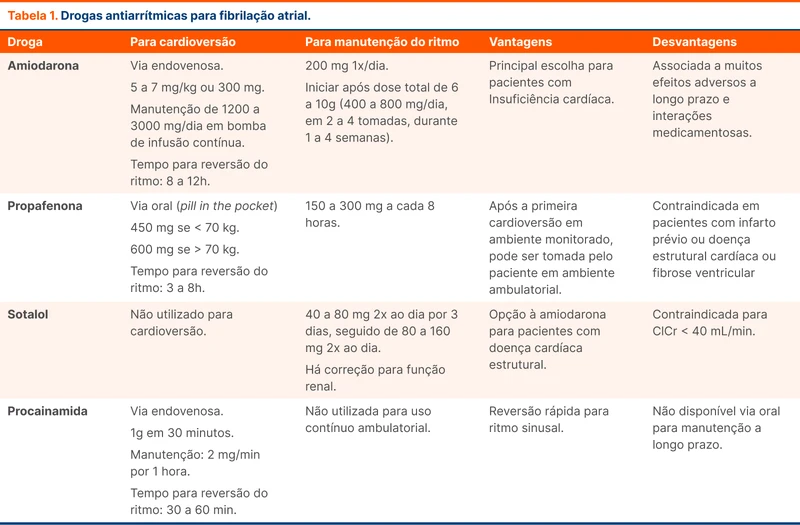
Propafenona é indicada para pacientes sem infarto prévio ou doença estrutural cardíaca ou fibrose ventricular, na dose de 150 a 300 mg a cada 8 horas.
Escolhi controlar o ritmo: devo indicar ablação?
A ablação por cateterismo visa isolar as regiões das veias pulmonares, onde surgem a maior parte dos estímulos que levam à fibrilação atrial.
A ablação melhora sintomas, diminui a recorrência de FA e lentifica a progressão para FA persistente. Os estudos MANTRA-AF, EARLY-AF e STOP-AF First, indicaram maior sucesso da ablação em comparação com medicamentos para controle de sintomas ou recorrência de FA [12-14]. Esses estudos envolveram pacientes relativamente jovens, em torno de 60 anos e com poucas comorbidades. Quanto mais cedo for indicada a ablação, maior é a chance de sucesso. As complicações mais sérias associadas com a ablação são a fístula átrio-esofágica (0,2%), estenose de veia pulmonar (0,1 a 0,8%), AVC (0,1 a 1,0%), derrame pericárdico (0,4 a 1,5%) e complicações vasculares (1 a 7%). A frequência de óbito é em torno de 0,1 a 0,4% dos procedimentos.
A classe de recomendação de ablação para pacientes com insuficiência cardíaca com fração de ejeção ventricular reduzida (IC FEVEr) foi elevada, recebendo agora a recomendação máxima da diretriz (1A). Isso é baseado no estudo CASTLE AF. Algumas críticas a esse trabalho são o viés por não ser cegado e o encerramento precoce que levou a uma perda do poder do trabalho. Além disso, os pacientes tinham média de idade de 62 anos, com poucas comorbidades.
As seguintes características aumentam a chance de benefício com a ablação:
- IC FEVEr
- Pacientes mais jovens
- Átrios de menores tamanhos
- Ausência de doenças graves ou alterações estruturais ou fisiológicas que permanecerão como substrato para novos episódios de FA
- Exemplos: estenose ou insuficiência mitral graves, cor pulmonale ou cardiomiopatias infiltrativas avançadas, como amiloidose.
Não é claro quais pacientes podem parar de usar anticoagulação após uma ablação bem sucedida. Estudos estão sendo feitos nesse momento para responder a essa pergunta.
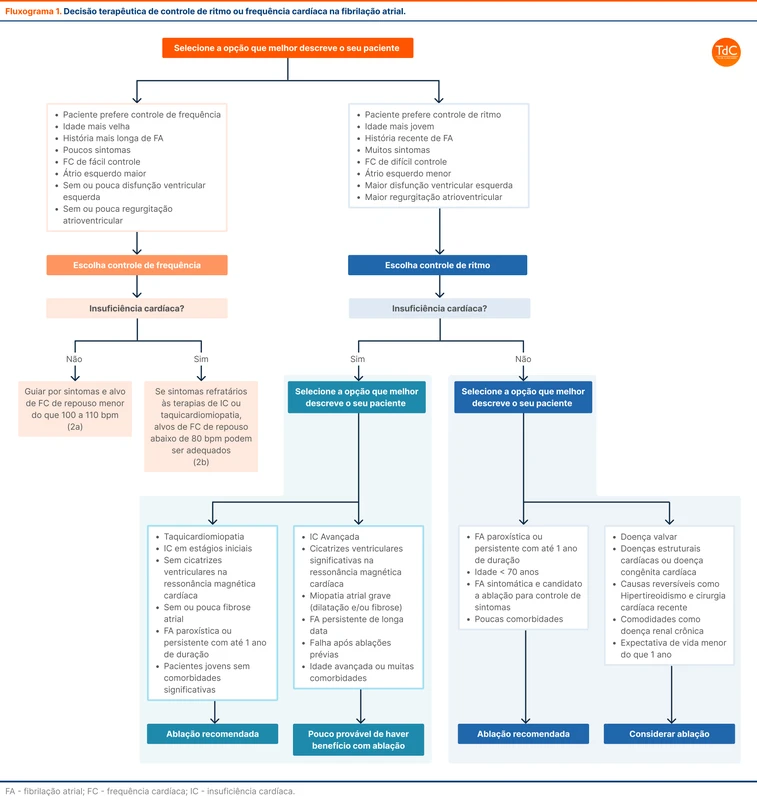
O fluxograma 1 auxilia nas decisões de controle de ritmo ou frequência e indicação de ablação. Ou disponível aqui de forma interativa para auxiliar na decisão de controle de ritmo ou frequência.
Escolhi controlar a frequência cardíaca: como fazer?
A meta de controle de FC recomendada é manter abaixo de 100 a 110 bpm. O estudo ECR RACE II não encontrou diferenças entre um grupo com FC < 110 bpm e outro com meta de FC < 80 bpm. Uma crítica desse trabalho é a pequena diferença, de apenas 10 bpm, entre os grupos estudados.
Algumas populações podem se beneficiar de controle com FC mais baixas:
- Taquicardiomiopatia: quando a função cardíaca sofre prejuízo pelo aumento da FC.
- Pacientes com CDI: para redução do risco de choque inapropriado
- Pacientes com terapia de ressincronização cardíaca: para preservar a função cardíaca
- Doença do nó sinusal com síndrome taquibradi e com marcapasso: para redução do risco de hospitalização
- Sintomáticos: para melhor controle dos sintomas
Os medicamentos de primeira linha são os betabloqueadores e os bloqueadores de canal de cálcio (BCC) cardiosseletivos, diltiazem e verapamil. Os BCC são contraindicados em pacientes com insuficiência cardíaca pelo risco de piora da função ventricular.
Caso a FC não seja controlada com um dos medicamentos acima, as seguintes estratégias podem ser usadas:
- Combinação das drogas (BB e BCC). Essa opção pode ser limitada pelas comorbidades do paciente.
- Associar digoxina. Bradicardia, hipotensão e intoxicação devem ser monitoradas. Os níveis séricos devem ser mantidos abaixo de 1,2 ng/mL.
- Troca de estratégia, para controle de ritmo. Podem ser necessárias técnicas invasivas de controle de ritmo, como ablação.
O fluxograma 2 traduz um algoritmo proposto pela diretriz.
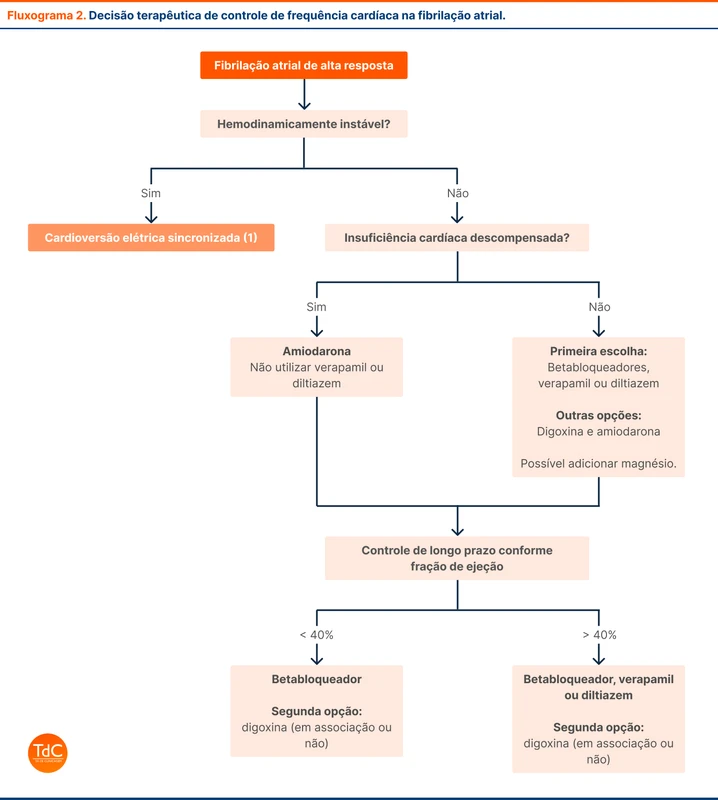
A ablação do nó atrioventricular é uma alternativa para pacientes com FA refratária ao uso de medicamentos em que o controle de ritmo não foi indicado ou falhou. Essa terapia obriga a implantação de marcapasso antes da realização do procedimento.
Para maiores detalhes sobre o controle farmacológico da frequência cardíaca, inclusive no cenário de emergência, acesse o tópico Controle Farmacológico de Frequência Cardíaca na Fibrilação.
Estimativa do risco tromboembólico, além do CHA²DS²VASc
A FA aumenta o risco de eventos tromboembólicos, principalmente o AVC. A anticoagulação é o método de prevenção desses eventos e sua indicação é feita com auxílio de ferramentas que estimam o risco tromboembólico. Essa decisão deve ser feita independentemente da escolha entre controle de ritmo ou frequência. O risco de sangramento também deve ser avaliado nesse momento.
Os pacientes são estratificados em:
- Baixo risco: < 1% ao ano
- Risco intermediário: 1-2% ao ano
- Alto risco:> 2% ao ano
A evidência para anticoagulação é mais robusta para pacientes de alto risco, mas há sugestão para anticoagulação a partir do risco intermediário.
O CHA²DS²VASc é considerado o escore mais validado. Leva em consideração idade, sexo, história de IC, hipertensão, eventos tromboembólicos prévios como AVC, doença vascular e diabetes. Uma pontuação de 2 pontos coloca o indivíduo no risco intermediário.
Outra novidade da diretriz foi o destaque para novos escores que estimam o risco tromboembólico. Os escores ATRIA e GARFIELD-AF melhoraram discretamente a discriminação do risco tromboembólico em comparação com o CHA²DS²VASc. O GARFIELD-AF traz dados detalhados sobre mortalidade e risco de sangramento, o que facilita a tomada de decisão compartilhada com o paciente.
Veja na tabela 2 a comparação entre os escores e como utilizar o GARFIELD-AF no vídeo.
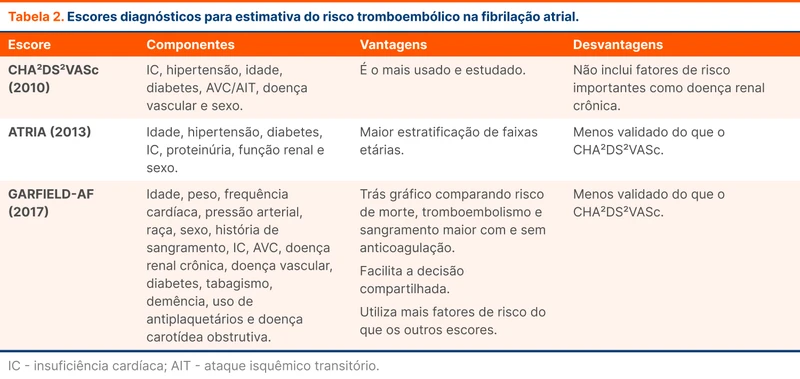
Alguns fatores de risco para FA são variáveis contínuas. Níveis diferentes dentro de um espectro podem significar riscos diferentes. Os escores não fazem esse tipo de distinção e dicotomizam esses fatores, sendo essa uma das limitações do seu uso.
Escores de risco de sangramento servem para identificação de fatores de risco modificáveis e também como dado para decisão compartilhada. Essas ferramentas discriminam mal entre pacientes que evoluem com ou sem sangramento e incluem fatores não específicos que também aumentam o risco tromboembólico. Alguns deles são o HAS BLED, HEMORR²HAGES e ATRIA.
Os anticoagulantes de ação direta (DOACs) são os medicamentos de primeira linha para anticoagulação, exceto nos casos de estenose mitral reumática moderada a grave ou valva mecânica, quando a varfarina é a primeira escolha com um alvo de INR entre 2 e 3.
Nos casos de FA e angioplastia coronariana por cateterismo, existe a necessidade de anticoagulação e terapia antiplaquetária ao mesmo tempo, o que aumenta o risco de sangramento. A diretriz recomenda terapia tripla (aspirina, inibidor da P2Y12 e DOAC) por uma a quatro semanas, em seguida suspender a aspirina e manter o inibidor da P2Y12 (por exemplo clopidogrel) e DOAC por um ano. Ao final desse um ano, é recomendado manter apenas o DOAC.
Nos casos de FA e doença renal crônica estágio 3, os DOACs são preferíveis do que a varfarina, com destaque para apixabana e rivaroxabana. Para o estágio 4, a recomendação é para DOAC ou varfarina. A diretriz recomenda fracamente que pacientes com ClCr < 15 ml/min ou em diálise podem fazer uso de varfarina com alvo de RNI entre 2 e 3 ou apixabana.
As doses indicadas estão na tabela 3.
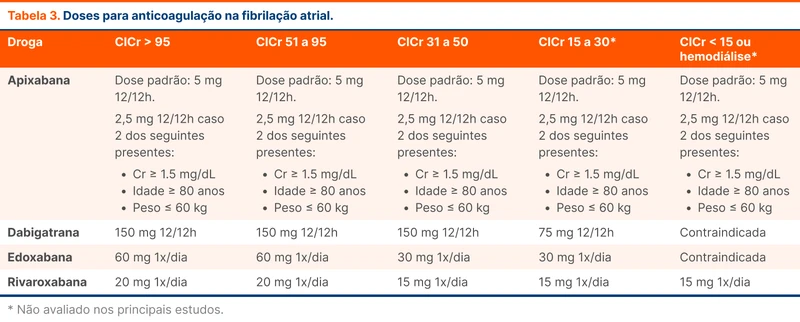
Para mais detalhes sobre anticoagulação na FA, leia o tópico Anticoagulação na Fibrilação Atrial com Doença Valvar Reumática.
Como evitar o tromboembolismo quando a anticoagulação é contraindicada?
Para pacientes com contraindicação da anticoagulação, o procedimento via percutânea de oclusão do apêndice atrial esquerdo é uma opção. Esse é o local onde a maior parte dos trombos se forma na FA. Alguns estudos indicaram que a oclusão é não inferior a varfarina e DOAC com redução do risco de sangramento.
Para pacientes que irão se submeter a cirurgia cardíaca e CHA²DS²VASc ≥ 2, é recomendado a exclusão do apêndice atrial no momento do procedimento cirúrgico.
Prescrição não farmacológica e controle de comorbidades
A diretriz aponta como um dos pilares da FA o tratamento das comorbidades. As recomendações para cada uma delas são:
- Obesidade: pacientes com IMC > 27 devem perder pelo menos 10% do peso
- Sedentarismo: recomendado exercícios moderados a intensos, pelo menos 210 minutos por semana. Exercícios de alta intensidade por mais de 3h por dia aumentam o risco de FA
- Álcool: eliminar ou minimizar o consumo, principalmente o Binge Drinking (grandes quantidades em curto período de tempo)
- Tabagismo: devem receber terapia para cessação
- Diabetes: controle de acordo com as metas de diretrizes da doença
- Hipertensão: controle de acordo com as metas de diretrizes da doença
Não há benefício na recomendação de abstenção de café para prevenção de episódios de FA, exceto para pacientes com FA sintomática que relatam o café como gatilho dos sintomas. Síndrome de apneia do sono (SAHOS) é um fator de risco para FA e pode ser útil o seu rastreio em pacientes com FA. Não é claro o papel do tratamento de SAHOS na manutenção do ritmo sinusal.
Episódios de alta frequência atrial, FA e Smartwatches
O crescente uso de dispositivos implantáveis (marcapassos, desfibriladores, ressincronizadores ou gravadores de loop) levou a um aumento do reconhecimento de episódios assintomáticos de arritmias atriais de curta duração, detectados apenas pelos dispositivos. Esses registros são chamados de episódios de alta frequência atrial (EAFA). Apesar de não serem termos totalmente idênticos, EAFA e FA subclínica são usados muitas vezes como sinônimos, já que um EAFA se assemelha a um pequeno período de FA.
A diretriz faz recomendação fraca para anticoagulação de EAFA com mais de 5 minutos e contraindica a anticoagulação para EAFA com menos de 5 minutos.
O texto não cita o estudo NOAH-AFNET 6, já discutido no tópico Anticoagulação nos Episódios de Alta Frequência Atrial [15]. Esse estudo avaliou o uso de edoxabana comparado ao placebo em pacientes com mais de 65 anos com EAFA de pelo menos 6 minutos e frequência atrial acima de 170 bpm. Os pacientes apresentavam pelo menos um fator de risco de evento tromboembólico. O trabalho foi parado precocemente por futilidade, pois o uso de edoxabana não reduziu o desfecho primário composto de morte cardiovascular, AVC ou embolização sistêmica.
Smartwatches como o Apple Watch utilizam a fotopletismografia para monitoramento do ritmo. Não são suficientemente confiáveis para o diagnóstico. A diretriz recomenda eletrocardiograma ou holter para confirmar as alterações sinalizadas pelo aparelho.
De forma comum, são usados para diagnosticar e monitorar a resposta à terapia, mas falta validação da acurácia dessas tecnologias. O uso desses aparelhos para rastreio também precisa ser melhor definido.
Não se sabe se as evidências provenientes de estudos com dispositivos implantáveis podem ser extrapoladas para o monitoramento com smartwatches.
Aproveite e leia:
Atualização sobre a Nova Diretriz de Fibrilação Atrial da ESC 2024
O Congresso Europeu de Cardiologia, realizado em setembro de 2024, apresentou uma nova diretriz de fibrilação atrial, atualizando as recomendações previamente publicadas em 2020. Este tópico comenta as principais novidades do documento.
Varfarina: Bulário e Quando Preferir em Relação aos DOACs
A varfarina é um anticoagulante antagonista da vitamina K. Ela atua inibindo os fatores de coagulação dependentes desse nutriente: proteína C, proteína S e fatores de coagulação II, VII, IX e X. Os anticoagulantes orais diretos (DOAC) são a primeira escolha em muitas situações, mas a varfarina ainda tem espaço na prática. Uma recente revisão do Journal of the American College of Cardiology avaliou essa questão e um ensaio clínico de janeiro de 2024 publicado no Circulation estudou a varfarina em indivíduos frágeis. Este tópico revisa o uso atual de varfarina.
Amiodarona
A amiodarona tem vários efeitos antiarrítmicos e é amplamente utilizada em taquiarritmias supraventriculares e ventriculares dentro e fora do hospital. Neste tópico revisamos seu mecanismo de ação, como prescrever e como evitar seus efeitos adversos durante a administração.
Avaliação de Risco Cardiovascular: Calculadora PREVENT
Existem várias formas de estimar o risco cardiovascular para determinar estratégias de prevenção. Em 2024, a American Heart Association (AHA) lançou a PREVENT, uma nova calculadora de risco de eventos cardiovasculares. Este tópico revisa o assunto e traz as novidades sobre a ferramenta.
Acetazolamida para Insuficiência Cardíaca Descompensada
Um destaque do congresso de 2022 da European Society of Cardiology (ESC), o estudo ADVOR avaliou o uso de acetazolamida na descompensação de insuficiência cardíaca (IC) e seus desfechos clínicos. Em um cenário comum, porém com menos estudos do que gostaríamos, o ADVOR chega para ser um dos maiores trabalhos de diureticoterapia na IC. Vamos aprofundar nesse estudo e na sua pergunta clínica.
