Fluidos, Fluido-Responsividade e Fluido-Tolerância
A administração de fluidos é uma intervenção que passou por mudanças significativas nas últimas décadas. Antes feita de maneira liberal e genérica, atualmente busca-se guiar essa terapia por parâmetros que possam minimizar o risco e aumentar o benefício. Essa revisão aborda o paradigma atual da fluidoterapia.
Por que fazer fluidos? O que é fluido-responsividade?
Os dois motivos principais para administrar fluidos são reposição de perdas volêmicas significativas (sangramentos e perdas gastrointestinais) e tratamento de choque circulatório.
Em pacientes com choque, administram-se fluidos para elevar o débito cardíaco. A intenção é que o aumento do débito possa melhorar a oferta e o consumo de oxigênio pelos tecidos, revertendo ou prevenindo disfunções orgânicas.
Fluido-responsividade é definida pela elevação do débito cardíaco em 10 a 15% após a expansão volêmica. O volume sistólico aumenta em resposta a uma elevação das pressões de enchimento cardíaco (aumento do volume diastólico final ou aumento da pré-carga). Porém, existe um limite para esse mecanismo, a partir do qual o aumento da pré-carga não eleva significativamente o volume sistólico (fase independente de pré-carga da curva de Frank-Starling - veja figura 1).
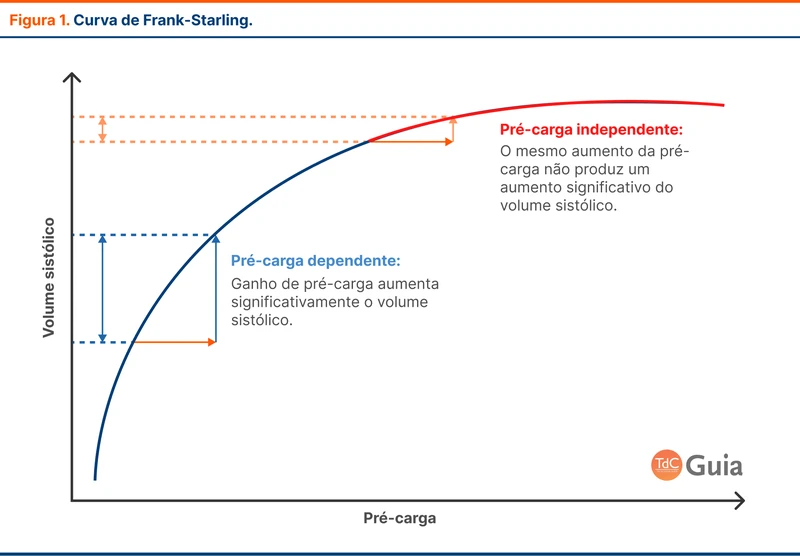
O fato de um paciente ser responsivo a fluidos não significa que ele precise de fluidos necessariamente. Pacientes fluido-responsivos que não apresentam sinais de oxigenação tecidual inadequada possivelmente não terão benefícios com a infusão de fluidos. Um aumento no débito cardíaco aumentará a oferta de oxigênio, mas não será acompanhada de um aumento do consumo (fase de independência de consumo e oferta - veja figura 2).
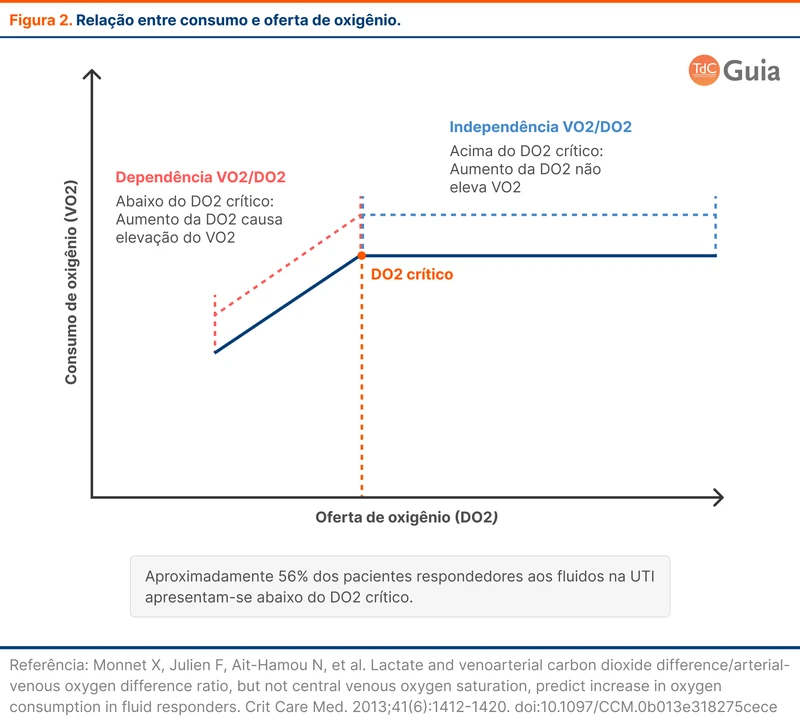
Apenas pacientes fluido-responsivos e com indícios de oxigenação tecidual inadequada devem receber fluidos. Os sinais de oxigenação tecidual inadequada são hipotensão com sinais de má-perfusão, enchimento capilar lentificado, livedo reticular, redução do nível de consciência e aumento do lactato.
Mesmo após a seleção cuidadosa de quem vai receber fluidos, o benefício pode ser transitório. Em pacientes com sinais de fluido-responsividade que apresentam incremento da oferta e consumo de oxigênio com melhora dos parâmetros de perfusão, a resposta ao fluido pode ser breve por perdas para o espaço extravascular, principalmente em pacientes com sepse [1].
Por que não fazer fluidos para quem não precisa?
Fluidos devem ser interpretados como medicamentos. Com indicação adequada podem trazer benefícios, porém também possuem riscos.
Várias evidências indicam piores desfechos em pacientes críticos que evoluem com balanço hídrico positivo e hipervolemia. Hipervolemia durante a internação está associada a aumento de tempo de ventilação mecânica, tempo de internação em UTI e aumento de mortalidade, principalmente em pacientes com sepse e síndrome do desconforto respiratório do adulto (SDRA) [2-4].
O acúmulo de fluidos está associado à edema periférico e visceral, com diversas consequências negativas [5]:
- Respiratórias: edema pulmonar, derrame pleural, dificuldade de desmame ventilatório e aumento do esforço respiratório.
- Gastrointestinais: íleo paralítico, má absorção, aumento da pressão intra-abdominal, aumento de complicações no pós-operatório de cirurgias abdominais (como infecções e fistulas) [6, 7]
- Cardíacas: disfunção diastólica, redução do débito cardíaco, derrame pericárdico.
- Renais: nefropatia congestiva, redução do fluxo renal, injúria renal aguda [8].
Como pesquisar fluido-responsividade?
A fluido-responsividade pode ser avaliada utilizando dois mecanismos:
- Interação cardiopulmonar
- Mobilização endógena de fluidos
Os métodos que usam a interação cardiopulmonar medem as variações no débito cardíaco com as respirações. Em pacientes fluido-responsivos, a oscilação da pressão intratorácica durante o ciclo respiratório causa uma variação significativa no débito cardíaco. Esses métodos só podem ser aplicados em pacientes sob ventilação mecânica (veja figura 3).
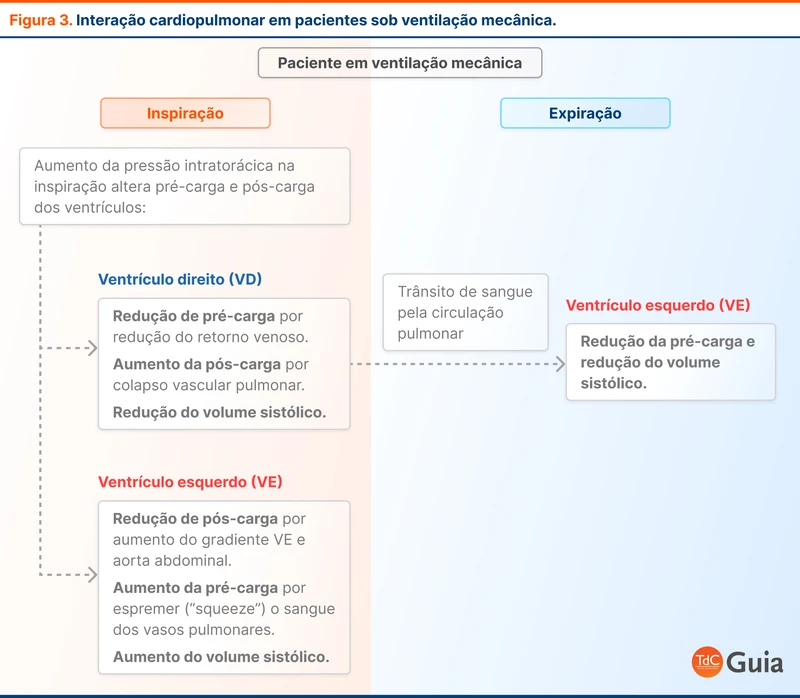
A mobilização endógena de fluidos baseia-se na manipulação da posição do paciente para recrutar o volume de sangue represado no sistema venoso. Essa estratégia não necessita de ventilação mecânica invasiva para ser utilizada.
Aplicar essas avaliações na fluidoterapia guiada por metas pode estar associado a redução de duração de ventilação mecânica, tempo de internação em UTI, necessidade de terapia substitutiva renal e até mortalidade [9, 10].
Fluido-responsividade: métodos baseados em interação cardiopulmonar
Os principais métodos aqui são: variação da pressão de pulso (VPP), variação do volume sistólico (VVS), tidal volume challenge (TVC) e variação da veia cava inferior.
Variação da pressão de pulso (VPP ou delta-PP)
A pressão de pulso é a diferença entre a pressão arterial sistólica e a pressão arterial diastólica. Ela tem relação com o débito cardíaco. A VPP é um dos marcadores mais acurados de fluido-responsividade e é calculada utilizando a pressão de pulso máxima (pressão no final da inspiração) e a pressão de pulso mínima (pressão durante a expiração), como na figura 4. Ela pode ser calculada utilizando monitores multiparamétricos comuns em pacientes com pressão arterial invasiva. Considera-se o paciente fluido-responsivo quando a VPP é maior do que 13% (com uma sensibilidade de 88% e especificidade de 89%) [11].
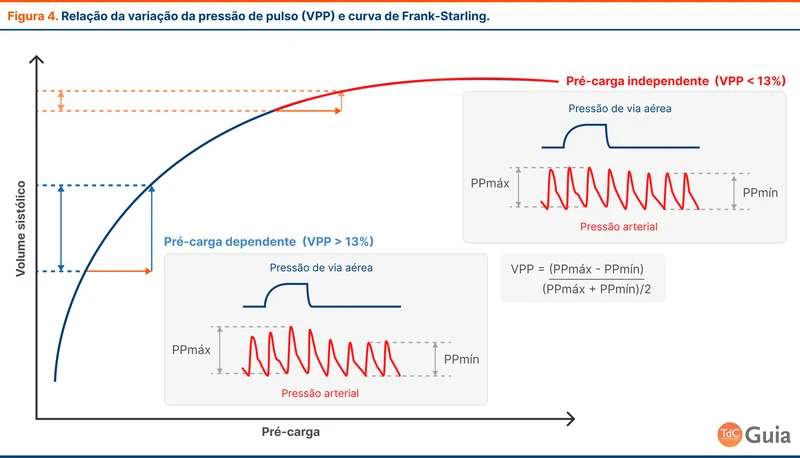
Resultados entre 9 a 13% caem em uma zona de incerteza, sendo adequado associar outros testes [12]. Uma possibilidade é o uso do passive leg raising (elevação de membros inferiores) para avaliar se há uma redução da VPP com a mobilização endógena de fluído, o que sugere fluido-responsividade.
Variação do volume sistólico (VVS)
Índice calculado a partir das mudanças do volume sistólico durante a inspiração e expiração. Esta medida depende do uso de monitores específicos (por exemplo Vigileo™ e VolumeView™) que calculam o volume sistólico continuamente durante o ciclo respiratório a partir da pressão arterial invasiva. Considera-se o paciente fluido-responsivo quando a VVS é maior do que 13%.
Para VPP e VVS serem confiáveis, o paciente deve preencher alguns pré-requisitos [13]:
- Ventilação mecânica com volume corrente de 8 mL/kg (há uma redução da acurácia com volumes menores ou maiores).
- Frequência respiratória < 35 incursões por minuto
- Sem arritmias
- Sem hipertensão intra-abdominal
- Sem disfunção de ventrículo direito
- Tórax fechado
- Adequação da curva arterial.
Estes pré-requisitos limitam a aplicabilidade da VPP e VVS, já que poucos pacientes preenchem todas estas condições [14].
Tidal Volume Challenge (TVC)
É comum utilizar ventilação mecânica com volume corrente menor que 8 mL/kg, principalmente em pacientes com doenças pulmonares. Estes volumes reduzidos diminuem a acurácia da VPP e VVS. O TVC é um método que tenta evitar esse problema.
O TVC consiste em aferir a VPP ou VVS com volume corrente de 6 mL/kg e aumentar o volume corrente para 8 mL/kg por um minuto e realizar uma nova aferição do VPP ou VVS. Esse aumento de volume corrente causa aumento de pressão intra-torácica, o que promoverá mudanças significativas no VPP e VVS se o paciente for fluido-responsivo. Um aumento ≥ 3,5% para VPP e ≥ 2,5% para VVS é considerado relevante e indica fluido-responsividade [15].
Variação da Veia Cava Inferior
A avaliação ultrassonográfica da veia cava inferior reflete o que está acontecendo com a pressão venosa central (PVC) do paciente. Isto não é uma análise da variação do volume sistólico com a respiração, mas será abordada nessa seção por ser muito utilizada.
O diâmetro e a variabilidade respiratória da veia cava inferior podem ser vistos pela ultrassonografia. Quanto maior o diâmetro e menor variação com as respirações, maior a PVC. Quanto menor o diâmetro e maior a variabilidade, menor a PVC.
Em pacientes sob ventilação mecânica, um índice de distensibilidade maior que 18% pode estar associado a fluido-responsividade (figura 5). Para uma avaliação adequada o paciente não pode ter esforço respiratório, pressão intra-abdominal elevada ou disfunção de ventrículo direito [16].
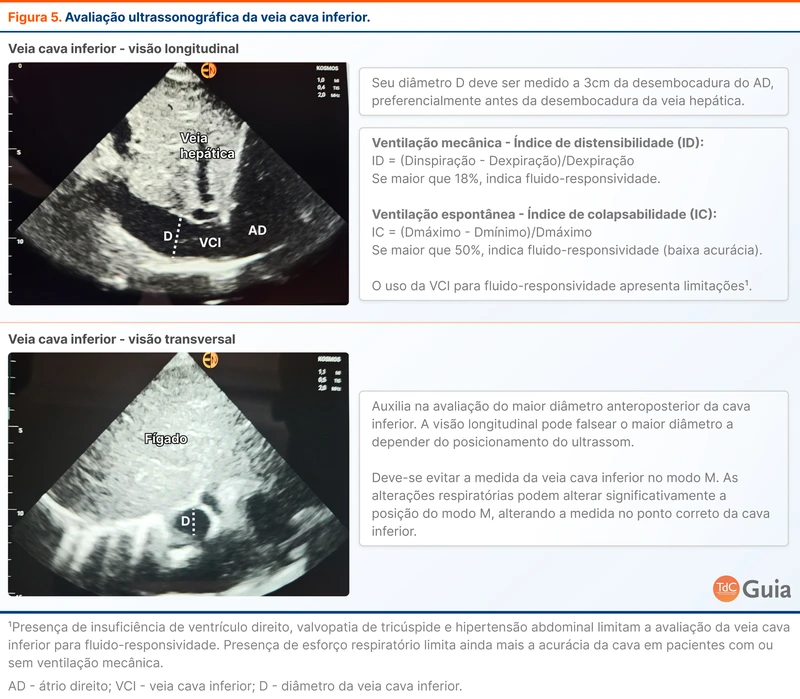
Em pacientes em ventilação espontânea, a acurácia de variações da veia cava inferior com a respiração é menor. Este não é um bom marcador de fluido-responsividade [17].
A PVC e a veia cava inferior não parecem ter uma boa acurácia em predizer fluido-responsividade de forma geral [18]. Em valores extremos e na ausência de marcadores mais acurados, esses parâmetros podem ser usados com cautela. Uma veia cava inferior com mais de 2 cm e pouca variabilidade reduz a chance do paciente ser fluido-responsivo. Por outro lado, uma veia cava inferior com diâmetro reduzido e variabilidade significativa ou até com colabamento pode auxiliar na decisão de administrar fluidos [19].
Atualmente, outras veias como veia jugular interna e veia femoral são estudadas para estimativas da PVC [20, 21].
Fluido-responsividade: métodos com mobilização endógena
O meio de mobilização endógena é a manobra de elevação passiva das pernas (ou passive leg raising, PLR). O paciente inicialmente fica em posição supina e então realiza-se uma elevação passiva das pernas a um ângulo de 45º por ao menos um minuto (veja figura 6). Esta manipulação causa um aumento transitório do retorno venoso e da pré-carga, simulando uma infusão de volume.
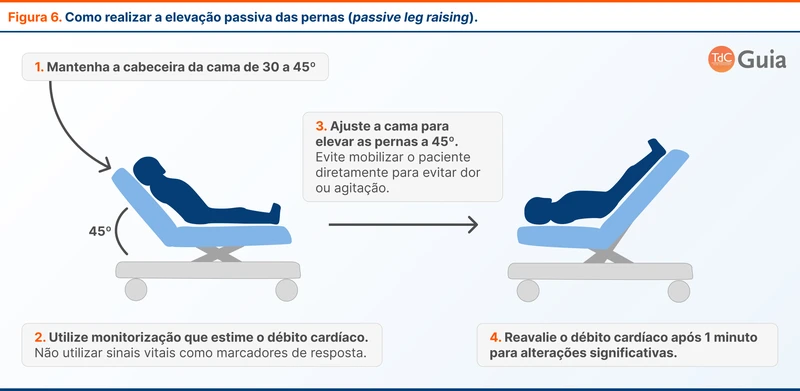
Um parâmetro deve ser aferido antes e após o PLR para avaliar se a variação dos valores sugere fluido-responsividade. Os parâmetros utilizados podem ser estimativas do débito cardíaco (ecocardiografia com VTI ou monitores como Vigileo™ e VolumeView™) ou a VPP. Em casos de avaliação do débito cardíaco, uma variação de 10 a 15% antes e depois do PLR indica fluido-responsividade[22]. Já na VPP, uma redução de 3% ou mais antes e após o PLR também está associada a fluido-responsividade.
Sinais vitais como frequência cardíaca e pressão arterial não devem ser utilizados como parâmetros de resposta. Mobilizar o paciente pode alterar estes parâmetros mesmo que ele não seja fluido-responsivo.
O PLR pode ser feito mesmo em pacientes sob ventilação mecânica com volume corrente menor [23]. Também pode ser realizada em pacientes em ventilação espontânea.
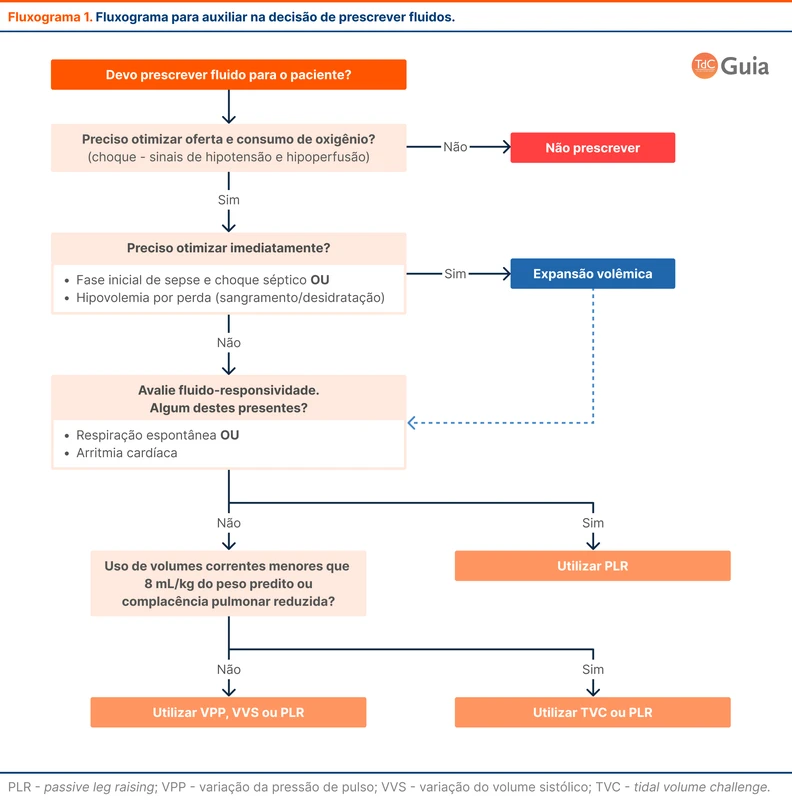
O fluxograma 1 resume os métodos de avaliação de fluido-responsividade e como utilizá-los na decisão de prescrever fluidos.
O que é fluido-tolerância e por que avaliar junto com fluido-responsividade?
Fluido-tolerância indica a capacidade de um paciente tolerar a infusão de fluidos sem desenvolver complicações [24]. Ela é avaliada por marcadores de congestão esquerda ou direita. Pacientes com intolerância a fluidos são aqueles que apresentam alterações nestes marcadores. Deve-se evitar fluidos nestes pacientes.
A perfusão tecidual é muitas vezes considerada pela perspectiva do débito cardíaco e pressão arterial. Porém, ela depende da diferença entre pressão arterial média e pressão venosa central (PVC). A congestão venosa afeta a perfusão negativamente, podendo comprometer qualquer órgão como discutido no tópico “Por que não fazer fluidos para quem não precisa?”.
Fluido-tolerância e congestão podem ser estimadas estudando as câmaras cardíacas esquerdas e direitas.
Em relação ao lado esquerdo, o pulmão é o principal órgão estudado. O ultrassom pulmonar à beira leito é a ferramenta de escolha para avaliação de congestão pulmonar com alta acurácia (veja mais no topico POCUS no Derrame Pleural).
Com relação a congestão pelo lado direito, a PVC é o principal marcador de congestão venosa. Contudo, não é possível mensurá-la diretamente na maioria dos pacientes. Utiliza-se o exame físico (turgência jugular, refluxo hepato-jugular, edema de extremidades) e a ultrassonografia (veia cava inferior, veia jugular interna ou VExUS) para predizer aumentos significativos na PVC (acima de 12-15 mmHg) e riscos de disfunção orgânica ocasionados por esse aumento.
Pacientes fora da fase de ressuscitação (ver "fases de fluidoterapia" abaixo) devem ter sempre uma avaliação de fluido-responsividade e fluido-tolerância em conjunto. Considerar se uma expansão volêmica trará danos ao paciente é tão importante quanto saber se existe fluido-responsividade.
O que é o VExUS e como utilizar?
O VExUS (venous excess ultrassound) é um protocolo de ultrassom à beira leito que quantifica a congestão venosa medindo o diâmetro da veia cava inferior e o fluxo ao Doppler das veias hepáticas, veia porta e veias intrarrenais.
O VExUS deve ser empregado como um adjuvante na análise de congestão e fluido-tolerância do paciente crítico. Pode ser utilizado tanto para o diagnóstico de congestão venosa quanto para o acompanhamento da “des-ressuscitação” do paciente com balanço hídrico acumulado positivo (ver "fases da fluidoterapia" abaixo).
Os transdutores curvilíneo ou cardíaco devem ser utilizados. O primeiro passo é a medida da veia cava inferior. Se menor que 2 cm, o VExUS é graduado como 0 (sem congestão). Se maior ou igual a 2 cm, prossegue-se para a avaliação com doppler das outras veias.
A curva de doppler das veias apresenta um padrão específico de normalidade e vão se alterando de forma previsível com o aumento da congestão (ou aumento da PVC). Cada uma das veias será classificada conforme sua curva como normal, levemente anormal ou gravemente anormal (veja a figura 7 e este vídeo para uma explicação de como realizar a avaliação).
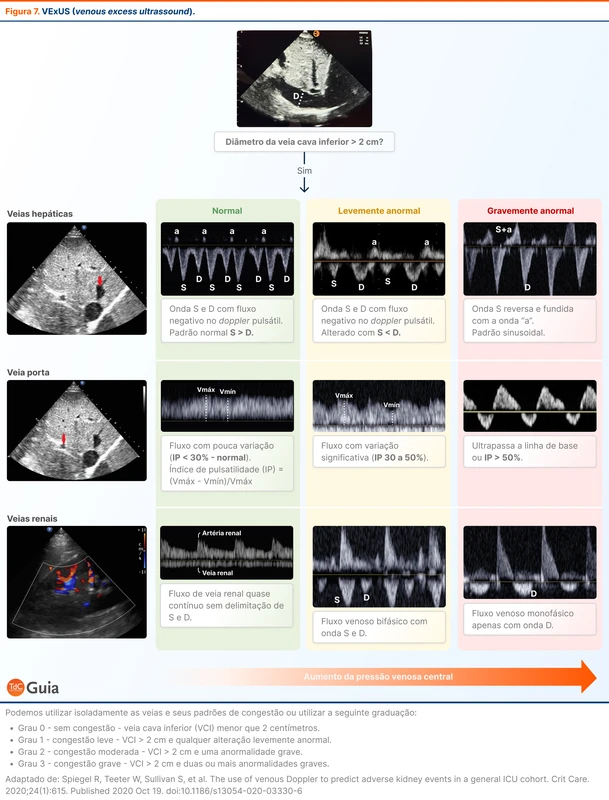
O estudo original que avaliou o VExUS foi realizado em pacientes em pós-operatório de cirurgia cardíaca e escores mais altos associaram-se com maior incidência de injúria renal aguda [25]. Estudos posteriores observaram piores desfechos renais na população de pacientes críticos em geral [26, 27].
As situações a seguir limitam o uso do VExUS por alterarem o Doppler por motivos diferentes de hipervolemia:
- Hipertensão abdominal
- Cirrose e trombose portal
- Doença renal crônica
- Insuficiência tricúspide e disfunção de ventrículo direito
- Pericardite constritiva
Fases da fluidoterapia
A fluidoterapia pode ser dividida em quatro fases com sobreposições entre si: ressuscitação, otimização, estabilização e retirada (veja figura 8) [5, 28].
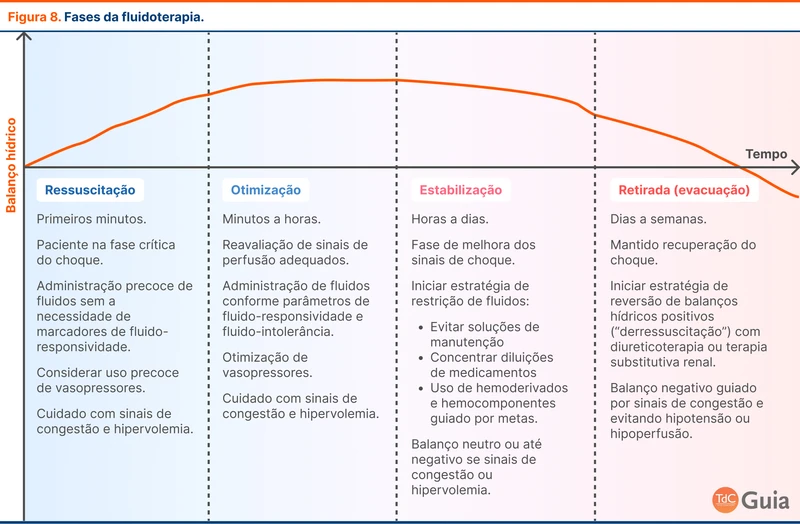
Ressuscitação
É a fase inicial - as primeiras 3 a 6 horas da fluidoterapia. É a fase em que a maioria dos pacientes com choque distributivo serão responsivos a volume, exceto pacientes com sinais claros de hipervolemia e congestão. A tendência é de realizar expansão volêmica nessa fase mesmo sem parâmetros de fluido-responsividade.
Apesar da recomendação de 30 mL/kg de fluidos no paciente com sepse, a terapia deve ser individualizada e baseada em metas. Inicialmente, uma alíquota de 500 a 1000 mL deve ser acompanhada de reavaliação de pressão arterial, perfusão e lactato. Pacientes refratários inicialmente podem necessitar de mais fluidos conforme fluido-responsividade ou até mesmo de início precoce de drogas vasoativas. Veja mais no tópico Vasopressores e Corticoide no Choque Séptico.
Otimização
É a segunda fase e pode durar horas. Em geral, os pacientes já estão internados em unidade de terapia intensiva na fase de otimização.
Apenas 50% dos pacientes admitidos em UTI são fluido-responsivos e o exame físico não apresenta boa acurácia para essa avaliação [19]. Após 8 horas de UTI, apenas 3% dos pacientes mantêm sinais de fluido-responsividade [29]. Parâmetros objetivos para guiar a continuidade da fluidoterapia são bem aplicados neste momento.
Esta é a fase em que a decisão de administrar mais fluidos deve ser guiada por marcadores de fluido-responsividade e fluido-tolerância. Pacientes com indícios de fluido-responsividade sem sinais claros de hipervolemia e congestão podem ter benefício com novas infusões de fluidos se mantiverem sinais de hipotensão e hipoperfusão.
Estabilização
Fase que se estende por dias após o insulto inicial. Pacientes nesta fase já apresentam estabilização dos sinais de choque e estão em melhora.
É comum a persistência de balanços positivos nesta fase. O volume de infusão associado a medicamentos (principalmente sedativos, analgésicos, drogas vasoativas e antibióticos) e a dieta contribuem para o acúmulo de líquido.
Fluidos de manutenção devem ser evitados, principalmente em pacientes com dieta já em progressão. Medicamentos e reposição de eletrólitos devem ter suas diluições concentradas na medida do possível.
A meta de balanço hídrico diário é de zero ou levemente positiva considerando as perdas insensíveis (500 a 1.000 mL com variações a depender da condição clínica).
Retirada (ou evacuação)
Fase que se estende por dias a semanas. Nesta etapa, os pacientes podem apresentar um aumento espontâneo da diurese com perda gradual do excesso de volume ou necessitar de auxílio de diuréticos ou terapia substitutiva renal.
Essa fase consiste em uma "des-ressuscitação" volêmica, com metas de balanço hídrico negativo e melhora dos sinais de congestão. Apesar de ser difícil encontrar o momento ideal, os pacientes que podem se beneficiar de remoção de fluidos apresentam uma combinação destes fatores:
- Estabilidade clínica
- Balanços hídricos positivos ao longo da internação
- Ausência de sinais de fluido-responsividade
- Presença de sinais de intolerância a fluidos (congestão esquerda e/ou direita).
Qual fluido escolher?
Existem dois grupos de fluidos para expansão volêmica:
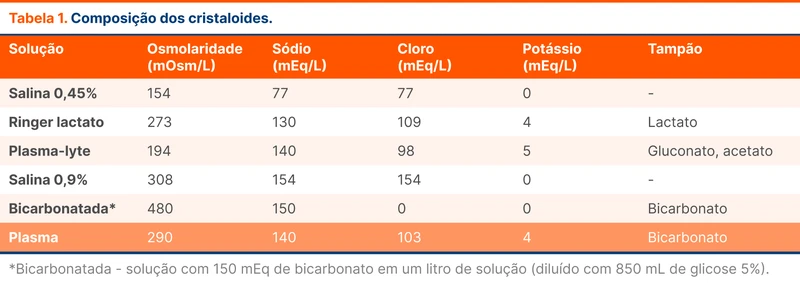
- Cristalóides (veja tabela 1)
- Soluções hiperclorêmicas - salina 0,9%, salina 0,45%
- Soluções balanceadas - Ringer lactato e plasma-lyte
- Colóides
- Sintéticos - gelatinas, amidos (hydroxyethyl starch, hidroxietilamido - Voluven®) ou dextranas
- Naturais - albumina
Os colóides sintéticos caíram em desuso na terapia intensiva. Estudos mostraram aumento de risco de morte e necessidade de terapia substitutiva renal com uso do hidroxietilamido quando comparados aos cristaloides [30, 31].
O uso de colóides naturais como a albumina parece resultar em desfechos semelhantes ao uso de cristaloides, não sendo utilizados rotineiramente pelo seu alto custo [32]. Seu uso inicialmente é benéfico para pacientes com cirrose e peritonite bacteriana espontânea ou injúria renal aguda. Pode-se considerar a albumina em pacientes com sepse refratários aos cristalóides, mas que ainda apresentam marcadores de fluido-responsividade [33].
Entre os cristalóides, existe um debate se existe superioridade entre as soluções hiperclorêmicas e as balanceadas. Não há favorecimento forte entre elas na literatura. Algumas informações que ajudam na escolha são:
- Pacientes com acidose metabólica hiperclorêmica podem se beneficiar do uso de ringer lactato - soluções com alto teor de cloro como a salina 0,9% tendem a piorar a acidose metabólica
- Soluções balanceadas podem estar associadas a melhores desfechos renais (injúria renal aguda, necessidade e tempo livre de terapia substitutiva renal) [34, 35]
- Salina 0,9% está associada melhores desfechos em pacientes com trauma cranioencefálico ou hipertensão intracraniana, possivelmente pela maior osmolaridade quando comparada às soluções balanceadas [36, 37]
- Pode-se considerar o uso de solução bicarbonatada para expansão volêmica em pacientes críticos com acidose metabólica grave com pH < 7,2 e injúria renal aguda com possível benefício de redução de necessidade de terapia substitutiva renal [38].
Aproveite e leia:
Novo Consenso de Síndrome Hepatorrenal
Um novo consenso sobre injúria renal aguda no paciente com cirrose do Acute Disease Quality Initiative (ADQI) e International Club of Ascites (ICA) foi publicado em 2024. O documento traz mudanças nos critérios diagnósticos e manejo da síndrome hepatorrenal com injúria renal aguda. Este tópico revisa as principais mudanças.
POCUS no Derrame Pleural
A ultrassonografia à beira do leito (POCUS) cada vez mais faz parte da avaliação na emergência. Todo dia a técnica é aprimorada e incorporada nos atendimentos. Um artigo do British Medical Journal (BMJ) publicado em janeiro de 2023 trouxe alguns pontos da abordagem do derrame pleural com POCUS. Aproveitamos para revisar esse tópico aqui no Guia.
Volume no Choque Séptico
Quanto e qual fluido fazer é uma pergunta que o clínico faz todos os dias. O estudo CLASSIC avaliou uma estratégia de fluidos restritiva versus a estratégia padrão no choque séptico. Aqui revisamos o tema e resumimos essa nova evidência.
Manejo de Pancreatite Aguda Grave
Pacientes com pancreatite aguda evoluem com sinais de gravidade em 15 a 25% dos casos. A mortalidade da pancreatite grave é de até 50%. Em junho de 2023, foi lançado um artigo na Intensive Care Medicine com dez dicas práticas sobre o manejo da pancreatite grave. Este tópico revisa os principais pontos da publicação.
Consenso de Emergências Hiperglicêmicas
Um novo consenso internacional de emergências hiperglicêmicas foi publicado em agosto do 2024 pela American Diabetes Association (ADA), European Association for the Study of Diabetes (EASD), American Association of Clinical Endocrinology (AACE) e outras sociedades. Publicado originalmente em 2001 e atualizado pela última vez em 2009, o documento agora incorpora os avanços mais recentes para o manejo dessas condições. Este tópico revisa aspectos práticos no diagnóstico e manejo da cetoacidose diabética e estado hiperglicêmico hiperosmolar.
