Caso Clínico #18
O caso clínico abaixo é apresentado em partes. O negrito é a descrição do caso, as partes que não estão em negrito são os comentários. Ao final, você encontrará a resolução e os pontos de aprendizagem resumidos.
Uma mulher de 27 anos, previamente hígida, procura o pronto-atendimento por aumento do volume abdominal e dor intermitente no abdome superior nos últimos dois meses. Informa também edema de membros inferiores e intolerância aos médios esforços, não conseguindo realizar tarefas habituais.
Os sinais vitais mostram pressão arterial de 110/75 mmHg, frequência cardíaca de 75 batimentos por minuto, frequência respiratória de 16 incursões por minuto e saturação de 96% em ar ambiente. Regular estado geral, com mucosas hipocoradas, sem icterícia. Exame cardiopulmonar sem alterações. O abdome era globoso, com manobras de ascite positivas (piparote), porém sem organomegalias palpáveis. Não apresentava dor à palpação abdominal ou sinais de peritonismo.
A paciente está estável, mas tem vários achados que preocupam. O aumento de volume abdominal com sinais de ascite ao exame físico tornam esta hipótese provável e, caso seja confirmada, deve ser puncionada o mais breve possível [1]. Caso essa paciente procurasse atendimento em contexto ambulatorial, o ideal é que fosse encaminhada ao pronto socorro, já que a investigação inicial demanda rapidez.
Pode-se agrupar as causas de aumento do volume abdominal baseado no conteúdo que está preenchendo o abdome. Alguns exemplos:
- Sólido: feto, organomegalias, fezes e massas neoplásicas
- Líquidas: ascite, cistos gigantes ou retenção urinária aguda
- Gás: distensão de alças ou pneumoperitônio
Os sintomas e o exame físico ajudam a diferenciar essas causas. Quase sempre será necessário exames complementares como radiografia, ultrassonografia ou tomografia.
Em relação às manobras do exame físico para ascite, o sinal do piparote é o que possui a melhor acurácia [2]. A sociedade americana de estudo de doenças hepáticas orienta que todo paciente com ascite seja avaliado com anamnese, exame físico, ultrassonografia, exames complementares de função e lesão hepática e paracentese diagnóstica [3].
O sintoma de dor abdominal pode ser atrelado à causa da ascite ou de complicações como peritonite bacteriana espontânea. A intolerância ao exercício pode estar relacionada à causa do edema ou à causa da mucosa hipocorada.
Os exames laboratoriais no pronto socorro revelam hemoglobina de 10,4 g/dL com VCM de 106, leucócitos de 7580/mm3, sem alteração na contagem diferencial e plaquetas de 54 mil/mm3. O coagulograma apresentava INR de 1,45 (VR: 0,8 a 1,20) e relação TTPA de 1,3 (VR: 0,8 a 1,20). Demais exames com gama GT 311 U/L (VR: até 40), fosfatase alcalina 150 U/L (VR: até 130) e albumina de 4,2 g/dL (VR: 3,5 a 4,5). Função renal, eletrólitos, bilirrubinas, AST e ALT estavam normais.
Na ultrassonografia foi visualizado fígado com forma normal, contornos regulares, dimensões aumentadas às custas de hipertrofia do lobo caudado, com discreta ecotextura difusamente heterogênea. Veia porta pérvia, de calibre preservado e fluxo hepatopetal. Sem sinais de dilatação de vias biliares intra e extra-hepáticas. Vesícula biliar normodistendida, com paredes difusamente espessadas, de aspecto reacional. Baço apresentando volume e ecotextura normais. Moderada quantidade de líquido livre abdominal.
A principal causa de ascite é cirrose [4]. A paciente não possui sinais indicativos de comprometimento hepático como alteração estrutural do fígado, albumina reduzida, bilirrubina elevada e fluxo hepatofugal na veia porta. Anemia e plaquetopenia são achados comuns em pacientes com cirrose, podendo ocorrer por sangramentos gastrointestinais ou hiperesplenismo, devido à hipertensão portal [5]. A ausência de outros achados de cirrose nessa paciente sugerem que a etiologia da bicitopenia não deve ser hepática.
A investigação etiológica neste caso pode seguir por dois caminhos: pela ascite e pela bicitopenia. Essas investigações devem ser realizadas simultaneamente.
Toda ascite precisa ser avaliada com paracentese para elucidação diagnóstica e para avaliação de uma possível peritonite bacteriana espontânea (PBE). No líquido ascítico é necessário avaliar contagem de células, cultura, albumina e proteínas totais. Exames como adenosina deaminase (ADA) e pesquisa de células neoplásicas podem ser solicitados a depender da suspeita.
A paracentese pode ser realizada mesmo em pacientes com plaquetopenia. A taxa de sangramento em pacientes cirróticos com plaquetas acima de 19.000/mm3 foi de 0,02% em um trabalho retrospectivo [6]. Dentre os pacientes que sangraram, foi mais comum a presença de lesão renal aguda e maiores valores de MELD. O uso da ultrassonografia no momento da paracentese reduz as taxas de complicações [7]. Mesmo em pacientes não cirróticos, procedimentos como paracentese podem ser realizados com plaquetas acima de 50.000l/μL [8].
A investigação da anemia associada à plaquetopenia é feita de maneira similar a uma pancitopenia. Pela história não foram identificados fatores causais clássicos de bicitopenia, como quimioterápicos ou outros medicamentos. Quanto à anemia, reticulócitos e exames de hemólise, como bilirrubina indireta e desidrogenase láctica, auxiliam a identificar se a causa é por um problema na medula óssea ou por destruição celular no sangue periférico. Essa distinção ajudará a definir se a medula precisa ser investigada. Deficiência de vitamina B12 e ácido fólico podem causar anemia com VCM elevado e plaquetopenia, por isso devem ser dosados nesta paciente.
A análise morfológica de sangue periférico (também chamado de hematoscopia ou esfregaço de sangue periférico) é fundamental para pacientes com bicitopenia. Essa análise pode detectar células anormais, como blastos nas leucemias ou esquizócitos nas microangiopatias trombóticas (MAT), como púrpura trombocitopênica trombótica e síndrome hemolítica-urêmica. Essas duas situações são consideradas urgências hematológicas e necessitam de avaliação com rapidez, por isso a hematoscopia deve ser realizada em todos os casos.
Como a paciente também possui valores alterados de coagulograma, a associação com plaquetopenia causa receio quanto à possibilidade de uma coagulação intravascular disseminada (CIVD). Para avaliar o risco de CIVD deve-se utilizar um escore específico (DIC score), que também leva em conta fibrinogênio e d-dímero.
Essa paciente necessita de internação hospitalar para elucidar a causa da ascite e da bicitopenia. A avaliação de causas graves como leucemia, microangiopatias trombóticas e peritonite bacteriana espontânea deve ser feita o quanto antes.
A paciente foi internada. Os exames adicionais apresentaram reticulócitos de 105.000/µL (VR: 16.000 a 70.000/µL), desidrogenase láctica de 498 U/L (VR: 250), ferritina 772 ng/mL (VR: 30 a 400) e índice de saturação de transferrina de 40% (VR: 20 a 50%). A vitamina B12 estava em valores normais. O D-dímero estava elevado em 3,46 µg/mL (VR: Abaixo de 0,5), porém o fibrinogênio estava normal em 306 mg/dL (VR: 200 a 400). O DIC score teve resultado de 4 pontos, não compatível com CIVD. A hematoscopia de sangue periférico não visualizou células anormais ou presença significativa de esquizócitos. Sorologias para HIV, hepatite B, hepatite C e sífilis foram todas negativas. Também foi solicitado beta-HCG que veio negativo.
A paracentese diagnóstica foi realizada e apresentou albumina no líquido ascítico de 2,6 g/dL, com proteínas totais de 3,7 g/dL. Os leucócitos totais do líquido ascítico estavam em 120 células. Foi realizada a adenosina deaminase (ADA) que veio de 8 U/L (VR: abaixo de 40).
A hematoscopia de sangue periférico reduziu a chance de leucemia e MAT, assim como o número de leucócitos no líquido ascítico afasta o diagnóstico de PBE. O DIC score para avaliação de CIVD é amplamente aceito (veja tabela 1), mas deve ser utilizado em conjunto com julgamento clínico, considerando condições predisponentes e explicações alternativas para o quadro.

A abordagem diagnóstica do líquido ascítico é realizada através do cálculo do gradiente de albumina soro-ascite (GASA). Valores maiores ou iguais a 1,1 apontam para a presença de hipertensão portal, sugerindo causas como cirrose, doenças cardíacas (insuficiência cardíaca, pericardite constritiva e hipertensão pulmonar) e trombose de veias hepáticas (síndrome de Budd-Chiari). Valores abaixo de 1,1 indicam ausência de hipertensão portal, direcionando para doenças como tuberculose peritoneal, neoplasias abdominais e síndrome nefrótica. (fluxograma 1 e tabela 2).
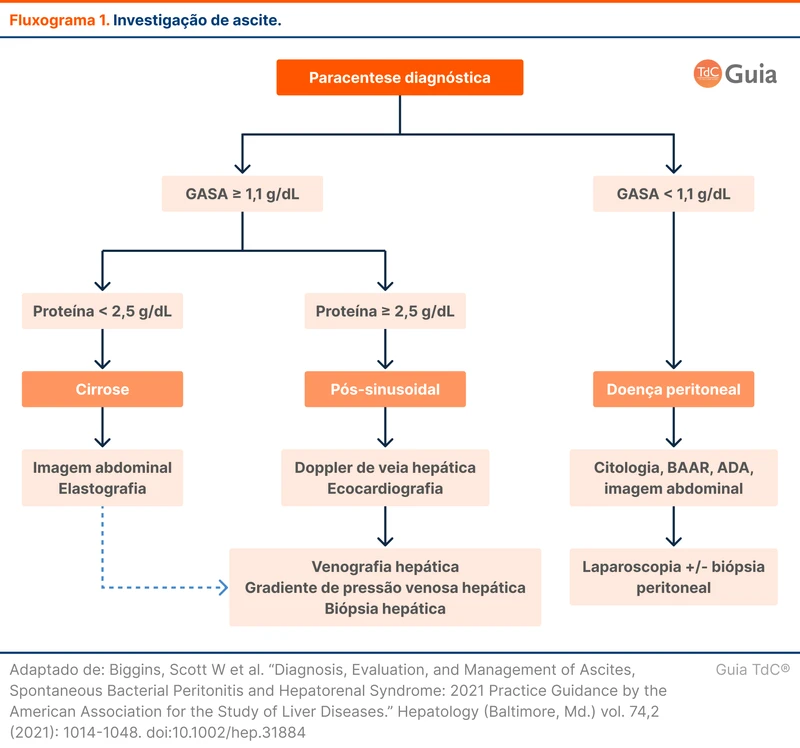
Diferente do derrame pleural, a investigação de ascite não é pautada pela diferenciação de exsudato e transudato com a dosagem de proteína e desidrogenase láctica. A acurácia da classificação de exsudato e transudato é baixa na ascite, já que ascites infecciosas podem ter proteína baixa e ascites cardíacas podem ter proteína alta [4].
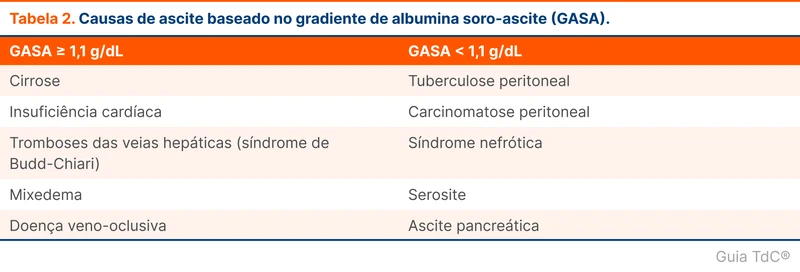
A paciente apresenta GASA de 1,6. Na cirrose espera-se uma proteína no líquido ascítico menor que 2,5 g/dL. A associação de GASA elevado e proteínas no líquido ascítico acima de 2,5 g/dL favorece as causas não cirróticas de hipertensão portal. Isso condiz com o caso, que já apresentava outros exames não compatíveis com cirrose. Nesse momento, é necessário a avaliação de função cardíaca e estudo contrastado dos vasos hepáticos.
Em relação à bicitopenia, os achados sugerem a presença de destruição periférica. O próximo passo é diferenciar em causas imunes e não imunes. O teste de Coombs pode ajudar, estando positivo nas causas imunes. O representante desse grupo é a síndrome de Evans, caracterizada pela associação de anemia hemolítica autoimune e púrpura trombocitopênica imune.
Quando o teste de Coombs está negativo, deve-se considerar as causas não imunes, sendo as principais:
- Microangiopatias trombóticas, como púrpura trombocitopênica trombótica e síndrome hemolítica urêmica
- CIVD
- Hiperesplenismo
- Hemoglobinúria paroxística noturna
A ausência de esquizócitos em número aumentado na análise de sangue periférico diminui a chance de uma MAT [9]. Hiperesplenismo é pouco provável já que não existem alterações esplênicas nos exames de imagem.
Nesse momento, devemos prosseguir com a investigação de causas não cirróticas para hipertensão portal, bem como dosagem do Coombs direto para distinguir entre causas imunes e não imunes de destruição periférica.
O ecocardiograma não mostrou alterações. A tomografia de abdome com contraste evidenciou fígado com dimensões aumentadas, notando-se hipertrofia do lobo caudado, bordas rombas e atenuação difusamente heterogênea com aspecto em “noz-moscada”. Foi visualizada trombose de veias hepáticas. Veia porta e ramos portais pérvios. Ausência de dilatação das vias biliares. Vesícula biliar de paredes espessas de aspecto reacional. Baço com aspecto normal. Rins sem alterações. Volumosa ascite.
O teste de Coombs direto estava negativo.
A obstrução da veia hepática ocasiona a síndrome de Budd-Chiari, definida como obstrução da via de saída venosa do fígado, independente do nível ou mecanismo de obstrução, desde que a obstrução não seja por doença cardíaca, pericárdica ou síndrome de obstrução sinusoidal (doença veno-oclusiva).
O quadro mais representativo de SBC é composto por hepatomegalia, ascite e dor no quadrante superior direito. Apesar dessa tríade clássica, os sintomas são variáveis tanto em intensidade como em progressão. Os pacientes podem estar assintomáticos ou ter sintomas que remetem à cirrose, como sangramento gastrointestinal, ascite e edema de membros inferiores. Apesar de raro, é possível que o paciente com SBC evolua para insuficiência hepática aguda [10].
A hipertrofia do lobo caudado pode estar presente, mas não é específica para SBC. As alterações laboratoriais são diversas e não específicas. Pacientes podem ter alteração da função hepática, incluindo coagulograma, e das transaminases.
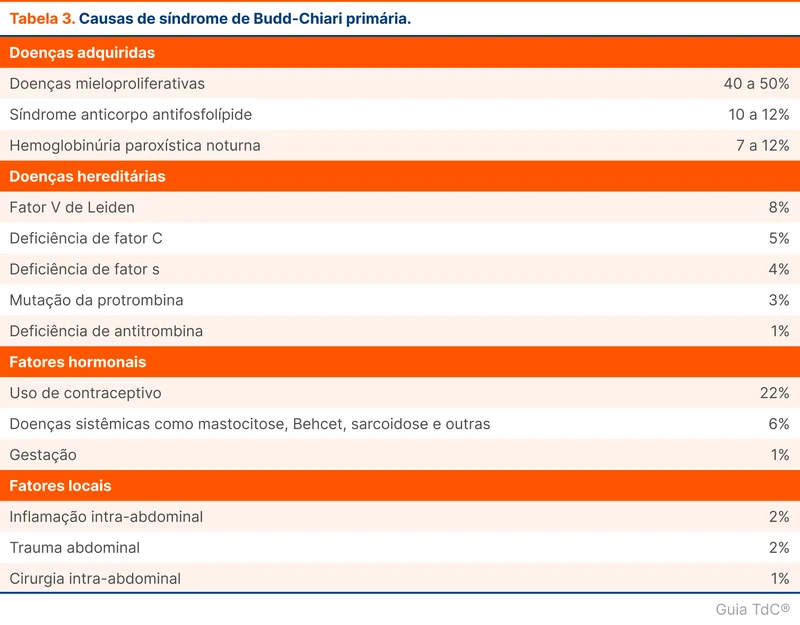
A SBC é considerada primária quando a obstrução é por trombose de vasos e secundária quando ocorre por invasão ou compressão extrínseca, como em malignidades. A SBC causada por trombose, apesar de ser chamada de primária, pode ter um fator causal encontrado em 75% dos [11]. As causas possíveis podem ser vistas na tabela 3. As mais comuns são (veja mais sobre investigação de trombofilias neste tópico):
- Doenças mieloproliferativas, como leucemia mielóide crônica, policitemia vera e trombocitose essencial
- Trombofilias, como síndrome do anticorpo antifosfolípide (SAAF)
- Hemoglobinúria paroxística noturna.
A SAAF seria uma possível explicação para a trombose da paciente e pode provocar anemia hemolítica imune e [12]. A forma mais grave de SAAF é chamada de síndrome antifosfolípide catastrófica e pode se comportar como uma MAT e causar plaquetopenia. Tanto a anemia hemolítica como a plaquetopenia são mais comuns no paciente com SAAF e lúpus eritematoso sistêmico associado. Os anticorpos para SAAF (anticardiolipina, beta-2 glicoproteína 1 e o anticoagulante lúpico) devem ser solicitados.
Hemoglobinúria paroxística noturna explica a trombose em sítio atípico, a anemia hemolítica com Coombs negativo e a plaquetopenia. O seu diagnóstico é confirmado através da citometria de fluxo.
A citometria de fluxo confirmou o diagnóstico de hemoglobinúria paroxística noturna. O diagnóstico de SAAF foi afastado após resultado negativo para os anticorpos. A paciente iniciou anticoagulação para a trombose da veia hepática e recebeu alta após 8 dias de internação.
No seguimento ambulatorial, a paciente teve sangramentos gastrointestinais com necessidade de interrupção transitória da anticoagulação. Um ano após o diagnóstico, a paciente conseguiu iniciar o tratamento com eculizumabe.
A hemoglobinúria paroxística noturna é uma doença adquirida ocasionada por uma mutação no gene da fosfatidilinosítol glicana classe-A (PIG-A). Isso leva à redução ou ausência de proteínas ligadas ao glicosilfosfatidilinositol (GPI) que funcionam como inibidores do complemento. Como resultado, a membrana das hemácias fica suscetível à destruição pelo complemento, ocorrendo hemólise intravascular com Coombs negativo e eventos trombóticos. Apesar do nome, a maioria dos pacientes não relatam hemoglobinúria noturna (HPN) [13].
Os eventos trombóticos ocorrem com mais frequência nas veias hepáticas, mas também pode ocorrer trombose das veias mesentéricas ou trombose venosa cerebral [14]. A HPN atinge ambos os sexos e geralmente ocorre entre a terceira e quarta década de vida [15].
A hemoglobina livre que surge devido à hemólise intravascular tem alta afinidade pelo óxido nítrico. Assim, além de citopenias e tromboses, os pacientes podem apresentar sintomas decorrentes da depleção tecidual de óxido nítrico, como espasmos esofágicos, priapismo e hipertensão pulmonar.
A HPN possui correlação com doenças que causam falência medular como anemia aplásica e síndrome mielodisplásica. Aproximadamente 10 a 30% dos pacientes com anemia aplásica desenvolvem HPN durante o curso da doença [16]. Também é comum pacientes com HPN desenvolverem anemia aplásica ao longo do tempo.
O diagnóstico é confirmado através da pesquisa de células HPN na citometria de fluxo de sangue periférico [13].
O tratamento principal é realizado com eculizumabe (Soliris®), um anticorpo monoclonal anti-C5. Esse tratamento está relacionado com melhora de sobrevida e qualidade de vida e redução de hemólise e eventos trombóticos. O principal risco relacionado a esse tratamento é a maior taxa de infecção por Neisseria, principalmente a N. meningitidis.
Alguns pontos de aprendizagem sobre o caso que você não pode esquecer:
- Todo paciente com ascite deve ser avaliado com ultrassonografia e exames complementares de função e lesão hepática, além de paracentese diagnóstica.
- A abordagem ao líquido ascítico envolve o cálculo do gradiente de albumina soro-ascite. Valores maiores ou iguais a 1,1 apontam para hipertensão portal, sugerindo causas como cirrose, doenças cardíacas e trombose de veias hepáticas.
- Frente à hipótese de destruição periférica de hemácias, devemos utilizar o teste de Coombs para diferenciar causas imunes e não imunes, estando positivo nas causas imunes.
- Em pacientes com anemia e plaquetopenia, a análise morfológica do sangue periférico deve ser feita assim que possível em busca de blastos - presentes em leucemias - e esquizócitos - presentes em microangiopatias trombóticas. Essas condições devem ser tratadas rapidamente.
- A síndrome de Budd-Chiari é definida como obstrução da via de saída venosa do fígado. Os pacientes apresentam-se com sintomas de febre, dor abdominal e hepatomegalia, mas também podem estar assintomáticos.
- A hemoglobinúria paroxística noturna se manifesta com hemólise intravascular, Coombs negativo e eventos trombóticos. Essa doença exige uma alta suspeição clínica e o diagnóstico envolve a pesquisa de células HPN na citometria de fluxo de sangue periférico. O tratamento é realizado com eculizumabe.
Aproveite e leia:
Investigação de Trombofilias
Trombofilias são condições que aumentam o risco de tromboses. A investigação de trombofilias após um evento trombótico tem indicações específicas. A British Society for Haematology lançou em 2022 uma diretriz com recomendações para testar trombofilias hereditárias e adquiridas. Esse tópico revisa as principais orientações do documento.
Caso Clínico #26
Homem de 36 anos procura o pronto atendimento por icterícia há 4 dias.
Reposição de Ferro na Insuficiência Cardíaca
Pacientes com insuficiência cardíaca (IC) tem altas taxas de deficiência de ferro. Rastrear e tratar ferropenia em pacientes com IC pode levar a melhores desfechos. No congresso da American Heart Association (AHA) de novembro de 2022, foi publicado o estudo IRONMAN, que avaliou infusão de ferro intravenoso em pacientes com IC e ferropenia. Aproveitamos para revisar o tema neste tópico.
Profilaxia Primária de Trombose no Paciente com Câncer
Pacientes com neoplasia possuem alto risco para desenvolvimento de eventos tromboembólicos. Encontrar o grupo que mais se beneficia de profilaxia primária é uma tema recorrente em diversos estudos nos últimos anos. O trabalho TARGET-TP, publicado na JAMA em novembro de 2023, propôs uma nova estratégia para identificar esses pacientes. Esse tópico revisa o tema e os resultados do estudo.
Fluidos na Pancreatite Aguda
Recentemente o New England Journal of Medicine publicou o Waterfall, um estudo sobre ressuscitação volêmica na pancreatite aguda. Um tema muito discutido e com poucas evidências. Vamos ver o que essa nova evidência acrescentou e revisar o tópico.
