Caso Clínico #19
O caso clínico abaixo é apresentado em partes. O negrito é a descrição do caso, as partes que não estão em negrito são os comentários. Ao final, você encontrará a resolução e os pontos de aprendizagem resumidos.
Um homem de 63 anos comparece à consulta de rotina com febre diária há dois meses. Ele relata que a temperatura atinge valores máximos de 38,5°C e que os episódios febris ocorrem apenas no período noturno. O paciente realizou um transplante renal há 14 anos. Queixa-se também de hiporexia e perda ponderal de 12 kg no período.
No paciente imunossuprimido, a febre abrange diferentes causas infecciosas e não infecciosas. Há aumento do risco de infecções oportunistas, maior gravidade dos casos na neutropenia febril e maior incidência de neoplasias [1].
Em pacientes com transplante de órgãos sólidos, as infecções prováveis podem ser organizadas pelo tempo decorrido desde o transplante [2, 3].
Menos de um mês após o transplante:
- Infecções provenientes do doador, como infecção de corrente sanguínea ou dengue;
- Complicações cirúrgicas, como infecção de ferida operatória;
- Infecções pré-existentes no receptor;
- Infecções nosocomiais após o transplante;
- Outras causas de febre nesse período são as reações transfusionais e rejeição ao enxerto. Reação às medicações imunossupressoras também pode causar febre, em especial a timoglobulina, cuja imunogenicidade é alta por ser uma imunoglobulina obtida do sangue de coelho.
De um mês até 6 a 12 meses após o transplante:
- Reativação de vírus, como CMV e herpesvírus;
- Pneumonia por Pneumocystis jirovecii, principalmente na ausência de profilaxia com sulfametoxazol-trimetoprima. Este antibiótico também previne infecção pelo Toxoplasma gondii e infecções urinárias.
Após o primeiro ano do transplante:
- Infecção pelo poliomavírus BK com injúria ao enxerto e papilomavírus com formação de condilomas;
- Colite por Clostridium difficile mesmo sem histórico de uso de antimicrobiano;
- Patógenos oportunistas como fungos (aspergilose, histoplasmose, criptococose) e parasitas intestinais (microsporídio, isóspora e criptosporídio).
Qual imunossupressor o paciente usa e se está utilizando alguma profilaxia para infecção são informações necessárias. Imunossupressores diferentes aumentam o risco de infecções diferentes. Inibidores da calcineurina (tacrolimus e ciclosporina) aumentam a chance de infecção virais, como citomegalovírus e vírus de Epstein Barr, já os medicamentos anti-TNF aumentam risco de infecção por micobactérias [4].
Pacientes submetidos a transplante renal devem receber profilaxia com sulfametoxazol-trimetoprim para prevenir infecção por Pneumocystis jirovecii e pacientes hematológicos em quimioterapia habitualmente usam aciclovir para profilaxia de infecção pelo vírus herpes simplex [5, 6].
Mais informações sobre o transplante são necessárias, assim como quais medicamentos o paciente está em uso.
O paciente tem doença renal crônica secundária à diabetes desde os 45 anos. Realizou hemodiálise por 4 anos e o transplante renal com doador falecido em 2010. Ele faz uso de insulina NPH e regular, esquema de imunossupressão com micofenolato, prednisona e tacrolimus, profilaxia com sulfametoxazol-trimetoprima. Tem boa adesão medicamentosa e apresentou intercorrências clínicas apenas no 1° ano após o transplante, realizando tratamento para citomegalovírus.
No exame físico tem sinais vitais estáveis, com pressão arterial 125/80 mmHg, frequência cardíaca de 78 batimentos por minuto, frequência respiratória 18 incursões respiratórias por minuto e afebril. Seu peso é de 51 kg. Emagrecido, descorado, anictérico e acianótico. Exame cardiovascular sem alterações. Abdome plano, simétrico, com cicatriz em fossa ilíaca direita, onde foi realizado o enxerto renal. Há linfonodomegalia palpável em região inguinal direita, com cerca de 2,5 cm de diâmetro, indolor e aderida aos planos profundos. O exame da região genital é normal, sem ulcerações ou corrimento. Não apresenta edema nas extremidades.
A abordagem agora pode ser modificada de febre a esclarecer para linfonodomegalia a esclarecer. As causas de linfonodomegalia são mais limitadas e uma amostra do linfonodo fornece o diagnóstico em muitos casos que os exames não invasivos são inconclusivos. Além disso, a causa da febre deve ser a mesma da linfonodomegalia.
Uma regra mnemônica para organizar as causas de linfonodomegalia é MIAMI: malignidade, infecção, autoimune, miscelânea e iatrogênico - ver na tabela 1 [7].

Uma maneira de organizar as causas de linfonodomegalia é dividi-las em localizadas ou generalizadas. Quando os linfonodos aumentados estão restritos a mesma cadeia linfonodal, considera-se a linfonodomegalia como localizada. Nesses casos deve-se buscar infecções ou neoplasia nos sítios de drenagem daquela cadeia. Ver tabela 2.
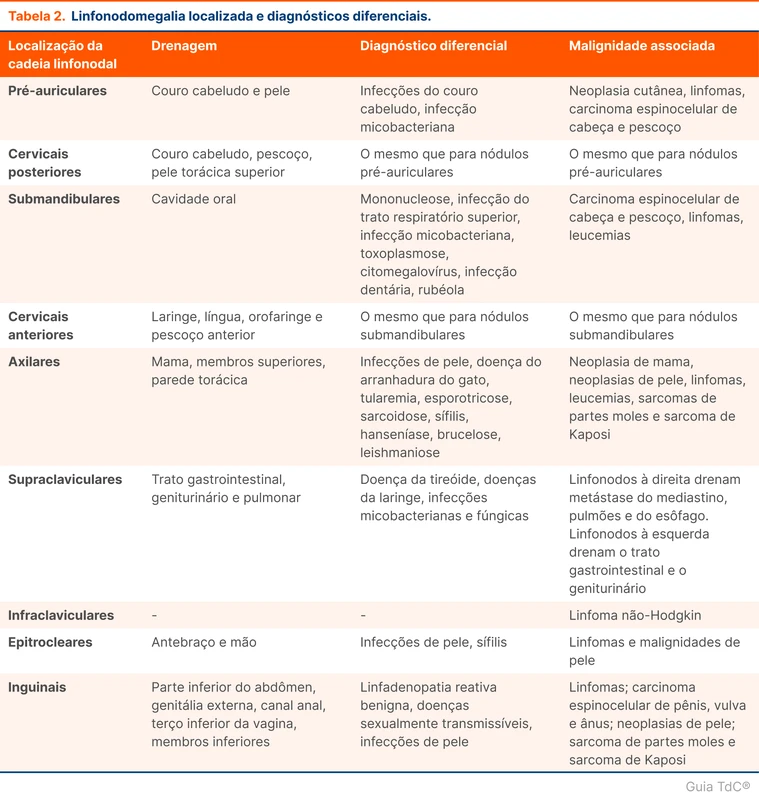
Em relação a linfonodomegalia generalizada, alguns sintomas e achados no exame físico e exames complementares podem direcionar a investigação para causas específicas. Por exemplo:
- Faringite e esplenomegalia: mononucleose e síndrome mono-like (HIV, toxoplasmose, herpesvírus, citomegalovírus).
- Pancitopenia: leucemia e linfoma.
- Sudorese noturna e perda ponderal: doenças linfoproliferativas e tuberculose.
Algumas características dos linfonodos são sinais de alarme por aumentarem a chance de uma causa neoplásica:
- Localização: supraclaviculares tem forte associação com câncer. Quando não existem lesões nos membros superiores, os axilares têm maior probabilidade de serem neoplásicos [8]. Tamanho: a maior associação com neoplasia é de linfonodos com mais de 2,25 cm² [9].
- Características: consistência rígida ou elástica, mas firme e aderida aos planos profundos; ausência de dor e irregularidade.
- Tempo: duração maior que quatro a seis semanas, já que muitas etiologias de linfonodomegalia são autolimitadas.
Quando a causa não está clara na avaliação clínica inicial ou há sinais de alarme como febre e perda de peso, exames complementares são necessários para investigar se há outras cadeias linfonodais acometidas.
O ultrassom consegue delimitar o tamanho, a forma, as margens e a relação com estruturas internas do linfonodo. Algumas características determinadas pelo ultrassom doppler são indícios de linfonodo maligno: distribuição do fluxo sanguíneo mais periférica, formato redondo e os índices de resistividade e de pulsatilidade altos [10 ,11].
Tomografia e ressonância magnética auxiliam mais na pesquisa de linfonodos da região torácica e abdominopélvica e no acometimento de outros órgãos como fígado e baço [12].
Nesse momento é necessário realizar exames laboratoriais gerais que possam auxiliar com pistas, como hemograma, e sorologias para infecções sexualmente transmissíveis. Exames de imagem também são necessários para delimitar melhor a linfonodomegalia. Apesar de ser imunossuprimido, não há necessidade de antibioticoterapia de empírica. Nosso paciente está estável e com uma queixa crônica de febre. É razoável aguardar os resultados dos exames para avaliar a necessidade de antibioticoterapia. O tamanho dos linfonodos do paciente aumenta a chance de uma causa neoplásica.
No hemograma, a hemoglobina estava 7,5 g/dl, com VCM de 87 e HCM 26, leucócito de 5200/mm³, sem alteração na contagem diferencial e plaquetas 274 mil/mm³. O coagulograma, função renal e hepática estavam normais. A desidrogenase láctica teve resultado de 4085.
O paciente realizou ultrassonografia da região inguinal com a presença de linfonodomegalia inguinal direita, com 3,4 x 2,2 cm, heterogênea, com vascularização central por vasos de pequeno calibre, deslocando o plexo vascular profundamente, podendo corresponder a conglomerado linfonodal. Demais estruturas próximas sem alterações.
Foi realizada tomografia de tórax, abdome e pelve para buscar outras linfonodomegalias e achados que possam direcionar a investigação. A tomografia de tórax não apresentou alterações. A tomografia de abdome e pelve apresentou linfonodos aumentados nas cadeias femoral, ilíacas externas e obturatórias à direita e aortocaval. O rim transplantado estava localizado na fossa ilíaca direita, com morfologia, dimensões, eixo, contornos e espessura do parênquima normais.
A tomografia caracterizou o quadro como uma linfonodomegalia generalizada. Nos pacientes imunossuprimidos e com linfonodomegalia generalizada com duração maior que quatro semanas, as duas principais categorias do mnemônico MIAMI são infecção e malignidade.
As exposições epidemiológicas antes e após o transplante determinam um maior risco de certas infecções que causam febre e linfonodomegalia. A reativação de infecções latentes como a tuberculose é mais prevalente que na à população geral e os casos de linfadenite tuberculosa são uma importante manifestação extrapulmonar desses pacientes. O diagnóstico definitivo é dado pela análise histopatológica do linfonodo com identificação do granuloma caseoso e positividade na reação dos bacilos álcool-ácido resistentes (BAAR) ou cultura da micobactéria [13-16].
Pacientes com transplante renal possuem maior risco de malignidades específicas. Uma neoplasia importante nesse grupo é a doença linfoproliferativa pós transplante (PTLD). A PTLD é um grupo de condições que vai desde proliferação benigna linfonodal até linfomas agressivos como o linfoma de Burkitt. Os fatores de risco mais associados são o uso crônico de imunossupressores (usados para prevenir a rejeição ao transplante) e infecções por vírus oncogênicos como o vírus Epstein Barr (tabela 3) [17, 18].
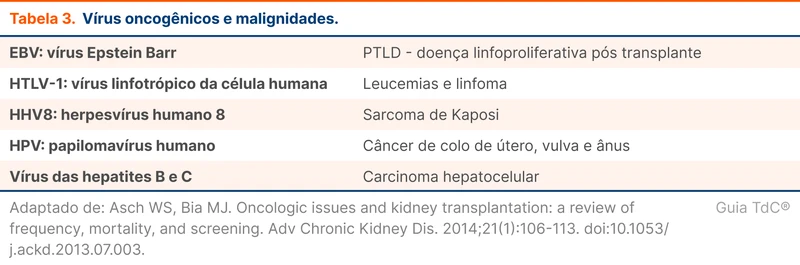
Outras neoplasias com maior frequência em pacientes com transplante são os cânceres de pele não melanoma, o sarcoma de Kaposi, cânceres renal e hepático e linfomas. Em transplantados renais, além da maior incidência, essas neoplasias ocorrem mais precocemente. Alguns cânceres comuns, como mama e próstata, não são mais prevalentes nessa população [18].
Na suspeita de malignidade ou quando não se identifica a etiologia da linfonodomegalia, uma amostra do linfonodo é necessária. Essa amostra pode ser obtida de três maneiras: duas que envolvem amostra tecidual, sendo a biópsia excisional e a biópsia com agulha grossa (core biopsy), e uma que envolve amostra citológica, sendo essa a punção por agulha fina (PAF). As biópsias analisam o linfonodo com maior preservação da arquitetura tecidual, oferecendo mais detalhes sobre a patologia. Já na punção, as células estudadas estão dispersas, sem preservação do tecido. A biópsia linfonodal recomendada na suspeita de neoplasia é a excisional. A PAF tem limitação no diagnóstico de linfomas, com alta taxa de falso negativo; mas apresenta boa acurácia na avaliação de linfonodos suspeitos para metástase de câncer sólido, como o de mama [19-21].
As duas principais hipóteses diagnósticas nesse momento são tuberculose e linfoma no contexto de PTLD. É necessário realizar uma biópsia excisional do linfonodo, tendo em vista a possibilidade do diagnóstico de linfoma nesse caso. O material deve ser enviado para cultura.
O paciente foi internado para melhor investigação. Foi indicada biópsia excisional do conglomerado linfonodal da região inguinal. Na análise histopatológica inicial, evidenciada uma neoplasia pouco diferenciada, infiltrativa no tecido celular subcutâneo e derme profunda. O material foi encaminhado para imuno-histoquímica e o laudo final foi de linfoma difuso de grandes células B do tipo centro germinativo, compatível com doença linfoproliferativa pós transplante (PTLD) monomórfica.
O paciente foi avaliado pela equipe da hematologia para início de quimioterapia. Foi realizado as sorologias para HIV, hepatite B e hepatite C que vieram negativas. O PCR para EBV sérico teve resultado de 358 cópias/mL (VR < 50 cópias/mL). Também foi realizada biópsia de medula óssea com resultado de neoplasia maligna infiltrativa com áreas de necrose e perfil imuno-histoquímico compatível com o diagnóstico de infiltração por doença linfoproliferativa.
O tratamento padrão com esquema R-CHOP (rituximabe, ciclofosfamida, doxorrubicina, vincristina, prednisona) foi iniciado. O paciente segue em esquema de quimioterapia no momento.
A PTLD ocorre em cerca de 4% dos transplantados renais e o linfoma representa 20% dos casos de câncer em transplantados de órgãos sólidos. Pela correlação com EBV, o risco é maior em transplantados que nunca tiveram contato com o vírus e recebem órgãos de doadores com EBV. A atividade do EBV ocorre com linfócitos B, tornando o linfoma de células B mais comum no primeiro ano após o transplante de pacientes jovens. Já a PTLD de linfócitos T é menos prevalente e não se relaciona ao EBV [17, 22].
O EBV tem alta prevalência na população (infectividade de 90%) e mantém-se latente nos linfócitos B. Com a desregulação do sistema imunológico no transplante, há proliferação viral e replicação desorganizada celular propiciando a oncogênese. Em 50-80% dos casos de PTLD há detecção do EBV. Casos de PTLD negativos para EBV ocorrem mais tardiamente, em geral após um ano de transplante. O tratamento da PTLD é o mesmo para pacientes EBV positivos ou negativos [23, 24].
A PTLD pode ser dividida em monomórfica ou polimórfica. A monomórfica é caracterizada por uma proliferação celular semelhante a um tipo específico de linfoma, como o linfoma difuso de grandes células B. A PTLD polimórfica, por outro lado, mostra uma composição celular mista, que não preenche critérios para linfoma de células B ou T, podendo incluir linfócitos pequenos, imunoblastos e plasmócitos. A PTLD monomórfica tem pior prognóstico e pode exigir tratamento mais agressivo em comparação à PTLD polimórfica [25].
A apresentação clínica de PTLD é variável, mas febre e linfadenopatia são as manifestações mais comuns. Sintomas específicos do um órgão acometido por infiltração podem ocorrer. No trato gastrointestinal pode se manifestar como dor abdominal, sangramentos e até obstrução intestinal. Outros acometimentos fora do linfonodo são a pele, os pulmões, o sistema nervoso central e o próprio aloenxerto [24, 26].
Na investigação laboratorial, deve ser solicitado PCR para EBV e o nível da lactato desidrogenase (DHL) está comumente elevado [23]. Quando disponível, o PET CT tem alta sensibilidade para detecção de PTLD. Torna-se útil para guiar a biópsia e permitir o diagnóstico definitivo. Em situações de inviabilidade da biópsia, a combinação de alteração na imagem e elevação de PCR do EBV podem ser considerados para diagnóstico presuntivo [27].
Alguns pontos de aprendizagem sobre o caso que você não pode esquecer:
- As infecções que acometem o paciente com transplante de órgão podem ser organizadas a partir do tempo após o transplante.
- As causas de linfonodomegalia podem ser divididas em localizadas ou generalizadas. Linfonodos aumentados restritos a mesma cadeia linfonodal são considerados localizados. Nesses casos deve-se buscar infecções ou neoplasia nos sítios de drenagem daquela cadeia.
- Linfonodomegalias maiores que 2,25 cm², especialmente quando persistem por mais de seis semanas e não tem outra explicação, tem alta chance de serem causadas por uma neoplasia.
- Há três maneiras de adquirir material de um linfonodo: biópsia excisional, biópsia por agulha grossa (core biopsy) e punção por agulha fina. Biópsia excisional e core biopsy coletam amostras histológicas, enquanto a punção por agulha fina coleta uma amostra citológica. A recomendada em casos de suspeita de linfoma é a biópsia excisional.
- A doença linfoproliferativa pós transplante (PTLD) é um grupo de condições que vai desde proliferação benigna linfonodal até linfomas agressivos como o linfoma de Burkitt. Ocorre em cerca de 4% dos transplantados renais e o linfoma representa 20% dos casos de câncer em transplantados de órgãos sólidos. Está relacionada a atividade do vírus de Epstein Barr e desregulação do sistema imunológico no transplante.
