Diretriz Europeia de Esclerose Lateral Amiotrófica
A esclerose lateral amiotrófica (ELA) é uma doença neurodegenerativa caracterizada por uma perda progressiva da motricidade voluntária. Em março de 2024, a Academia Europeia de Neurologia publicou uma diretriz de recomendações [1] sobre a doença que será revisada neste tópico.
Manifestações clínicas de ELA
A ELA é caracterizada por um déficit motor indolor e progressivo com disfunção de neurônio motor superior (NMS) e inferior (NMI) ao mesmo tempo. Um exemplo espasticidade (sinal de NMS) associada a atrofia muscular e fasciculações (sinais de NMI). O início dos sintomas costuma ocorrer por volta da sexta década de vida. É uma doença degenerativa, com sobrevida mediana de aproximadamente quatro anos, com apenas 6% dos pacientes vivos após seguimento de 10 anos na forma clássica.
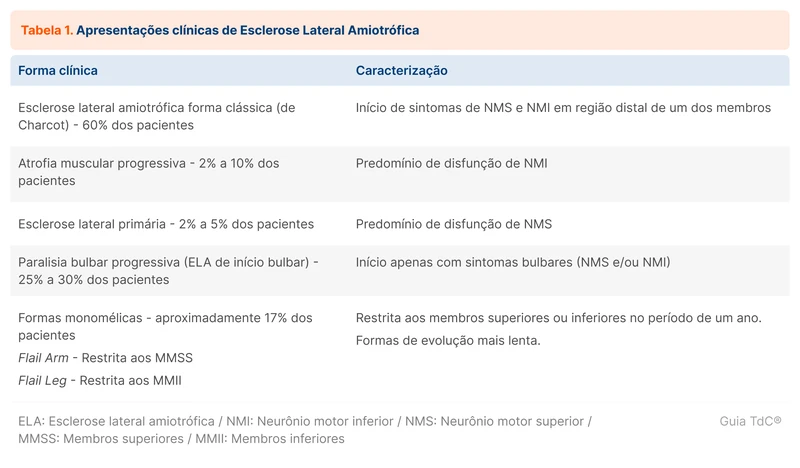
A doença tem várias apresentações clínicas, com uma parte dos pacientes exibindo predomínio de disfunção de NMS (esclerose lateral primária), e outra com predomínio de disfunção de NMI (atrofia muscular progressiva). Existem diversas formas clínicas entre os dois extremos (tabela 1).
O déficit motor pode iniciar em qualquer dos quatro segmentos do sistema nervoso central (SNC): bulbar (musculatura da fala e deglutição), cervical (membros superiores), torácico (musculatura torácica e abdominal) e lombossacral (membros inferiores). A doença afeta mais de uma região progressivamente, mas existem formas restritas a um único membro. Em até 60% dos pacientes, a doença começa nos membros (região cervical ou lombossacral), geralmente de forma assimétrica, conhecida como forma clássica ou de Charcot [2].
Em até 30% dos pacientes, a doença começa na região bulbar, em que a fraqueza pode se manifestar como disartria e disfagia, conhecida como ELA de início bulbar ou paralisia bulbar progressiva. Na região bulbar, as disfunções de NMS e NMI são:
- NMS bulbar: labilidade emocional (afeto pseudobulbar); disartria; reflexos mandibular e nauseoso exacerbados
- NMI bulbar: atrofia e fasciculações de língua; disartria e disfagia
A ELA também pode ser acompanhada de sintomas cognitivos e está associada a demência frontotemporal (DFT). ELA evolui para DFT em 15% dos casos e a associação entre as doenças está presente no momento do diagnóstico em 10% das vezes [3].
Diagnóstico de ELA
Para o diagnóstico de ELA, é necessário documentar o comprometimento do NMS (pelo exame neurológico) e NMI (pelo exame neurológico e/ou pela eletroneuromiografia) e excluir diagnósticos diferenciais. A eletroneuromiografia pode auxiliar o diagnóstico e deve ser feita em todos os segmentos do sistema nervoso central (bulbar, cervical, torácico e lombossacral) para avaliar acometimento de NMS e NMI, além de sinais de reinervação aguda e crônica.
Os critérios de Gold Coast organizam o diagnóstico em três pontos [4]:
- Déficit motor progressivo documentado em avaliação sequencial ou com história clínica
- A presença de disfunção concomitante do NMS e NMI em pelo menos um dos quatro segmentos do SNC ou disfunção do NMI em pelo menos dois segmentos
- Exclusão de diagnósticos diferenciais
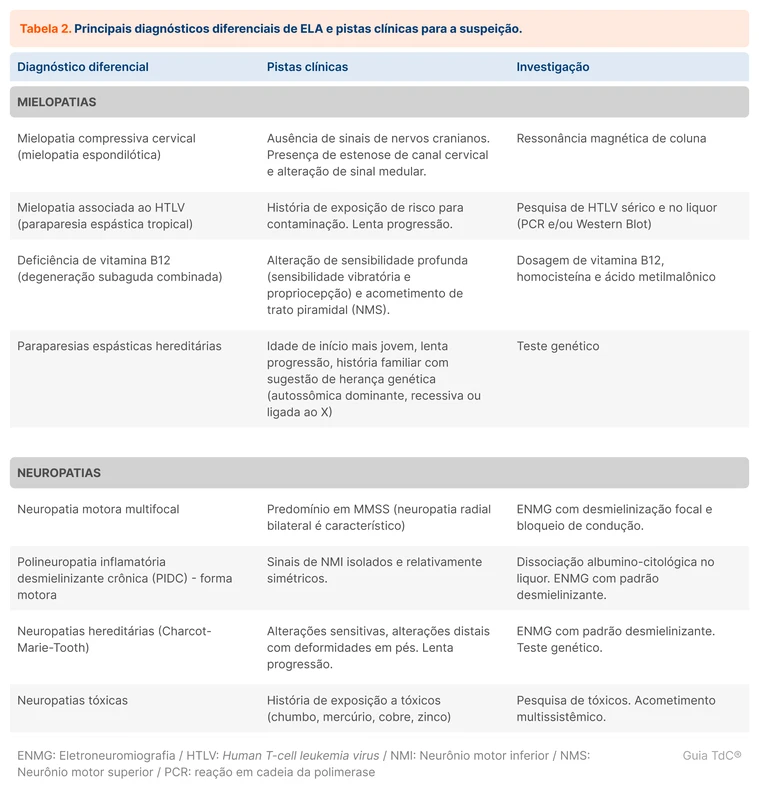
O diagnóstico é feito com a presença dos três pontos.
As mielopatias e neuropatias são os principais diagnósticos diferenciais na suspeita de ELA e estão organizadas na tabela 2.
Exames de imagem auxiliam na avaliação de diagnósticos diferenciais. Na ressonância magnética, alguns sinais estão associados a ELA:
- Hipersinal na região dos tratos corticoespinhais nas sequências ponderadas em T2
- Hipersinal da língua nas sequências ponderadas em T1, ou "sinal da língua branca” [5]
- Hiposinal em T2 no giro pré-central em imagens ponderadas em susceptibilidade (SWI), conhecido como "sinal da banda motora” [6]
Contudo, as alterações em exames de imagem têm baixa acurácia diagnóstica isoladamente.
Suporte nutricional e respiratório na ELA
Os principais problemas relacionados a pacientes com ELA são a disfagia e a sialorreia (salivação excessiva). Os pacientes devem ser avaliados periodicamente para cálculo de necessidade calórica, ajuste de consistência dos alimentos e avaliação do risco de aspiração. A discussão sobre gastrostomia deve ser introduzida precocemente nas consultas, à medida que a doença avança. Caso indicado, o procedimento não deve ser postergado.
Quanto aos sintomas respiratórios, é necessário treinamento de cuidadores para posicionamento durante a alimentação e técnicas de assistência para tosse, para diminuir o risco de aspiração e facilitar expectoração de muco. Muco espesso também deve ser avaliado e tratado com mucolíticos conforme necessidade.
Sinais e sintomas de insuficiência respiratória devem ser pesquisados ativamente em cada consulta. Testes de oximetria e função respiratória devem ser realizados no momento do diagnóstico e periodicamente para avaliar necessidade de ventilação não-invasiva. Pacientes com capacidade vital forçada (CVF) ou capacidade vital (CV) abaixo de 80% do predito na espirometria devem ser encaminhados para avaliação de suporte ventilatório. Se CFV ou CV estiverem abaixo de 50% do predito ou existir retenção de CO₂ na gasometria arterial, o paciente deve ser encaminhado para suporte ventilatório com ventilação não invasiva (VNI) mesmo se assintomático. Veja mais sobre VNI na revisão Ventilação Não Invasiva.
Controle de sintomas, profilaxia de tromboembolismo e drogas modificadoras de doença na ELA
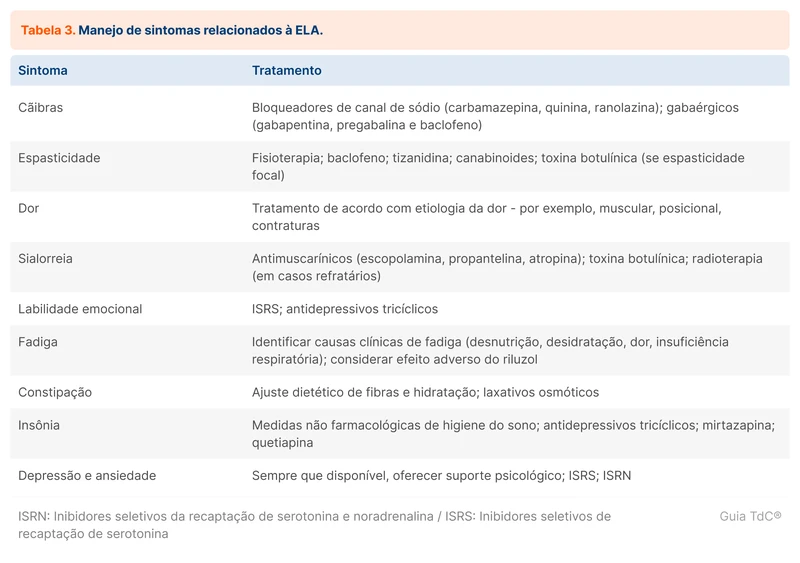
Os principais sintomas referidos pelos pacientes e seus tratamentos de primeira linha estão expostos na tabela 3.
Apesar do risco de trombose venosa pela imobilidade, não há evidências que indiquem benefício da anticoagulação profilática para trombose venosa. São recomendadas medidas não farmacológicas como movimentação passiva, fisioterapia, elevação dos membros ao repouso e meias de compressão.
Existem duas drogas modificadoras de doença citadas na diretriz: riluzol e tofersen. O riluzol, na dose de 50 mg duas vezes ao dia, é recomendado para todos os pacientes, com aumento de sobrevida mediano de dois a três meses [7]. Já o tofersen (Qalsody), administrada por via intratecal, é restrita aos pacientes com ELA decorrente de uma mutação específica no gene da superóxido dismutase (SOD1). No momento é indisponível no Brasil [8].
Aproveite e leia:
Caso Clínico #20
Homem de 50 anos com queixa de fraqueza em pés e mãos.
Gabapentinoides, Dor Neuropática e Eventos Adversos
Os gabapentinoides (pregabalina e gabapentina) são anticonvulsivantes amplamente utilizados para a dor neuropática. Vistos como drogas seguras, a prescrição dessas medicações têm aumentado progressivamente. Estudo publicado em julho no American Journal of Kidney Diseases (AJKD) investigou a associação de gabapentinoides e eventos adversos em idosos com doença renal crônica. Vamos ver os resultados e revisar a evidência sobre essas medicações.
Gabapentinoides: Principais Usos e Novos Eventos Adversos
Evidências dos últimos anos identificaram riscos dos gabapentinoides anteriormente desconhecidos que devem ser considerados antes da prescrição. Os dois principais medicamentos da classe são a gabapentina e a pregabalina. O TdC Bulário revisa as indicações e eventos adversos dos gabapentinoides.
Vacina Pneumocócica no Adulto
Atualmente, o esquema de vacinação pneumocócica no Brasil é baseado em duas vacinas: VPC13 e VPP23. Em outubro de 2021, o Comitê de Práticas Imunizantes dos Estados Unidos recomendou o uso das novas vacinas PCV15 ou PCV20, considerando uma maior efetividade com relação ao esquema anterior. Assim, trazemos uma revisão do esquema vacinal brasileiro e os principais pontos desta nova recomendação.
Piúria, Bacteriúria e Delirium
O diagnóstico de infecção do trato urinário (ITU) pode ser feito sem o exame de urina se os sintomas forem clássicos. Contudo, se os sintomas forem atípicos ou naqueles com dificuldade em demonstrar seus sintomas, existe dúvida sobre o papel dos exames de urina. Nesse contexto, trouxemos um estudo publicado em setembro de 2022 no American Journal of Medicine sobre a correlação entre piúria e bacteriúria.
