Gamopatia Monoclonal de Significado Indeterminado (MGUS)
A gamopatia monoclonal de significado indeterminado (MGUS) é uma condição pré-maligna com risco de evoluir para neoplasia hematológica, principalmente mieloma múltiplo. A maioria dos pacientes com MGUS não progredirá para quadros neoplásicos, dificultando a escolha de quem se beneficiaria de investigação adicional. Em abril de 2024, foi publicado no Annals of Internal Medicine uma calculadora de risco para auxiliar na indicação de investigação medular nesses pacientes [1]. Este tópico revisa MGUS e traz os resultados do estudo.
O que é gamopatia monoclonal?
Plasmócitos são as células do sistema imune que produzem anticorpos. Os anticorpos são chamados de imunoglobulinas ou gamaglobulinas. A estrutura de uma imunoglobulina é formada por combinações de dois tipos de cadeias, uma leve e uma pesada (figura 1):
- Cadeias pesadas: cinco tipos diferentes e definem a classe da imunoglobulina (IgA, IgG, IgM, IgD e IgE).
- Cadeias leves: dois tipos diferentes, kappa (𝜅) e lambda (𝜆).
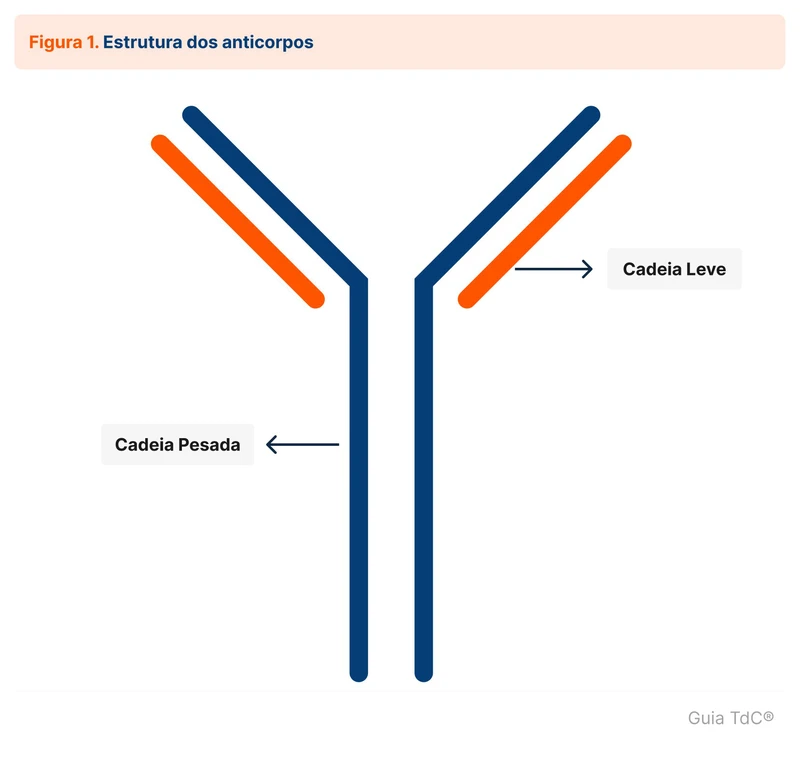
Por exemplo, um anticorpo IgG em que a cadeia leve é kappa é chamado de IgG kappa.
Cada plasmócito produz apenas um tipo de imunoglobulina específica contra um antígeno. Quando necessário, o sistema imune copia o plasmócito em clones idênticos que irão juntos produzir em maior quantidade a imunoglobulina contra aquele antígeno.
Em situações de estimulação imunológica, como em uma infecção, há uma resposta a diversos antígenos. Nesse caso, são produzidas diversas imunoglobulinas por diferentes plasmócitos clonados. Essas imunoglobulinas são percebidas na eletroforese de proteínas como um pico de base larga, chamado de pico policlonal, já que vários clones distintos de plasmócitos estão envolvidos (veja mais em "como identificar uma gamopatia monoclonal?").
Em outras situações, um único clone de plasmócitos produz em excesso um único tipo de imunoglobulina, chamado de proteína monoclonal ou proteína M. Essa situação é chamada gamopatia monoclonal e ocasiona um pico de base estreita na eletroforese, chamado de pico monoclonal. O plasmócito clonado também pode produzir apenas cadeias leves livres (kappa ou lambda), sem cadeia pesada associada.
A gamopatia monoclonal pode ocorrer em neoplasias hematológicas, em doenças causadas por toxicidade da proteína M ou pode ter significado clínico indeterminado. A principal doença hematológica associada é o mieloma múltiplo (MM). Outras doenças associadas são macroglobulinemia de Waldenström, amiloidose primária e síndrome de POEMS.
Como identificar uma gamopatia monoclonal?
Os três principais exames de investigação de gamopatias monoclonais são a eletroforese de proteínas, a imunofixação sérica e a pesquisa de cadeias leves livres.
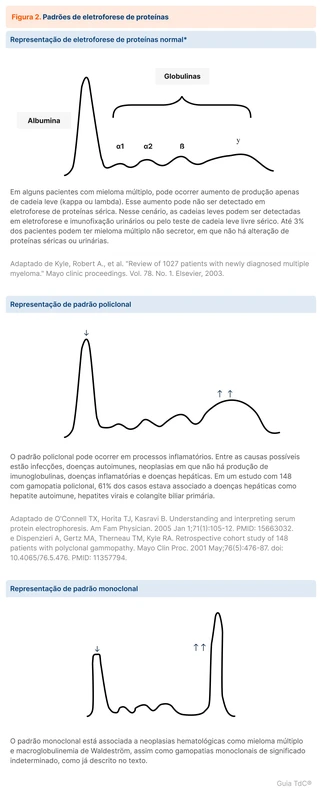
A eletroforese de proteínas (figura 2) quantifica as proteínas e as representa em um gráfico, conforme o peso (mais pesadas à esquerda e mais leves à direita) e a concentração sérica (quanto maior a concentração, maior o "pico"). A albumina é a proteína com maior concentração e tem alto peso, formando um pico à esquerda do gráfico. As outras proteínas são agrupadas em quatro regiões com relevo menor: alfa-1, alfa-2, beta e gama. As imunoglobulinas se localizam na região gama, daí o nome de gamaglobulinas.
Quando há aumento da concentração de imunoglobulinas produzidas por um único clone, pode surgir um pico agudo e de base estreita na região gama chamado de pico monoclonal. A imunoglobulina responsável por esse pico é chamada de proteína M.
A imunofixação identifica a classe de cadeia pesada e de cadeia leve monoclonal (exemplo: IgG kappa). É mais sensível que a eletroforese e detecta quantidades muito baixas de proteína monoclonal. A combinação de eletroforese de proteínas e imunofixação aumenta a sensibilidade de detecção da proteína M de 82% para 93%, em comparação com a eletroforese isoladamente [2].
Eletroforese de proteínas e a imunofixação séricas podem não detectar algumas proteínas monoclonais, especialmente cadeias leves livres em pequena quantidade, difíceis de detectar no soro. Estes exames também podem ser realizados na urina para detecção de cadeias leves. A pesquisa de cadeias leves livres sérica é um exame que consegue identificar as quantidades de kappa e lambda livres no soro mesmo em pequenas quantidades. A relação entre as cadeias leves livres (por exemplo, kappa/lamba) também é usado no diagnóstico de gamopatias monoclonais [2, 3, 4].
O que fazer diante de uma gamopatia monoclonal? O que é MGUS?
Após encontrar uma proteína monoclonal, o próximo passo é avaliar se existe uma doença associada ou não. Sinais de mieloma múltiplo (disfunção renal, anemia e hipercalcemia) devem ser investigados. Neoplasias linfoproliferativas também cursam com a presença da proteína monoclonal e devem ser investigadas conforme o quadro clínico do paciente. A tabela 1 traz os exames iniciais para investigação após identificação de gamopatia monoclonal [2, 5].

Há associação da proteína monoclonal com lesões de órgãos, mesmo na ausência de uma neoplasia hematológica. O termo gamopatia monoclonal com significado clínico é utilizado para esses casos. O tratamento hematológico pode ser indicado para reverter a alteração orgânica. Exemplos de doenças associadas são a amiloidose primária, crioglobulinemias, glomerulonefrites e polineuropatias.
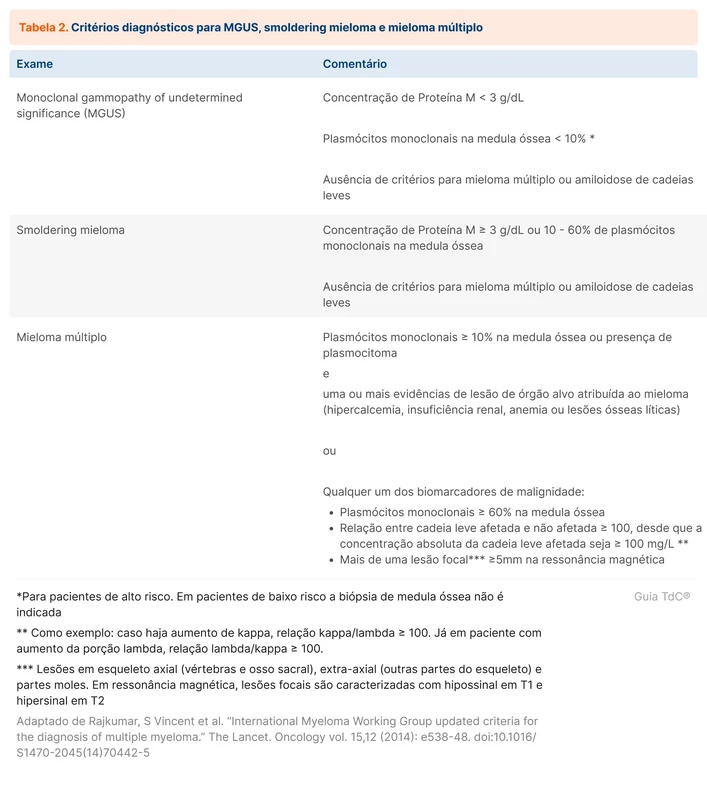
Gamopatia monoclonal de significado indeterminado (utiliza-se comumente a sigla MGUS, do inglês monoclonal gammopathy of undetermined significance) é a situação em que ocorre a produção de uma proteína M sem que haja significado clínico. MGUS está presente em aproximadamente 3% da população com mais de 50 anos. É considerado um estágio pré-maligno de cânceres hematológicos, principalmente o mieloma múltiplo. A maioria dos pacientes não progride para um câncer. Há um estágio intermediário entre o MGUS e o mieloma múltiplo chamado de smoldering mieloma (mieloma assintomático). O risco de progressão para mieloma múltiplo é em torno de 1% ao ano. A probabilidade em 10 anos de progressão é em torno de 12% e em 25 anos de 30%. A tabela 2 traz os critérios diagnósticos de MGUS, smoldering mieloma e mieloma múltiplo [6].
O grupo IStopMM está investigando o rastreio de mieloma múltiplo na população da Islândia e ainda não publicou seus resultados [7].
Como decidir se o paciente com MGUS deve fazer uma biópsia de medula?
Caso não seja identificado neoplasia hematológica, o próximo passo é diferenciar MGUS de smoldering mieloma. Pacientes com smoldering mieloma tem ≥ 10% de plasmócitos na medula óssea, sendo essa a principal diferença em relação aos pacientes com MGUS. Contudo, nem todos os pacientes com gamopatia monoclonal necessitam de investigação medular. A estratificação de risco da Mayo Clinic é recomendada em diretrizes para indicar a necessidade de investigação de medula. (tabela 3). Em pacientes de baixo risco não há indicação de investigação medular, mas é necessário monitorar o paciente [3].

Os preditores mais importantes na avaliação do risco de progressão para mieloma múltiplo são a concentração da proteína monoclonal, o tipo de proteína monoclonal, a relação entre as cadeias leves livres kappa/lambda e o número de plasmócitos clonais na biópsia de medula. Os três tipos de MGUS, conforme a proteína monoclonal produzida, estão na tabela 4.

Mesmo no grupo de alto risco pela Mayo Clinic, 73% dos pacientes não progrediram para neoplasia após 20 anos de acompanhamento, considerando que uma parte faleceu durante esse período. Por isso, são necessárias novas estratégias para definir quem são os pacientes com MGUS que devem ser investigados.
O grupo IStopMM desenvolveu uma calculadora que auxilia na decisão de realizar investigação medular em pacientes com suposto MGUS [1]. Ao inserir o tipo de MGUS, a concentração de proteína M sérica, os valores de IgG, IgA, IgM e a relação kappa/lambda, a calculadora estima a chance de encontrar 10% ou mais de plasmócitos na medula óssea.
O trabalho que avaliou a calculadora incluiu mais de 1000 pacientes com suposto MGUS com mediana de idade de 68 anos. Os pacientes participavam de um estudo em curso na Islândia sobre rastreio de MGUS, ainda não publicado [7]. Foram excluídos os pacientes com MGUS IgM por ser rara a progressão para mieloma múltiplo. Investigação medular foi feita em todos os pacientes. A calculadora estima o risco de o paciente ter um smoldering mieloma, o que nesse contexto significa mais 10% de plasmócitos na medula óssea. Os autores do estudo calcularam a especificidade e a sensibilidade para várias estimativas de risco. Considerando um estimativa de risco de 10% ou mais de ter smoldering mieloma, a ferramenta teve um valor preditivo de 96%.
Estima-se que, em comparação com a calculadora, o modelo da Mayo Clinic indicaria mais biópsias. A ferramenta IStopMM conseguiria evitar 130 a 300 procedimentos a cada 1000 pessoas, em comparação com o modelo da Mayo, sem perder um único diagnóstico de mieloma múltiplo.
Apesar dos resultados, o trabalho possui algumas limitações. A população é pouco diversa geneticamente (apenas islandeses) e os resultados devem ser confirmados em outras amostras populacionais. Além disso, os participantes do estudo vieram de um de rastreio populacional de MGUS. Isso difere do diagnóstico de MGUS da prática clínica, já que não há recomendação de eletroforese de proteínas para rastreio de neoplasias hematológicas em pacientes assintomáticos. A identificação da proteína monoclonal frequentemente é um achado acidental. Ocorre na investigação de doenças ou quando é solicitado para pacientes assintomáticos de rotina [8, 9, 10].
Aproveite e leia:
Amiloidose: Manifestações Clínicas e Diagnóstico
Clinicamente, amiloidose representa um grupo de doenças que ocorrem pelo acúmulo de proteínas no extracelular, podendo levar a disfunção orgânica. Em maio de 2024, uma coorte americana extraiu os dados de 1401 pacientes para avaliar quais sintomas já se encontravam aparentes antes do diagnóstico. Este tópico aborda os principais tipos de amiloidose, suas características e como realizar a investigação.
Leucemia Linfocítica Crônica
A leucemia linfocítica crônica é a leucemia mais comum do mundo. O Journal of the American Medical Association (JAMA) realizou uma revisão em 2023 sobre o diagnóstico e tratamento dessa condição. Esse tópico traz as principais informações sobre manifestações clínicas, diagnóstico e tratamento dessa condição.
Asma - GINA 2023
Aproximadamente 300 milhões de pessoas no mundo têm asma. Anualmente o Global Initiative for Asthma (GINA) publica suas diretrizes para orientar o tratamento da doença. Essa revisão traz os principais pontos da diretriz publicada em 2023.
Anticoagulação no Perioperatório
O manejo de anticoagulantes no perioperatório gera muitas dúvidas. Em abril de 2023, o American College of Physicians publicou uma revisão sobre o tema. Vamos aproveitar para revisitar algumas recomendações importantes.
Doença de Parkinson: Avaliação e Tratamento
A doença de Parkinson é a segunda doença neurodegenerativa mais comum da prática clínica, atrás apenas da doença de Alzheimer. O tratamento envolve medicações sintomáticas e intervenções como a estimulação cerebral profunda (deep brain stimulation, DBS). O tópico “Doença de Parkinson: Avaliação e Tratamento” revisa os principais conceitos para o manejo dessa condição.
