Cardiomiopatia Hipertrófica: Diretrizes de 2024
Em 2024, a American Heart Association/American College of Cardiology (AHA/ACC) e a Sociedade Brasileira de Cardiologia (SBC) publicaram diretrizes de cardiomiopatia hipertrófica. Este tópico aborda a definição, apresentação clínica, diagnóstico e tratamento da cardiomiopatia hipertrófica com base nas duas diretrizes [1, 2].
O que é cardiomiopatia hipertrófica?
A cardiomiopatia hipertrófica (CMH) é uma doença genética que causa aumento da espessura da parede do ventrículo esquerdo (VE) com ou sem hipertrofia do ventrículo direito. A doença pode causar consequências hemodinâmicas e eletrofisiológicas para o paciente. Na CMH, o espessamento da parede ocorre na ausência de outra condição capaz de produzir hipertrofia ventricular - por exemplo, HAS e estenose da valva aórtica [3, 4].
A CMH é a doença cardíaca de origem genética mais frequente, sendo transmitida de forma autossômica dominante. Uma coorte norte-americana encontrou um aumento de incidência e prevalência de CMH, com taxa de mortalidade global maior do que a população em geral (HR 1,44, IC 95%, 1,21 a 1,71; P <0.001), porém em queda [5].
No Brasil, estudos realizados em diferentes regiões indicam a presença consistente de mutações associadas com CMH (genes MYH7, MYBPC3 e TNNT2), o que sugere uma significativa prevalência dessa condição [6, 7].
Apresentação clínica
Muitos pacientes com CMH são assintomáticos e têm expectativa de vida normal. Quando sintomáticos, as principais manifestações são angina, arritmias, síncope, insuficiência cardíaca (IC) com hipertrofia ventricular e morte súbita cardíaca (MSC). A CMH é uma das principais causas de MSC em jovens e atletas [8, 9]. MSC abortada, mesmo na ausência de sintomas prévios, é uma apresentação possível de CMH.
A angina pode ser desencadeada pelo exercício físico ou ocorrer em repouso, e habitualmente não existe correlação com aterosclerose. Mesmo assim, deve-se excluir doença arterial coronariana em pacientes com alto risco cardiovascular.
As arritmias mais comuns são extrassístoles (supraventriculares e ventriculares), fibrilação ou flutter atrial e taquicardia ventricular sustentada ou não sustentada (TVS e TVNS). Pode manifestar-se com palpitações, pré-síncope e síncope. A extensão da fibrose miocárdica está associada com maior risco de ocorrência de TVNS [10].
Em pacientes sintomáticos, geralmente as queixas ocorrem por IC como consequência à obstrução da via de saída do VE (VSVE) e regurgitação mitral secundária. Os sintomas mais comuns são dispneia e fadiga. A IC avançada com congestão sistêmica ou pulmonar é rara. A maioria dos pacientes sem obstrução da VSVE é assintomática, com 10% progredindo para quadros avançados [11].
O eletrocardiograma (ECG) está alterado em 90-95% dos pacientes com CMH. As principais alterações são sinais de sobrecarga de VE e alterações de repolarização [12, 13].
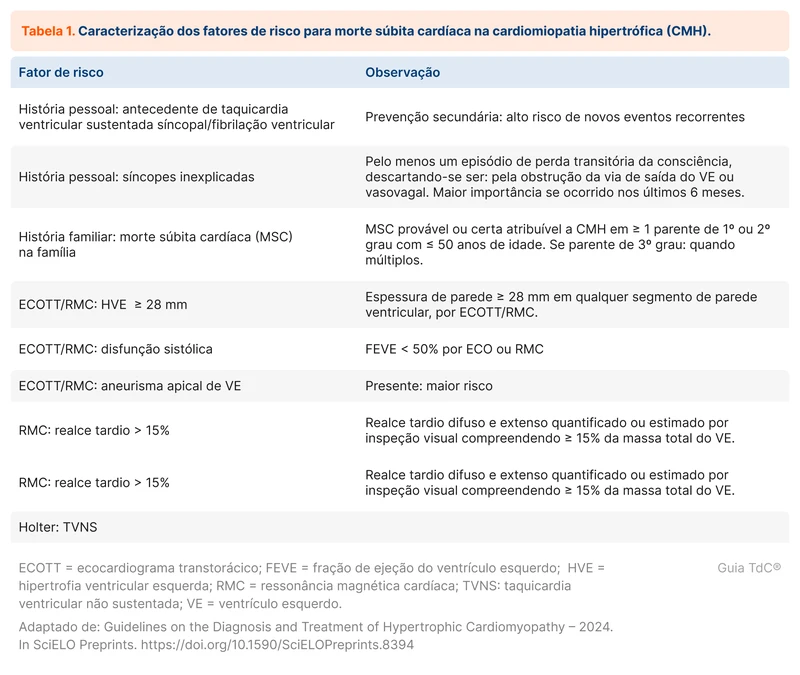
Os principais fatores de risco para MSC estão na tabela 1 [14].
Diagnóstico de cardiomiopatia hipertrófica e diferenciais
O diagnóstico da CMH é realizado com o auxílio do ecocardiograma transtorácico (ECOTT) ou ressonância magnética cardíaca (RMC), sendo esta última indicada quando o ECOTT é inconclusivo [1]. Na impossibilidade de RMC, a tomografia cardíaca pode ser considerada (fluxograma 1).
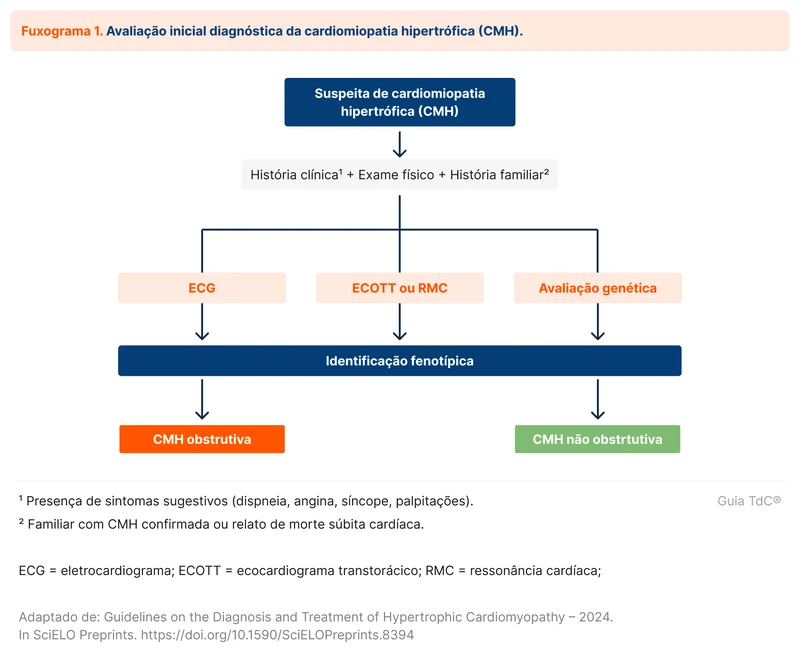
Em adultos, CMH é definida pela presença da espessura diastólica final em quaisquer segmentos do VE ≥ 15 mm na ausência de outra causa de hipertrofia ou ≥ 13 mm em familiares de um paciente com CMH ou pessoas com teste genético positivo [1, 15].
A CMH é considerada obstrutiva quando o gradiente de pico na VSVE ≥ 30 mmHg. Gradientes em repouso ou dinâmicos (durante manobras provocativas) ≥ 50 mmHg definem obstrução mais grave da VSVE [16]. A CMH obstrutiva tem prognóstico e abordagem terapêutica distintos.
A presença de hipertrofia do VE tem três principais diagnósticos diferenciais além de CMH: cardiomiopatia hipertensiva, estenose aórtica e coração do atleta.
Hipertensão arterial sistêmica é a causa mais comum de hipertrofia do VE, principalmente quando não tratada ou tratada parcialmente. Nesse contexto, raramente a espessura do VE é maior que 15 mm. A hipertrofia por HAS é mais frequente em pessoas com mais de 65 anos ou com mais de dez anos de diagnóstico, principalmente na presença de outras lesões de órgão-alvo.
A estenose aórtica causa hipertrofia do VE que pode ser confundida com CMH. A análise da valva aórtica pelo ecocardiograma ajuda a definir que a hipertrofia é por estenose aórtica.
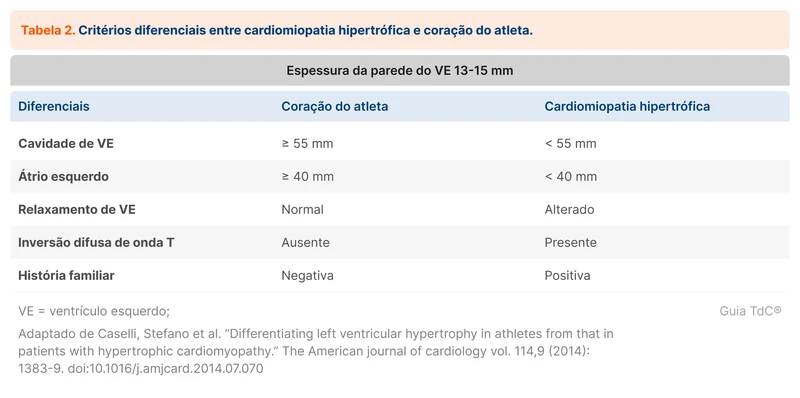
A hipertrofia ventricular esquerda secundária ao exercício ("coração do atleta") ocorre em atletas de alto rendimento, cujos treinos podem aumentar a massa do VE e causar hipertrofia. Diferenciar coração do atleta de CMH é crítico, já que o exercício pode aumentar a chance de MSC em pacientes com CMH. Deve-se excluir a presença de CMH nesses pacientes pelo risco de arritmias e MS durante o esforço físico (veja tabela 2).
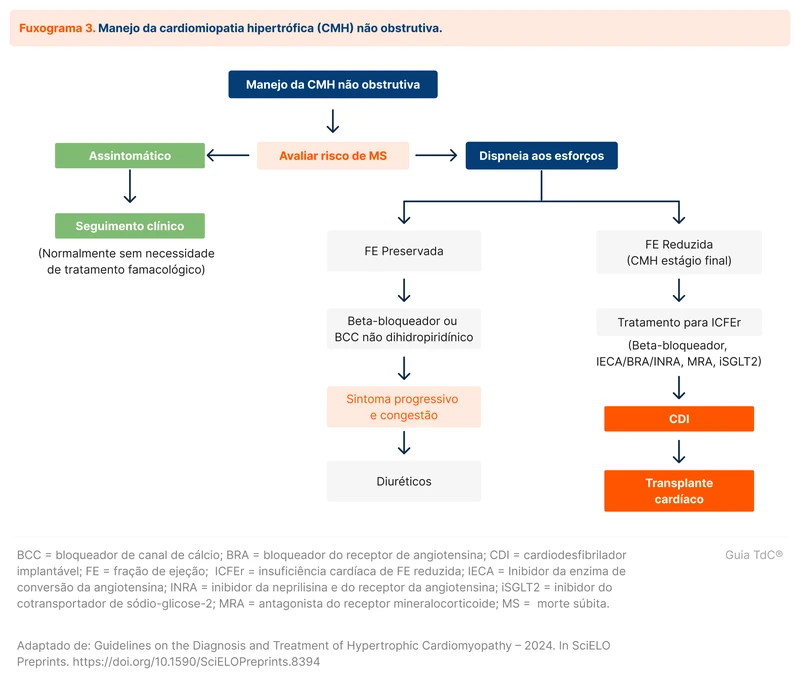
Manejo de cardiomiopatia hipertrófica
O manejo de CMH passa por avaliar o risco de três complicações: morte súbita cardíaca (MSC), insuficiência cardíaca (IC) e fibrilação atrial (FA).
A estimativa do risco de MSC é realizada através da calculadora HCM Risk-SCD, classificando em três categorias de risco: baixo (< 4%), intermediário (4-6%) ou alto (> 6%) [17]. Independente do risco, recomenda-se o implante de CDI nos pacientes com MSC revertida, TVS ou FV [2]. Os demais pacientes com pelo menos um fator de risco devem ser estratificados conforme a idade e a decisão de implante de CDI tomada individualmente.
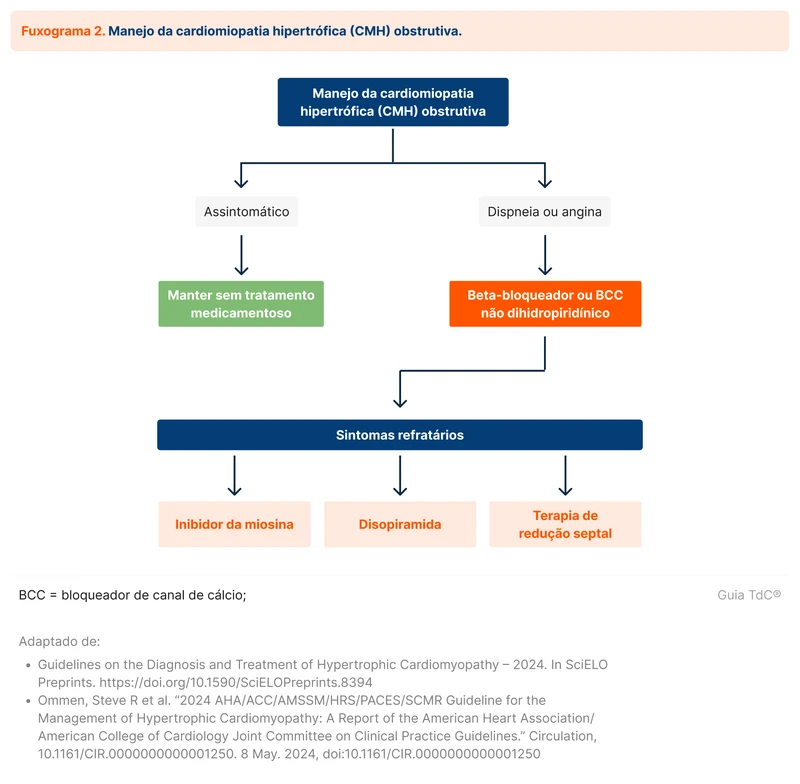
Os beta-bloqueadores são o tratamento de primeira linha para o controle sintomático de angina e dispneia na CMH obstrutiva e não obstrutiva. Na persistência de sintomas ou intolerância aos beta-bloqueadores, recomendam-se bloqueadores dos canais do cálcio não dihidropiridínicos (verapamil ou diltiazem) [1].
Em caso de falha e sintomas decorrentes da obstrução da VSVE, recomenda-se associar um inibidor da miosina cardíaca (mavacanteno e aficanteno), disopiramida ou terapia de redução septal [1] (fluxograma 2). O mavacanteno (Camzyos®) é a única dessas medicações que está disponível no Brasil. A terapia de redução septal é feita cirurgicamente ou com ablação alcoólica.
Em casos de FE reduzida, as medicações para outras causas de IC com FE reduzida também são recomendadas (fluxograma 3).
Anticoagulação é indicada para todos os pacientes com FA, independente do CHADSVASC. DOAC são a primeira opção no tratamento. O uso de antiarrítmicos é uma estratégia segura e pode ser considerada.
Aproveite e leia:
Vonoprazana para Helicobacter pylori
A vonoprazana pertence a uma nova categoria de medicações anti-ulcerosas disponíveis recentemente. Em junho de 2022, um estudo publicado no Gastroenterology avaliou o uso de vonoprazana no tratamento de Helicobacter pylori. Em outubro de 2022, a mesma revista também publicou um artigo que avaliou o uso de vonoprazana no tratamento de esofagite erosiva. Este tópico revisa o mecanismo de ação e os usos dessa nova medicação.
Ezetimibe e Dislipidemia
As estatinas são a primeira escolha no tratamento da dislipidemia, mas nem sempre são suficientes. O estudo RACING, publicado no Lancet em julho, avaliou o uso de ezetimibe associado a rosuvastatina em pacientes com doença aterosclerótica. Vamos ver o que o estudo acrescenta e revisar o uso clínico do ezetimibe.
Hipertensão Arterial na Doença Renal Crônica
O manejo da hipertensão arterial sistêmica na doença renal crônica tem particularidades que podem dificultar o controle pressórico. Este tópico aborda as principais diretrizes de tratamento para esses pacientes, incluindo a de 2023 da European Society of Hypertension (ESH) e de 2024 do Kidney Disease Improving Global Outcomes (KDIGO) e da European Society of Cardiology (ESC).
Carcinoma Hepatocelular
O carcinoma hepatocelular é o câncer hepático primário mais prevalente e possui alta mortalidade quando diagnosticado tardiamente. Os resultados de um estudo sobre o impacto do rastreio dessa condição em pacientes de risco, publicados em abril de 2024 no Journal of the American Medical Association, motivaram a revisão sobre o tema.
Gliflozinas (inibidores da SGLT2)
As gliflozinas (inibidores da SGLT2) são uma das medicações mais estudadas da última década, com pesquisas mostrando seu benefício em diabetes mellitus tipo 2 (DM2), insuficiência cardíaca e doença renal crônica (DRC). Em maio de 2022, o New England Journal of Medicine (NEJM) lançou uma revisão sobre as gliflozinas no manejo de doenças cardiovasculares e trazemos os principais estudos e indicações aqui.
