Insulinização no Diabetes Mellitus Tipo 2
Esta revisão traz os principais conceitos e atualizações sobre a insulinoterapia no diabetes mellitus tipo 2 (DM2).
Como funcionam as insulinas exógenas?
As insulinas exógenas podem ser classificadas em dois grupos [1]:
- Insulinas basais: simulam a secreção fisiológica de insulina entre as refeições. Sua principal função é inibir a produção hepática de glicose. Essas insulinas produzem um pico de ação mais tardio e têm uma duração de ação mais prolongada.
- Insulinas bolus: simulam a secreção fisiológica de insulina durante e logo após as refeições. A principal função é reduzir o pico hiperglicêmico após a alimentação. Essas insulinas produzem um pico de ação mais precoce e têm uma duração de ação mais curta.
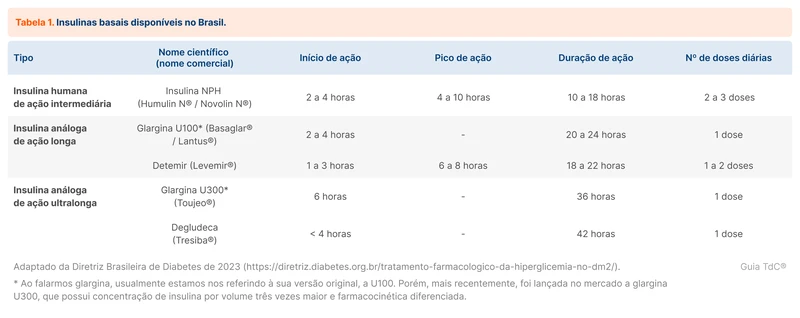
As insulinas basais podem ser divididas em outros três grupos, dispostos na tabela 1. Já as insulinas bolus podem ser divididas em outros dois grupos, dispostos na tabela 2. As insulinas análogas têm menor risco de hipoglicemias, porém o elevado custo ainda é uma limitação.

Indicações de insulinoterapia
Mesmo pacientes aderentes e engajados podem precisar de intensificação da terapia, inclusive com insulina, por conta da natureza progressiva do diabetes. Os profissionais de saúde não devem apresentar a insulinoterapia como consequência de uma falha no tratamento anterior ou como punição por falta de engajamento do paciente [2].
A insulinoterapia plena está indicada para todos os pacientes com diabetes mellitus do tipo 1 (DM1). Já no DM2, as principais indicações do uso de insulina são [1, 2]:
- Sinais e sintomas de catabolismo (como perda de peso e cetose);
- Sintomas de hiperglicemia (como poliúria, polidipsia e polifagia);
- Glicemia capilar > 300 mg/dL;
- Hemoglobina glicada > 9% (Sociedade Brasileira de Diabetes) ou 10% (American Diabetes Association); Intensificação do tratamento em pacientes com múltiplos hipoglicemiantes orais fora da meta de hemoglobina glicada (HbA1C).
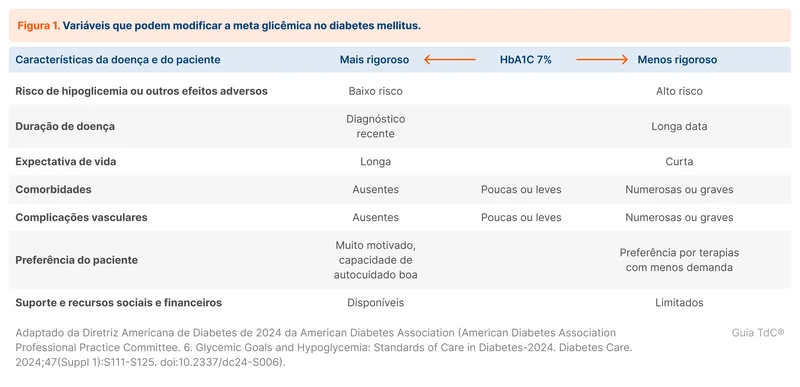
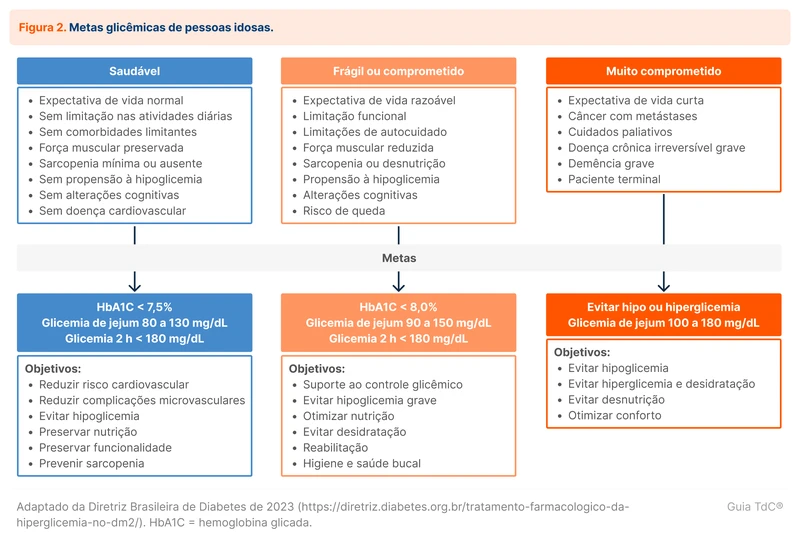
As metas de HbA1C devem ser individualizadas conforme a condição clínica do paciente. Para a maioria das pessoas com DM2, a meta de HbA1C é de valores menores que 7%. A figura 1 mostra fatores que devem ser avaliados para a personalização dessa meta e a figura 2, a individualização dos alvos na população idosa.
A insulina também pode ser indicada no tratamento intra-hospitalar de hiperglicemia, manejo perioperatório de indivíduos com DM2 e controle do diabetes na gestação.
Pacientes com DM2 e níveis muito elevados de HbA1C se beneficiam da introdução precoce de insulinoterapia. Estes pacientes estão sujeitos à glicotoxicidade, que pode reduzir a eficácia das outras medicações. Ensaios clínicos importantes, como o DCCT e o UKPDS, demonstraram que o controle glicêmico rigoroso precoce é benéfico a longo prazo, reduzindo de complicações crônicas [3, 4]. Esse benefício é denominado de efeito legado e o benefício é mantido mesmo que o controle seja perdido posteriormente.
Como iniciar a insulinoterapia e ajuste inicial
Segundo a diretriz da American Diabetes Association (ADA) de 2024, antes de iniciar a insulinoterapia no DM2 sempre que possível deve-se prescrever um fármaco agonista do receptor de GLP-1. Essa recomendação é feita devido ao melhor controle glicêmico, menor ganho de peso e menor risco de hipoglicemia com essa classe em comparação com a insulina [2].
No DM2, evita-se iniciar a insulinoterapia com múltiplas doses diárias de insulina. O primeiro passo costuma ser a aplicação de uma dose de insulina basal ao dia. Em adultos, essa primeira dose de insulina basal costuma ser realizada ao deitar — geralmente às 22 h — sendo por isso chamada de insulina bedtime. É aceitável a aplicação antes do café da manhã em idosos (pelo maior risco de hipoglicemia noturna) ou em pessoas que usam insulinas análogas de ação longa ou ultralonga.
A estratégia de iniciar a insulina bedtime é simples, exigindo apenas uma dose noturna e uma aferição de glicemia pela manhã. O paciente não precisa levar a insulina para o trabalho, por exemplo, sendo conveniente para muitos. Existem evidências de que iniciar com a insulina basal, ao invés de uma prandial ou esquemas com várias doses, leva a um bom controle glicêmico, com menos eventos adversos [5, 6].
A prescrição dessa dose inicial de insulina pode ser feita da seguinte forma:
- Tipo de medicamento: insulinas de ação intermediária, longa ou ultralonga.
- Horário da aplicação: bedtime (22 h, antes de dormir) para adultos em uso de insulina NPH. Antes do café da manhã para adultos em uso de insulinas basais análogas ou pessoas idosas.
- Dose inicial: 10 UI ou 0,1 a 0,2 UI/kg, independentemente do tipo de insulina.
- Titulação: aumentos de 2 UI, conforme a glicemia de jejum (se for administrada bedtime) ou glicemia pré-prandial (se for administrada antes do café da manhã). Deve ser feito um intervalo de pelo menos dois a três dias entre cada ajuste.
Existem evidências de que a titulação da insulina ocorre de maneira subótima na prática [7]. Como muitos pacientes com DM2 têm IMC elevado e a dose de insulina é baseada no peso, é comum a necessidade de doses elevadas de insulina basal. Os dados variam, mas mesmo após uma titulação adequada, mais da metade dos pacientes permanece com HbA1C acima de 7% [8 ,9].
O incremento na dose de insulina basal tem limites. Doses próximas de 0,5 UI/kg indicam uma reavaliação do quadro. Técnica de aplicação e aderência devem ser revistos. Uma opção se doses elevadas de insulina basal não estiverem sendo suficientes é dividir o esquema em mais de uma aplicação ou acrescentar insulina prandial.
Após atingir a meta de glicemia de jejum ou pré-prandial com a titulação da dose de insulina basal, o paciente deve se manter por pelo menos três meses com essa dose e uma nova HbA1C deve ser aferida. Se estiver na meta, o paciente mantém o esquema atual.
Se essa nova HbA1C estiver fora da meta mesmo com as glicemias dentro do alvo, a terapia deve ser intensificada segundo a sessão seguinte.
Como intensificar a terapia insulínica?
Há diferentes recomendações sobre como intensificar a terapia com insulina. O fluxograma 1 expõe a recomendação da ADA. Há outras formas de realizar esse processo, como aquela apresentada no episódio 131 sobre insulinoterapia no DM2.

Segundo a ADA, a progressão da terapia insulínica deve ocorrer da seguinte forma:
- Adicionar uma segunda dose de insulina basal (aplica-se somente aos pacientes com uso de insulina NPH)
- Horário da medicação: usualmente, é administrada uma dose antes do café da manhã e uma antes de deitar. Dose inicial: divide-se 80% da dose total diária de insulina basal em dois terços pela manhã e um terço bedtime.
- Titulação: aumentos de 2 UI, conforme a glicemia de jejum (se a dose for feita em horário bedtime) ou glicemia pré-prandial (se a dose for feita antes do café da manhã). Deve ser feito um intervalo de pelo menos dois a três dias entre cada ajuste.
- Adicionar uma dose de insulina bolus (conhecido como esquema basal-plus)
- Horário da medicação: na refeição mais copiosa; na que antecede a maior glicemia pós-prandial ou na que antecede a maior glicemia pré-prandial.
- Dose inicial: 4 UI ou 10% da dose total de insulina basal.
- Titulação: aumentos de 1 a 2 UI ou 10 a 15% conforme a glicemia pós-prandial que se segue à sua aplicação.
Se a meta de HbA1C não for atingida com os passos anteriores, deve-se realizar a adição gradativa de mais doses de insulinas basais ou bolus seguindo as recomendações prévias. Denomina-se esquema basal-bolus (ou insulinização plena) aquele que conta com insulina basal associada a pelo menos três doses diárias de insulinas bolus.
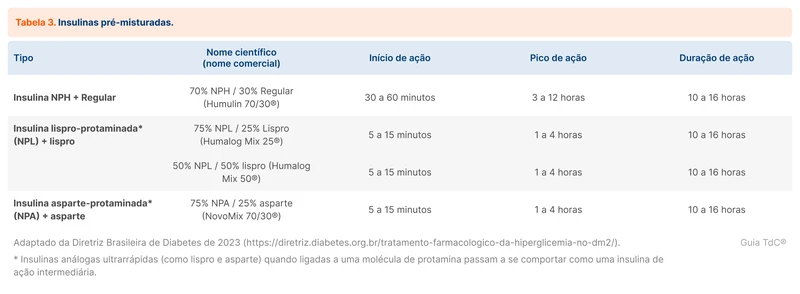
Para diminuir o número de aplicações diárias, há a possibilidade de prescrição de insulinas pré-misturadas (tabela 3). Esse tipo de preparação traz maior comodidade, porém com menor flexibilidade nos ajustes de doses.
Apesar de ser uma conduta que pode variar, a partir do momento em que se utiliza duas doses diárias de insulina (especialmente se ambas forem basais) as sulfonilureias e/ou glinidas são suspensas. A justificativa para a suspensão é a baixa reserva pancreática desses pacientes, levando à redução da efetividade com esses medicamentos. Além disso, a sua associação agrega maiores riscos de hipoglicemia.
O receio de hipoglicemias pode levar o médico a priorizar a titulação das insulinas basais. Contudo, deve-se estar atento ao fenômeno de overbasalization, no qual doses excessivas de insulinas basais se associam a maior dificuldade no controle do diabetes [10]. Os critérios de suspeição de overbasalization são:
- Dose de insulina basal > 0,5 UI/kg/dia
- Diferença entre a glicemia antes de dormir e em jejum > 50 mg/dL
- Variação significativa entre a glicemia pré e pós-prandial
- Hipoglicemias
Pacientes em overbasalization têm mais dificuldade de controle de glicemia, maior risco de hipoglicemias e maior ganho de peso. Opções para correção dessa situação incluem adicionar insulina prandial ou acrescentar outras medicações antidiabéticas que reduzem a dose total de insulina necessária [11].
Conservação, preparo e aplicação
O uso de insulina envolve três processos: conservação, preparo e aplicação propriamente dita. Os conceitos sobre este subtópico estão resumidos no vídeo abaixo.
Conservação [12, 13]:
- As insulinas (ampolas ou canetas) devem ser conservadas sob refrigeração de 2 a 8 °C antes de serem abertas. Essa temperatura geralmente corresponde à encontrada nas prateleiras do meio ou na gaveta de verduras das geladeiras. A insulina deve estar guardada em um recipiente de plástico ou metal e deve-se evitar que a sua embalagem toque as paredes.
- Deve-se evitar armazenar a insulina na porta da geladeira, pois nessa região há maior variabilidade térmica, podendo desnaturar as proteínas.
- Após aberta, a insulina (ampola ou caneta) pode ser mantida sob refrigeração (como descrito acima) ou sob temperatura ambiente, desde que menor que 30 °C. Canetas recarregáveis não devem ser refrigeradas após abertas.
- Em caso de congelamento, a insulina deve ser descartada.
- Em caso de viagens mais longas, as insulinas podem ser transportadas em isolamento térmico (como em bolsas térmicas ou isopor).
Preparo [12, 13]:
- A insulina deve ser retirada da geladeira 15 a 30 minutos antes da sua administração, pois a aplicação do medicamento gelado pode causar dor e irritação cutânea.
- A insulina deve ser homogeneizada antes da aspiração. As ampolas devem ser roladas pelo menos 20 vezes entre as palmas das mãos e as canetas devem ser giradas 180º e voltadas à posição inicial pelo menos 20 vezes.
- No caso de seringas, deve-se aspirar a quantidade de ar correspondente ao número de unidades a serem aplicadas. Em seguida, o frasco é perfurado e o ar injetado no frasco. Por fim, aspira-se a quantidade desejada de insulina.
- As insulinas NPH e regular podem ser aspiradas em uma mesma seringa. Se isso for realizado, deve-se primeiro aspirar a insulina regular e depois a NPH.
- No caso de canetas, deve-se rodar o indicador da caneta conforme a quantidade de unidades a serem aplicadas.
Aplicação [12, 13]:
- Higienizar as mãos com água e sabão ou álcool em gel.
- No caso de uso de seringas, deve-se limpar a borracha do frasco de insulina com álcool a 70%. No caso de canetas, deve-se limpar o sítio de acoplamento com a agulha com álcool a 70%.
- A limpeza do sítio de aplicação da pele com álcool 70% só é recomendada pelo Ministério da Saúde para pessoas institucionalizadas ou em serviços de saúde. Se a limpeza do sítio for realizada, aguardar o álcool secar para prosseguir aos próximos passos.
- No caso de canetas, após atarraxar a agulha, seleciona-se duas unidades de insulina, põe-se a caneta com a agulha voltada para cima e o botão de aplicação é pressionado (tudo isso sem inserir a agulha na pele). Esse procedimento serve para retirar bolhas de ar do circuito e assegurar que a dose injetada será igual à programada.
- Faz-se uma prega cutânea e a agulha é inserida a 90º com a pele. Após aplicada a insulina empurrando o êmbolo da seringa ou pressionando o seletor da caneta, deve-se aguardar de 5 a 10 segundos para retirar a agulha da pele.
- A agulha é desprezada em uma caixa destinada ao descarte de materiais perfurocortantes ou em um emplastro de superfície rígida.
- Após a aplicação, não é recomendada a realização de massagens locais ou colocação de bolsas de gelo ou aquecidas, pois esses métodos podem modificar a absorção do medicamento.
- O sítio de aplicação deverá ser modificado a cada dose. Os sítios recomendados são: barriga, glúteo, coxas e região posterior do braço (figura 3).
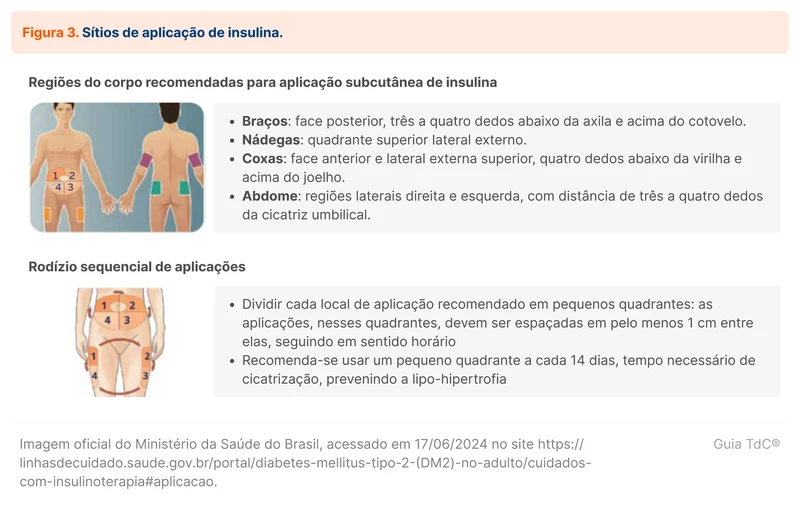
Além da aplicação utilizando seringas ou canetas, as insulinas também podem ser administradas por meio de sistema (ou bomba) de infusão contínua de insulina. Apenas as insulinas análogas ultrarrápidas são utilizadas por esses sistemas. Como podem convenientemente simular a secreção basal e bolus de insulina, os sistemas de infusão são mais comumente utilizados em pacientes com DM1. Evidências mostram que o seu uso em pacientes com DM2 leva a melhor controle glicêmico, menor dose necessária de insulina e maior satisfação. As principais limitações do uso dessa técnica são o custo elevado e a necessidade de treinamento específico de paciente e profissionais de saúde [14].
Monitorização
A forma tradicional de monitoramento da insulinoterapia é por meio da medição da glicemia capilar. Por este método, as insulinas basais são tituladas segundo a glicemia capilar em jejum ou pré-prandiais seguintes à sua aplicação. Já as insulinas bolus serão ajustadas conforme as medidas de glicemias capilares uma a duas horas após a refeição em que foi aplicada (pós-prandial) ou pré-prandiais da refeição seguinte.
Existe variação nas recomendações de qual glicemia deve nortear o ajuste das insulinas. A ADA recomenda ajustar a insulina NPH antes do café da manhã com base na glicemia antes do jantar. Essa é uma recomendação que se aplica quando doses maiores de NPH são feitas pela manhã (dois terços da dose total), especialmente quando a glicemia antes do almoço também está elevada. Quando doses menores são feitas, o ajuste da NPH antes do café da manhã pode ser feito tomando como base a glicemia antes do almoço. O mesmo ocorre com a insulina rápida. Existe a recomendação de ajuste baseado tanto na glicemia pós-prandial como na glicemia pré-prandial da refeição seguinte. Caso a glicemia pré-prandial da refeição seguinte seja utilizada, lanches que o paciente faz entre as refeições maiores (almoço e jantar) podem interferir nos valores, dificultando a interpretação. Caso ocorra muita variabilidade nas aferições, deve-se indagar sobre a ingestão de lanches ao longo do dia.
Os horários mais frequentemente prescritos para a medição da glicemia capilar são:
- Em jejum (imediatamente antes do café da manhã);
- 1 - 2 horas após o café da manhã;
- Imediatamente antes do almoço;
- 1 - 2 horas após o almoço;
- Imediatamente antes do jantar;
- 1 - 2 horas após o jantar;
- Às 22 horas (muitas vezes essa medição coincide com a anterior);
- Às 3 horas da manhã;
- Antes da realização de atividades físicas.
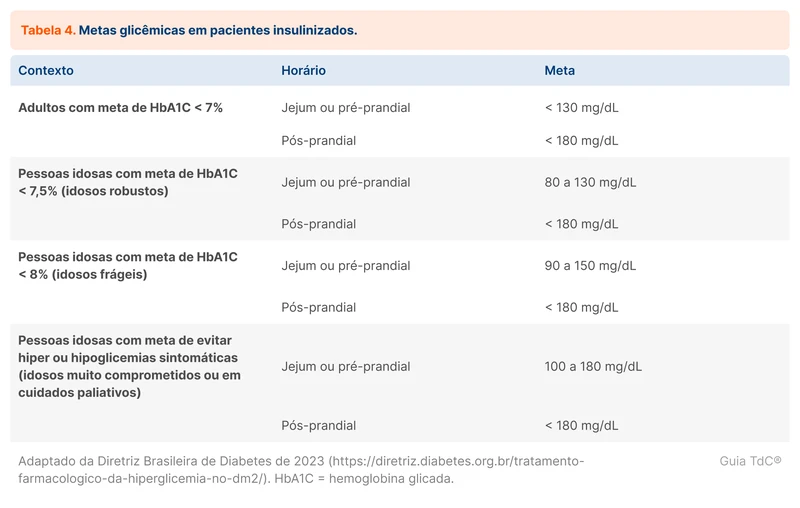
Nem todos os horários de medição de glicemia acima precisam ser realizados por todos os pacientes. Deve-se individualizar o número e horários das medições segundo o planejamento terapêutico. O esquema de insulina basal bedtime só necessita da glicemia de jejum, sendo essa uma praticidade do esquema. As metas de glicemia capilar de acordo com o horário de medição estão dispostas na tabela 4.
Uma alternativa à glicemia capilar é a utilização dos sistemas de monitorização contínua da glicose intersticial ou CGM, do inglês continuous glucose monitoring. Esses dispositivos permitem a verificação da glicemia com maior comodidade e fornecem informações mais detalhadas quanto ao controle glicêmico. Estudos em pessoas com DM2 indicam que o uso dos CGM proporciona um melhor controle glicêmico. A principal limitação é o custo elevado [14]. Veja mais sobre dispositivos de monitorização de glicose no tópico de hipoglicemia na diabetes - diretriz de manejo ambulatorial.
Efeitos adversos
Hipoglicemia
É o principal efeito adverso. O uso de insulinas análogas diminui a ocorrência. Um episódio isolado deve suscitar uma avaliação da causa do quadro. Deve-se procurar por erros posológicos, ingestão associada de outros hipoglicemiantes ou refeições diferentes do habitual. Hipoglicemias recorrentes não explicadas indicam uma redução de 10 a 20% na dose de insulina que antecedeu o evento.
Ganho ponderal
A insulina é anabólica. O ganho ponderal pode ser mitigado com a associação de outros hipoglicemiantes, como metformina, inibidores da SGLT2 ou análogos de GLP1.
Lipodistrofia
A aplicação repetida de insulina no mesmo sítio pode causar atrofia (lipoatrofia) ou hipertrofia (lipohipertrofia) do panículo adiposo local. Além do prejuízo estético, as doses de insulinas aplicadas sobre estes locais terão absorção errática, provocando maior variabilidade glicêmica, hiper ou hipoglicemias.
Aproveite e leia:
Caso Clínico #21
Homem de 48 anos procura o pronto-socorro por diarreia e vômitos há um dia.
Hipoglicemia na Diabetes: Diretriz de Manejo Ambulatorial
A hipoglicemia é um dos principais efeitos adversos no tratamento medicamentoso da diabetes. Em fevereiro de 2024, o Journal of the American Medical Association publicou uma sinopse da diretriz de 2023 da Endocrine Society sobre o manejo de pacientes com diabetes e alto risco de hipoglicemia. Este tópico aborda as principais recomendações desses documentos.
Gliflozinas (inibidores da SGLT2)
As gliflozinas (inibidores da SGLT2) são uma das medicações mais estudadas da última década, com pesquisas mostrando seu benefício em diabetes mellitus tipo 2 (DM2), insuficiência cardíaca e doença renal crônica (DRC). Em maio de 2022, o New England Journal of Medicine (NEJM) lançou uma revisão sobre as gliflozinas no manejo de doenças cardiovasculares e trazemos os principais estudos e indicações aqui.
Semaglutida para Prevenção Cardiovascular Secundária
A semaglutida reduz eventos cardiovasculares em pacientes com diabetes. Será que essa droga é capaz de reduzir esses desfechos em pacientes de alto risco sem diabetes, porém com obesidade ou sobrepeso? Essa foi a pergunta que o estudo SELECT, publicado no New England Journal of Medicine em novembro, tentou responder. Esse tópico revisa o que existe para prevenção secundária e traz os resultados do estudo.
Hidroxicloroquina nas Doenças Reumatológicas
Em janeiro de 2023, o Annals of Internal Medicine publicou uma coorte de pacientes que utilizam hidroxicloroquina cronicamente e avaliou a incidência de retinopatia. Este tópico traz os achados do estudo e revisa as indicações dessa droga nas doenças reumatológicas e seus eventos adversos.
