Doença Arterial Periférica: Diretriz AHA/ACC 2024
Impacto e definições de doença arterial periférica
A prevalência global de doença arterial periférica (DAP) em 2019 era de 1,52%, sendo 42,6% dos pacientes em países de baixa e média renda. A prevalência global foi maior em idosos (80 aos 84 anos) e mulheres [3]. Os pacientes de risco para DAP estão na tabela 1.

DAP está associada com doenças cardiovasculares, pior qualidade de vida, funcionalidade e morte. Um estudo com pacientes com DAP sintomática estratificados por idade e presença de diabetes mellitus (DM) encontrou taxas de mortalidade de 10% em 5 anos para pacientes com menos de 75 anos sem DM e 23% no grupo com menos de 75 anos com DM. Nos pacientes com 75 anos ou mais, com ou sem DM, as taxas de mortalidade foram 52% e 38% respectivamente [4]. Pacientes com DAP sintomática tem o dobro de mortalidade em comparação com pessoas sem DAP e esse risco aumenta conforme a gravidade da obstrução [5].
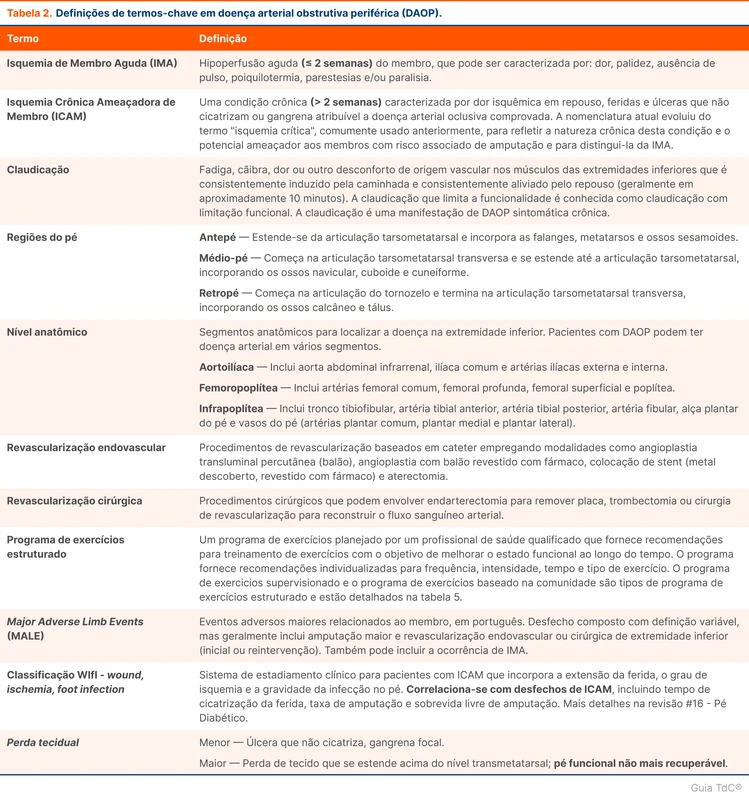
A diretriz traz definições de termos necessários para o desenvolvimento do tema. Uma versão selecionada das definições está na tabela 2.
Subtipos e apresentação clínica
A doença arterial periférica (DAP) pode ser dividida em quatro apresentações/subtipos (tabela 3) [1]:
- DAP assintomática
- DAP sintomática crônica
- Isquemia crônica ameaçadora de membro (ICAM)
- Isquemia de membro aguda (IMA)

A DAP assintomática contém pacientes verdadeiramente assintomáticos, mas também alguns que se adaptam para manterem as atividades abaixo do seu limiar isquêmico para evitar dores nas pernas. Esses pacientes podem ter um pior desempenho funcional e pior qualidade de vida do que os pacientes com claudicação [6, 7].
Já a DAP sintomática crônica manifesta-se classicamente com claudicação intermitente, com dores, cãibras ou sensação de fadiga localizada nas nádegas, coxas, panturrilhas ou pés. Os sintomas iniciam durante a marcha e normalmente são aliviados após cerca de 10 minutos de repouso [8]. Estima-se que apenas um terço dos pacientes com DAP apresentam claudicação típica [9]. A maioria dos pacientes com DAP apresenta outros sintomas ao esforço que não são comumente associados a claudicação, como sensação de fraqueza nas pernas ou fadiga ao caminhar, sem dor [9].
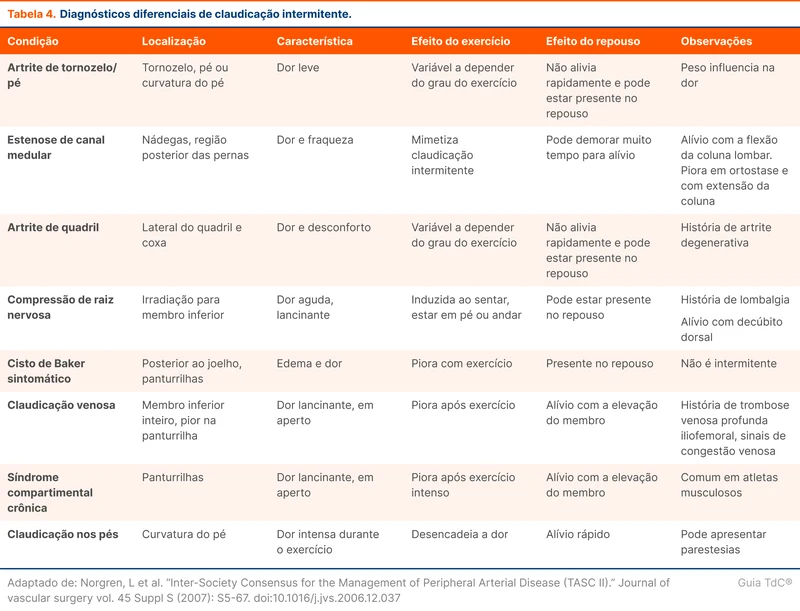
Além de DAP, estenose de canal medular e síndrome compartimental crônica de membros inferiores podem causar claudicação intermitente [10]. Diagnósticos diferenciais de claudicação estão na tabela 4.
A isquemia crônica ameaçadora de membro (ICAM) é caracterizada por dor isquêmica em repouso, úlceras que não cicatrizam ou gangrena em uma ou ambas pernas há pelo menos duas semanas [2, 11]. É responsável pela maioria das amputações não traumáticas maiores e menores de membros em pessoas com DM nos Estados Unidos [12].
A isquemia de membro aguda (IMA) é uma manifestação grave definida como uma diminuição súbita da perfusão do membro que ameaça a sua viabilidade [10]. A hipoperfusão ocorre em até duas semanas e se manifesta com dor, palidez, ausência de pulso, poiquilotermia, parestesias e/ou paralisia [13]. Um estudo randomizado de 2019 encontrou uma incidência de IMA de 1,7% na população com DAP ao longo de 30 meses [14].
Pacientes de risco para DAP (tabela 1) devem ter um exame vascular completo, com foco nos membros inferiores (recomendação forte). Os pulsos dos membros inferiores (artérias femoral, poplítea, tibial posterior e dorsal do pé) são avaliados por palpação e classificados de zero a três (0 - ausente; 1 - diminuído; 2 - normal; 3 - aumentado).
Menor temperatura do membro, presença de úlceras, palidez, presença de sopro (especialmente em artéria femoral) e qualquer alteração na palpação de pulsos aumentam a probabilidade de DAP [15]. Os achados mais úteis são claudicação intermitente e alterações na palpação de pulsos [15]. Por outro lado, a presença dos pulsos tibial posterior e dorsal do pé bilateralmente à palpação está associada a uma baixa probabilidade de DAP [16]. A presença de pulsos periféricos do pé em ambos os membros na ausência de sopros femorais tem valor preditivo negativo de 94,9% para DAP [17].
Diagnóstico de DAP
Em pacientes com fatores de risco, história e exame físico sugestivos, deve-se realizar o índice tornozelo-braquial (ITB) para diagnóstico de DAP (recomendação forte). O ITB é um teste não invasivo usado para diagnóstico inicial de DAP. O valor do ITB em repouso deve ser relatado como alterado (≤ 0,90), limítrofe (0,91-0,99), normal (1,00-1,40) ou não compressível (>1,40) (recomendação forte) [18]. Um ITB ≤ 0,90 tem sensibilidade de 69 a 79% e especificidade de 83 a 99% para o diagnóstico angiográfico de DAP, com redução de sensibilidade em pacientes com DM [18-20].
Em pacientes com ITB ≤ 0,90, o diagnóstico de DAP é confirmado. O ITB após exercício pode ser utilizado após o diagnóstico para avaliar objetivamente o tempo decorrido até ao início dos sintomas, o tipo dos sintomas e o tempo máximo de marcha [1].
O ITB tem limitações, principalmente em pacientes com DM e doença renal crônica (DRC) por menor compressibilidade dos vasos (ITB > 1,40). Nesse cenário, a diretriz recomenda o índice hálux-braquial (IHB) ou índice dedo-braquial, sendo a razão da pressão do hálux dividida pela maior das pressões sistólicas da artéria braquial esquerda e direita (recomendação forte). Para realizar esse índice é necessário um aparelho que perceba o fluxo de sangue nos dedos, como um fotopletismógrafo (mesma tecnologia de um oxímetro de pulso). Um IHB ≤ 0,70 é considerado anormal e permite o diagnóstico de DAP em pacientes com um ITB > 1,40 que tenham história ou exame físico sugestivos de DAP [21, 22].
Quando a suspeita de DAP sintomática crônica persiste mesmo com ITB entre 0,90 e 1,40, a orientação é realizar o ITB após exercício (recomendação forte). O ITB é verificado de um a cinco minutos após o exercício realizado numa esteira. Um estudo retrospectivo mostrou maior sensibilidade do ITB após exercício para o diagnóstico de DAP [23].
A diretriz de 2024 orienta não realizar ITB em pacientes que não sejam de risco para DAP (tabela 1) e que não possuam sintomas ou exame físico sugestivos (ausência de benefício). Por outro lado, pacientes assintomáticos com um ITB alterado (DAP assintomática) têm maior mortalidade por todas as causas e cardiovascular do que pacientes com ITB normal, sendo razoável o rastreio segundo os autores (recomendação moderada) [24, 25].
Usar apenas o ITB pode ser insuficiente para avaliar pessoas com suspeita de ICAM, podendo estar entre 0,70 a 1,40 em 29% dos pacientes [26]. Outro estudo demonstrou que o ITB pode ser de 0,90 a 1,40 em 25% dos pacientes com ICAM [27]. Contudo, essa população pode ter limitações para fazer o ITB após o exercício, que seria o próximo passo quando a suspeita de DAP persiste apesar de um ITB normal. Na suspeita de ICAM com ITB normal (exemplo, úlcera não cicatrizante), o IHB com curva de pulso e outros exames fisiológicos (mensuração de oxigênio transcutâneo [TcPO2], pressão de perfusão de pele) podem ser utilizados (recomendação moderada).
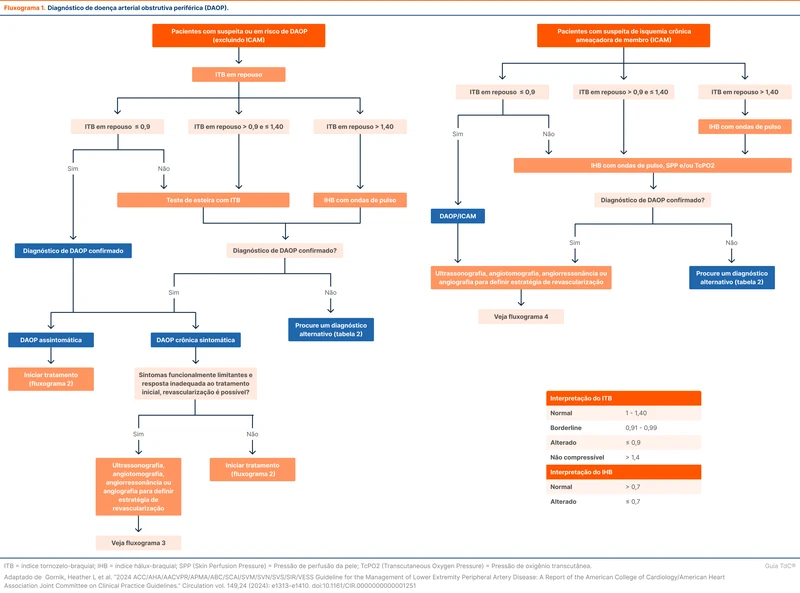
Exames de imagem (ultrassonografia, angiotomografia, angiorressonância ou angiografia por cateter) não são necessários para estabelecer o diagnóstico de DAP na maioria dos pacientes. Podem ser considerados quando existe forte suspeita de DAP e o ITB e demais exames são inconclusivos ou indisponíveis. A melhor indicação dos exames de imagem é em pacientes refratários ao tratamento clínico nos quais a revascularização está sendo considerada (recomendação forte) [1]. Para pacientes com diagnóstico estabelecido e sem perspectiva de revascularização, não há benefício em detalhar a anatomia da DAP com exames de imagem. Veja mais no fluxograma 1.
Terapia com exercício físico estruturado
Os programas de exercício físico estruturados podem ocorrer em dois formatos: programa de exercícios supervisionado e programa de exercícios baseado na comunidade [28]. A evidência de benefício é maior para o programa de exercício físico supervisionado. Detalhes sobre essas modalidades de programa de exercício estão na tabela 5.

Um programa de exercício físico estruturado é indicado para todos os pacientes com DAP sintomática crônica para melhorar o estado funcional, o desempenho da marcha e a qualidade de vida (recomendação forte). O benefício em distância caminhada e qualidade de vida se equipara ao da revascularização [28-31].
O programa de exercício supervisionado foca em exercícios de marcha numa esteira ergométrica intercalados com períodos de repouso quando a dor se torna moderada ou importante. A dificuldade de acesso é um limitador para essa intervenção.
As evidências para os programas de exercícios baseados na comunidade tem crescido e eles também são recomendados para pacientes com DAP sintomática crônica (recomendação forte). Esses programas são autodirigidos com a orientação de profissional de saúde qualificado e geralmente utilizam caminhadas. Estudos mais recentes têm encontrado resultados semelhantes ao exercício estruturado [32, 33].
Tratamento farmacológico
Nos pacientes com DAP crônica sintomática e com ICAM, deve-se iniciar terapia antiplaquetária (recomendação forte). O antiplaquetário em monoterapia reduz o risco de MACE em pacientes com DAP sintomática com ou sem revascularização prévia. A monoterapia com clopidogrel foi mais eficaz que o ácido acetilsalicílico (AAS) na prevenção de MACE no estudo CAPRIE, com taxas de sangramento semelhantes, e uma revisão sistemática recente encontrou um benefício limítrofe dos inibidores da P2Y12 em relação ao AAS [34, 35]. O ticagrelor não foi superior ao clopidogrel na redução de MACE, com taxas semelhantes de eventos adversos [36]. Tanto clopidogrel quanto AAS são apropriados segundo a diretriz (recomendação forte).
O documento pontua que a adição de rivaroxabana 2,5 mg 2x/dia ao AAS para DAP sintomática é eficaz em reduzir eventos cardiovasculares, baseando-se nos dados do estudo COMPASS [37]. Esse estudo testou rivaroxabana 2,5 mg 2x/dia com AAS 100 mg/dia contra AAS 100 mg/dia em monoterapia em pacientes com doença cardiovascular sem alto risco de sangramento e sem indicação de DAPT ou anticoagulação. Houve redução de MACE e MALE com a intervenção. Em análises de subgrupo do COMPASS em pacientes com DAP, também houve redução de MACE e MALE, mas com aumento do risco de sangramento [38]. Não há comparação de rivaroxabana 2,5 mg 2x/dia com aspirina contra clopidogrel e a diretriz não especifica em quais pacientes acrescentar a rivaroxabana. Uma estratégia é avaliar os critérios do estudo COMPASS e o risco individual de sangramento do paciente.
Em pacientes com revascularização cirúrgica ou endovascular de membro inferior recente, a diretriz recomenda rivaroxabana 2,5 mg 2x/dia e aspirina em baixa dose (recomendação forte) com base no trabalho VOYAGER PAD. Este estudo avaliou rivaroxabana 2,5 mg 2x/dia com aspirina contra aspirina e placebo em pacientes com revascularização nos últimos dez dias. A intervenção apresentou uma incidência significativamente menor de isquemia aguda de membros inferiores (maior parte do benefício) e eventos cardiovasculares [39].
Após revascularização endovascular, a DAPT é uma opção (recomendação moderada). Um estudo observacional mostrou benefício principalmente na presença de ICAM e o tempo de manutenção por mais de seis meses reduziu eventos cardiovasculares maiores e eventos adversos maiores nos membros [40, 41]. Quando há indicação de anticoagulação terapêutica por outro motivo (por exemplo, fibrilação atrial) em pacientes com revascularização recente e não há alto risco de sangramento, os autores consideram que acrescentar um antiplaquetário (AAS ou inibidor da P2Y12) ao anticoagulante é razoável (recomendação moderada) [42, 43].
Em pacientes com claudicação, o cilostazol é uma opção para aumentar a distância da caminhada (recomendação forte). A medicação é contraindicada em pacientes com insuficiência cardíaca. Veja mais em "Atualizações no Tratamento de Doença Arterial Obstrutiva Periférica".
Deve-se abordar medidas para redução de risco cardiovascular através do controle de comorbidades e cessação de tabagismo. Veja mais sobre avaliação de risco cardiovascular e medidas de redução de risco em "Avaliação de Risco Cardiovascular: Calculadora PREVENT".
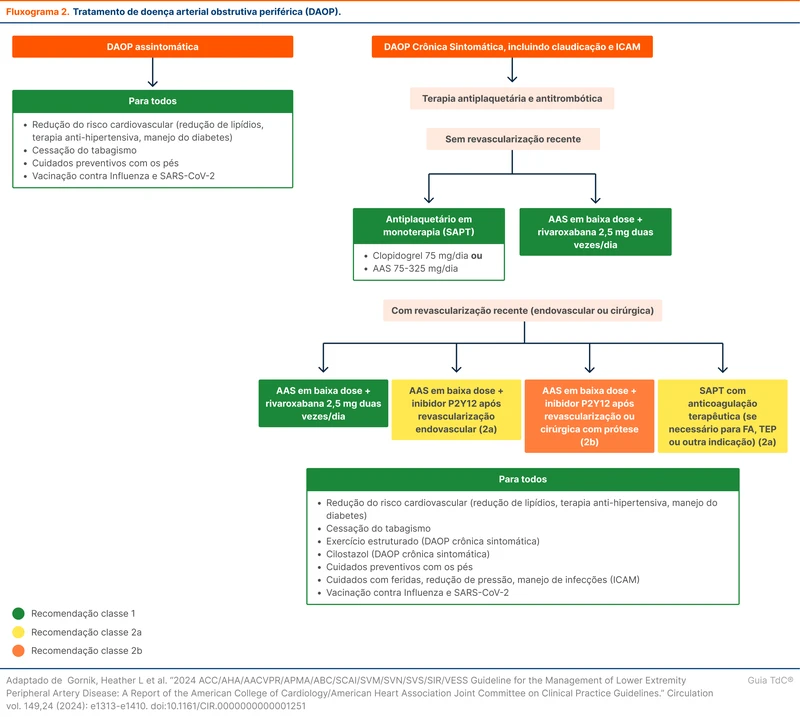
Nos pacientes com DAP assintomática, os autores pontuam que monoterapia antiplaquetária é razoável, porém a evidência não é clara [44, 45]. O cuidado é voltado para o controle de comorbidades, cuidados com os pés e vacinação (veja mais no fluxograma 2).
Revascularização para DAP sintomática crônica e assintomática
A revascularização é indicada para tratar os sintomas de claudicação ou as apresentações mais graves de DAP, como a ICAM e isquemia aguda.
Na DAP crônica sintomática, a revascularização deve ser considerada para pacientes refratários após terapia farmacológica e com exercícios. A intervenção pode ser endovascular, cirúrgica ou híbrida. A técnica será definida conforme a localização da lesão, dividida em três grupos: infrapoplítea isolada, femoral comum e aortoilíaca/femoropoplítea (fluxograma 3). A melhor evidência é para a revascularização endovascular de doença aortoilíaca/femoropoplítea (recomendação forte). Uma ferramenta de apoio a decisão compartilhada de revascularização pode ser acessada aqui.
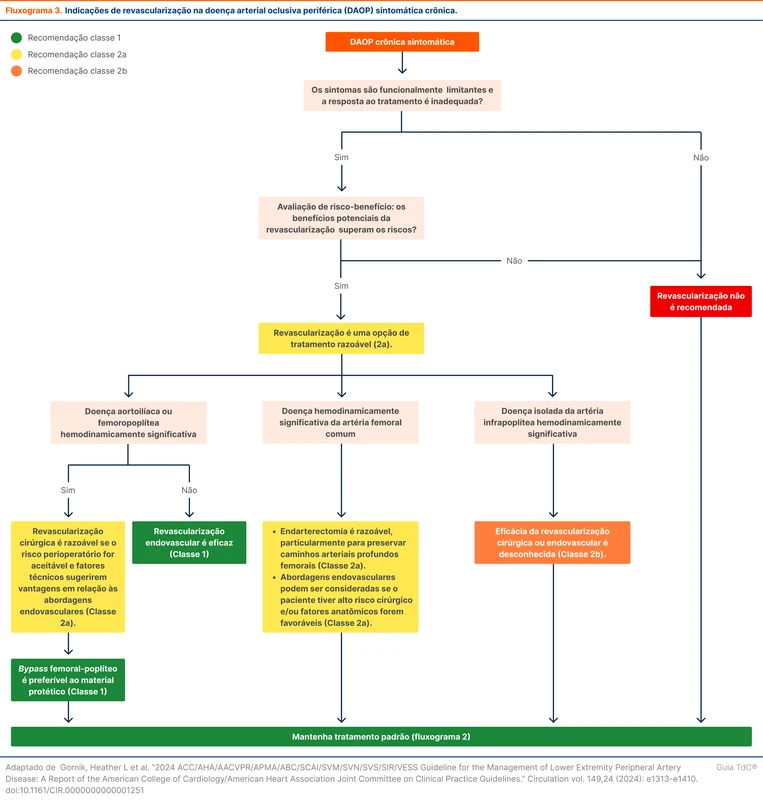
Para pacientes com DAP assintomática, a revascularização é raramente indicada e o aumento de MALE após o procedimento deve sempre ser considerado. A revascularização pode ser útil nos assintomáticos para facilitar algum procedimento que necessite de patência vascular, como implante de valva aórtica percutânea via transfemoral e reparo de aneurisma de aorta via endovascular (recomendação moderada).
Veja mais sobre a revascularização em "Atualizações no Tratamento de Doença Arterial Obstrutiva Periférica".
Abordagem de isquemia crônica ameaçadora de membro
A abordagem multiprofissional é a base do tratamento da ICAM, atuando nos cuidados da cicatrização de feridas e prevenção de amputação.
Recomenda-se o uso de órteses não removíveis (gesso de contato total e sapatos não removíveis) em pacientes com DM por reduzir a pressão plantar, auxiliando na cicatrização de feridas [46]. A eficácia de redução da pressão plantar na ausência de DM é desconhecida, mas a diretriz recomenda cuidados semelhantes. Órteses como CROW (Charcot restraint orthotic walker) podem ser utilizadas na indisponibilidade das não removíveis.
A revascularização é recomendada para pacientes com ICAM, quando possível, para minimizar a perda tecidual, cicatrizar feridas, aliviar a dor e preservar um membro funcional (recomendação forte) (veja mais no fluxograma 4). Pacientes com ICAM que não foram submetidos a revascularização apresentaram 22% de mortalidade por todas as causas e 22% de amputação maior (amputação acima do tornozelo) em 12 meses [47].
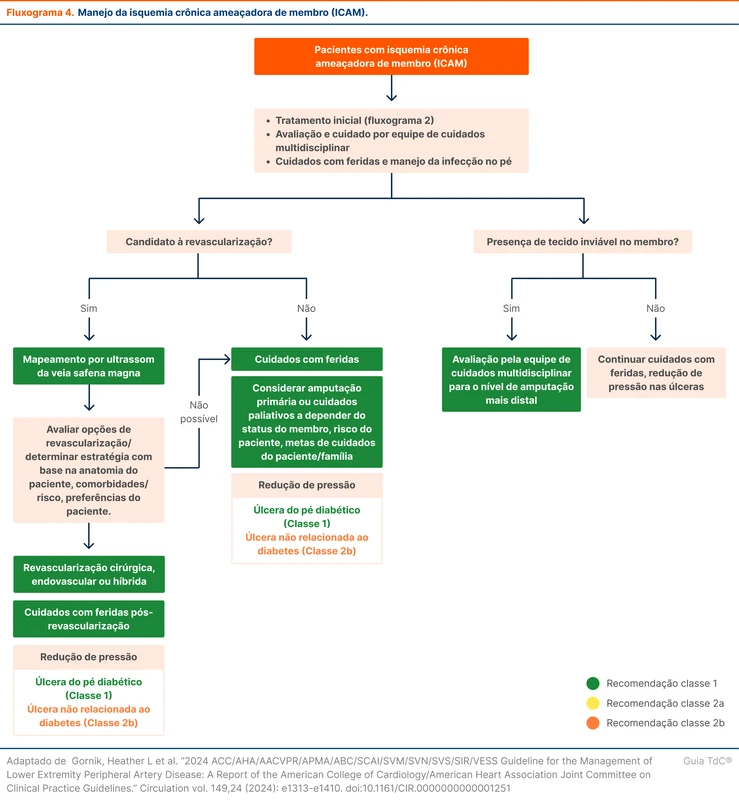
Os exames de imagem vascular são indicados para avaliar o grau de comprometimento e anatomia. Especificamente, a ultrassonografia deve ser feita para avaliar a veia safena magna (recomendação forte). A técnica da revascularização - endovascular, cirúrgica ou híbrida - é definida a partir da anatomia, comorbidades e preferências do paciente.
O estudo BEST-CLI comparou a revascularização endovascular com a cirúrgica em pacientes com ICAM por DAP infrainguinal. Houve melhores resultados para cirurgia aberta quando a veia safena magna foi utilizada, porém sem diferença entre abordagem cirúrgica e endovascular quando outras veias foram usadas como enxerto vascular [48]. Já o estudo BASIL-2 comparou a revascularização endovascular com a cirúrgica em pacientes com ICAM por DAP infrapoplítea, com ou sem acometimento infrainguinal. Nesse trabalho, a revascularização cirúrgica apresentou maior taxa de amputação maior e morte quando comparada com a técnica endovascular [49]. As diferenças de resultados entre os dois estudos podem refletir diferenças clínicas (maior risco cardiovascular favorece abordagem endovascular), de estadiamento e anatômicas. A diretriz de 2019 de ICAM publicada no Journal of Vascular Surgery orienta integrar o risco cardiovascular do paciente, a gravidade do acometimento do membro pela classificação WIfI e a anatomia com a classificação GLASS [50]. Veja mais em "Atualizações no Tratamento de Doença Arterial Obstrutiva Periférica" e sobre a classificação WIfI na revisão "Pé Diabético".
Quando as lesões são superficiais e sem infecção, a revascularização oportuna possibilita a recuperação tecidual sem necessidade de amputação. Em perdas teciduais mais extensas ou com infecções profundas, debridamento com amputação óssea pode ser necessária. Não existe evidência de ensaios clínicos randomizados para guiar a escolha do nível de amputação. Essa decisão deve ser individualizada e a classificação WiFI pode ajudar. Para mais informações, veja a revisão sobre "Pé Diabético".
Existem situações em que a amputação deve ser feita de emergência. Isso inclui pacientes com infecção extensa de partes moles com sepse em que amputação é necessária para controle de foco ou quando há necrose tecidual extensa levando a desarranjo metabólico ameaçador a vida.
Abordagem de isquemia de membro aguda (IMA)
Pacientes com IMA devem ser avaliados de emergência (recomendação forte). A IMA pode ser decorrente de trombose local, embolização, estado de hipercoagulabilidade e trauma (veja outras causas na tabela 6). O tempo de manifestação depende da causa de base.
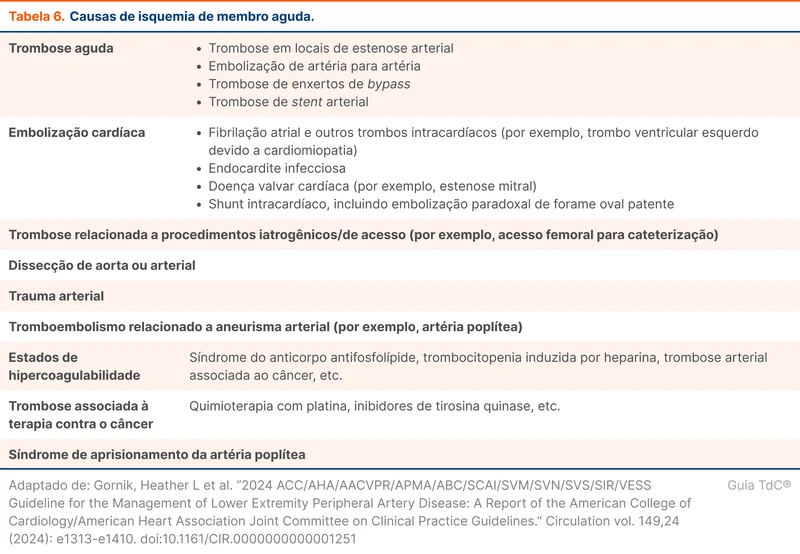
A classificação de Rutherford é usada para definir a gravidade da apresentação da IMA. A diretriz recomenda avaliar perda sensorial, força muscular e doppler arterial e venoso para definir a abordagem (fluxograma 5) [51].
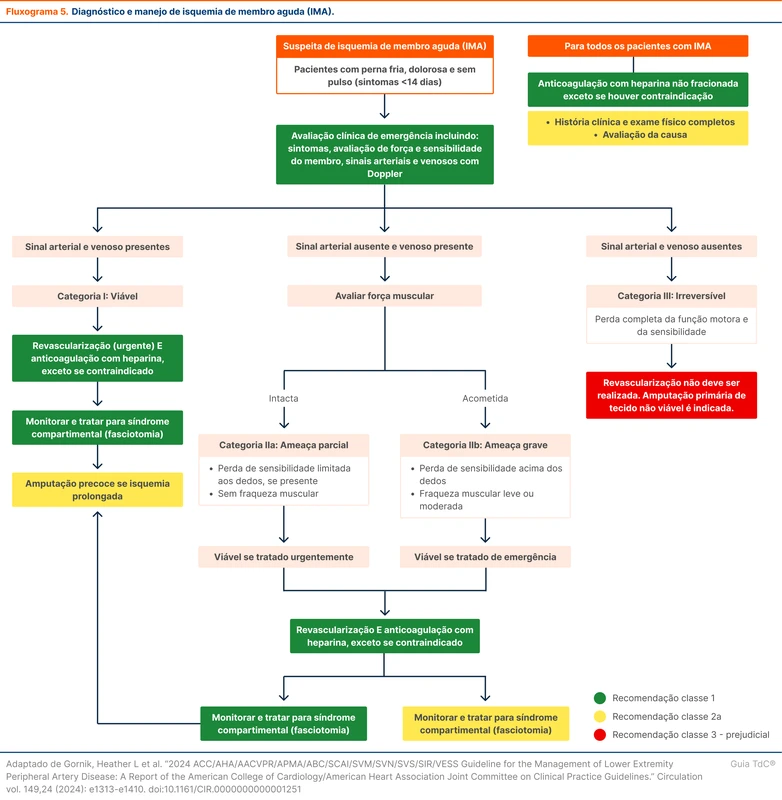
Na suspeita de IMA, a avaliação de viabilidade e potencial de salvamento do membro pode ser feita sem exames de imagem não invasivos (recomendação forte). O Doppler é um ponto-chave nessa avaliação. A ausência de fluxo arterial e venoso no Doppler indica que o membro pode estar irreversivelmente comprometido e potencialmente não pode ser salvo. Em pacientes com procedimentos prévios ou quando um exame de imagem pode mudar a abordagem (ex.: suspeita de dissecção de aorta), os exames de imagem podem ser necessários.
Em pacientes com membro viável, a revascularização está indicada para prevenir amputação (recomendação forte). Tromboembolectomia cirúrgica ou trombólise guiada por cateter são opções. Independente da causa e do nível da oclusão, a anticoagulação com heparina não fracionada deve ser iniciada no momento do diagnóstico de IMA (recomendação forte). Todos os pacientes devem ser monitorados para o desenvolvimento de síndrome compartimental (recomendação forte). Veja o diagnóstico e conduta no fluxograma 5.
Aproveite e leia:
Diretriz de Doenças da Aorta - ESC 2024
A European Society of Cardiology (ESC) publicou em 30 de agosto de 2024 a nova diretriz de doenças da aorta e doenças arteriais periféricas. A doença arterial periférica foi abordada em "Doença Arterial Periférica: Diretriz AHA/ACC 2024". Este tópico é baseado na nova diretriz e revisa o diagnóstico, rastreio, tratamento e atualizações sobre aneurismas de aorta.
Avaliação de Risco Cardiovascular: Calculadora PREVENT
Existem várias formas de estimar o risco cardiovascular para determinar estratégias de prevenção. Em 2024, a American Heart Association (AHA) lançou a PREVENT, uma nova calculadora de risco de eventos cardiovasculares. Este tópico revisa o assunto e traz as novidades sobre a ferramenta.
Atualizações no Tratamento de Doença Arterial Obstrutiva Periférica
Em novembro deste ano, o New England Journal of Medicine publicou o artigo BEST-CLI comparando as estratégias de revascularização na doença arterial obstrutiva periférica (DAOP). Vamos ver o que essa nova evidência acrescentou e revisar o tópico.
Abordagem do Paciente com Ataque Isquêmico Transitório
Entre 7,5 a 17,4% dos pacientes com ataque isquêmico transitório (AIT) evoluem com acidente vascular cerebral isquêmico (AVCi) em 3 meses. Em metade dos casos, o novo evento acontece nas primeiras 48 horas após o AIT. Nessa revisão do mês, trazemos os principais pontos da abordagem e tratamento dos pacientes com AIT.
Pé Diabético
O pé diabético é a destruição, ulceração ou infecção do pé de pacientes com diabetes. Essa condição está diretamente associada à neuropatia periférica e a doença vascular periférica. Esta revisão aborda a classificação, diagnóstico e tratamento das complicações associadas ao pé diabético com base em uma revisão publicada em 2023 no Journal of the American Medical Association e na diretriz de pé diabético infectado da International Working Group on the Diabetic Foot (IWGDF).
