Diagnóstico e Manejo de Nefrite Lúpica
A nefrite lúpica é uma manifestação grave do lúpus eritematoso sistêmico, acometendo até 50% dos pacientes e evoluindo para doença renal crônica em até 30% dos casos em 15 anos. Em junho de 2024, foi publicado o II consenso da Sociedade Brasileira de Reumatologia para o diagnóstico e manejo da nefrite lúpica [1]. O tópico “Diagnóstico e Manejo de Nefrite Lúpica” aborda os principais pontos do consenso.
Definição, diagnóstico e alvo de tratamento
Nefrite lúpica é definida pela presença de proteinúria persistente (mais que 0,5 g/24 h ou relação proteinúria/creatininúria maior que 0,5) e/ou sedimento urinário ativo (hematúria, leucocitúria ou cilindros urinários) na ausência de outras explicações em pacientes com lúpus eritematoso sistêmico (LES). A condição também pode ser definida de forma histopatológica através da biópsia renal.
Todo paciente diagnosticado com LES deve realizar dosagens de creatinina e exames urinários (sedimento urinário/urina 1 e proteinúria), mesmo que assintomático. A periodicidade dessa avaliação deve ser individualizada.

O padrão-ouro para o diagnóstico da nefrite lúpica é a biópsia renal. Ela define a classe histológica (tabela 1), identifica parâmetros de atividade e cronicidade, auxilia na decisão terapêutica e avalia diagnósticos diferenciais. A biópsia é indicada na presença de alguma das alterações abaixo:
- Proteinúria maior que 500 mg/24 h ou proteinúria/creatininúria (P/C) maior que 0,5 (em amostra isolada ou em 24 horas)
- Alteração da função renal de etiologia desconhecida
- Presença de hematúria de origem glomerular presumida associada a proteinúria, mesmo que menor que 500 mg/24 h
- Avaliação de diagnósticos diferenciais, como hipertensão, diabetes, microangiopatias trombóticas e podocitopatias
A biópsia renal não deve atrasar o início da imunossupressão quando clinicamente indicada. Nas situações onde a biópsia não está disponível, a utilização de uma calculadora desenvolvida no Brasil pode auxiliar na diferenciação clínica entre as classes III/IV e a classe V, o que traz impacto na conduta terapêutica.
O objetivo do tratamento é uma resposta renal, definida no consenso como:
- Melhora ou manutenção da função renal (variação de 10% para mais ou para menos em relação ao início do tratamento) E
- Redução da proteinúria de 24 horas ou P/C em urina de 24 horas de 25% em 3 meses, 50% em 6 meses e um valor de proteinúria < 0,8 g/24 h em 12 meses. Nos pacientes com proteinúria nefrótica no início do tratamento, pode ser acrescido um tempo de 6 a 12 meses para a resposta renal.
Tratamento das classes III ou IV
O tratamento é dividido em terapia de indução e manutenção (fluxograma 1). A duração do tratamento é variável, mas no geral é realizado por 3 a 6 meses na fase de indução e 3 a 5 anos na fase de manutenção. Em pacientes com resposta incompleta, múltiplas recaídas prévias ou maior dano renal, um tratamento mais prolongado pode ser indicado.
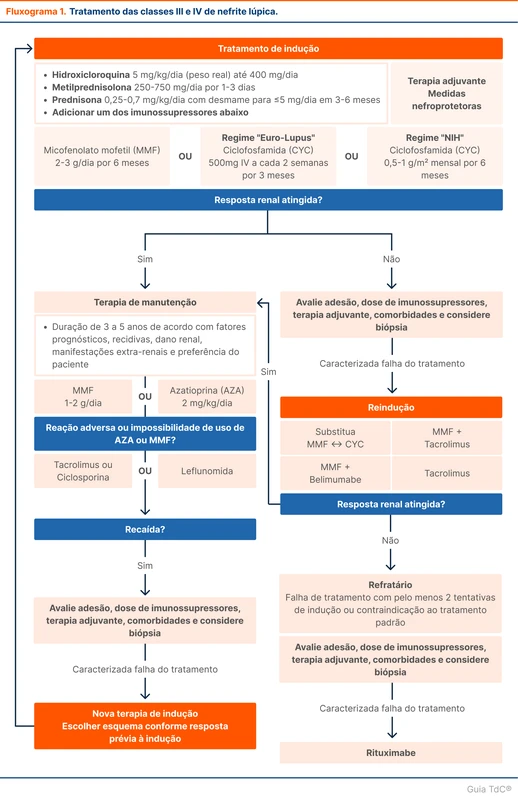
Indução
A terapia de indução consiste na combinação de pulsoterapia com metilprednisolona na dose de 250 a 750 mg por 1 a 3 dias associada a uma segunda droga imunossupressora, como micofenolato mofetil ou ciclofosfamida intravenosa. Após a pulsoterapia com corticoide, é iniciado prednisona na dose de 0,25 a 0,7 mg/kg/dia com desmame gradual para doses menores que 5 mg em 3 a 6 meses. A hidroxicloroquina também deve ser iniciada nessa etapa e mantida durante todo o tratamento. Veja mais em "Hidroxicloroquina nas Doenças Reumatológicas".
Tanto micofenolato quanto ciclofosfamida podem ser utilizados, com a decisão sendo baseada no perfil de efeitos adversos e na disponibilidade das medicações. Se o paciente não apresentar uma resposta renal adequada, o consenso sugere uma nova tentativa de indução, utilizando outro agente indutor. Ou seja, caso o paciente tenha utilizado micofenolato, é sugerida a mudança para ciclofosfamida.
Outra opção sugerida para os casos que não tiveram resposta é a combinação de terapias, como micofenolato e tacrolimus ou micofenolato e belimumabe. O tacrolimus é preferível se há impossibilidade de uso de ciclofosfamida ou intolerância a maiores doses de micofenolato. O tacrolimus não é recomendado se o paciente possui sinais de microangiopatia trombótica ou creatinina sérica maior que 3 mg/dL. Já o belimumabe é uma opção se há dificuldade no desmame do corticoide, alto risco de progressão para doença renal crônica, alto risco de relapso ou manifestações extra-renais. Não é uma droga amplamente disponível no Brasil.
Caso o paciente ainda não apresente resposta, tendo o diagnóstico confirmado e adesão adequada, a nefrite lúpica é caracterizada como refratária. Nesses casos, o rituximabe está indicado.
Manutenção
A terapia de manutenção é baseada na combinação de hidroxicloroquina associada a MMF ou azatioprina. Se o paciente realizar a indução com MMF, a preferência é continuar a droga também na manutenção. Por outro lado, a azatioprina pode ser utilizada durante a gestação e tem melhor posologia e menos efeitos gastrointestinais. Se houver intolerância ou contraindicações ao uso de MMF ou azatioprina, outras medicações podem ser utilizadas, como inibidores da calcineurina (tacrolimus ou ciclosporina) ou leflunomida.
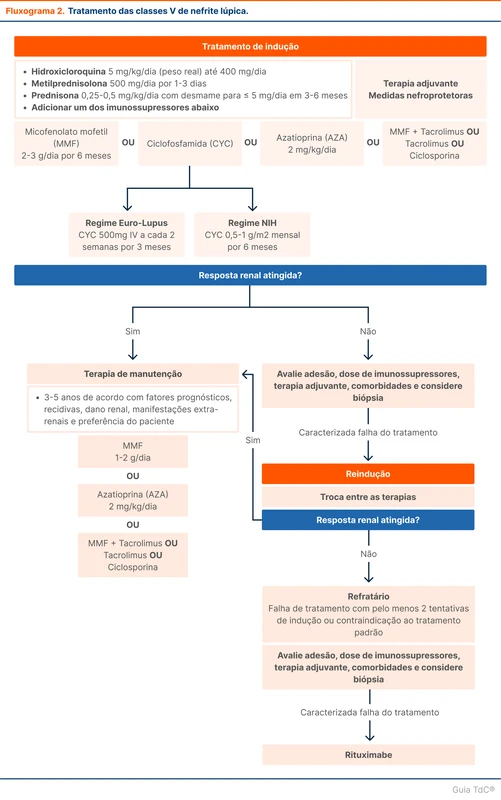
Tratamento da classe V
O tratamento da classe V também envolve etapas de indução e manutenção. A indução é feita com hidroxicloroquina e pulsoterapia com corticoide associado a outro imunossupressor. A manutenção é realizada com hidroxicloroquina associada a azatioprina, micofenolato ou inibidores da calcineurina. Medidas nefroprotetoras, como controle da pressão arterial e drogas antiproteinúricas, têm importância adicional nesses pacientes (fluxograma 2).
Comparação com outras diretrizes
A European Alliance of Associations for Rheumatology (EULAR) e o Kidney Disease Improving Global Outcomes (KDIGO), ambos em 2024, disponibilizaram suas diretrizes para o manejo de LES e nefrite lúpica [2, 3]. As diretrizes têm recomendações semelhantes, mas existem algumas diferenças em relação ao consenso brasileiro. No EULAR e KDIGO, o alvo do tratamento para a proteinúria após 12 meses é um valor menor que 0,5 a 0,7 g/24 h, diferindo do menor que 0,8 g/24 h do consenso brasileiro. Essa diferença se deve ao fato do consenso brasileiro ter utilizado também um estudo nacional para a definição do corte de proteinúria.
Outra diferença é a indicação de belimumabe, tacrolimus ou voclosporina como opções de primeira linha nas diretrizes internacionais, enquanto o consenso brasileiro limita essas opções terapêuticas para casos de falha. O consenso nacional tomou essa decisão para se adaptar à realidade brasileira, considerando a baixa disponibilidade dessas medicações.
Aproveite e leia:
Hidroxicloroquina nas Doenças Reumatológicas
Em janeiro de 2023, o Annals of Internal Medicine publicou uma coorte de pacientes que utilizam hidroxicloroquina cronicamente e avaliou a incidência de retinopatia. Este tópico traz os achados do estudo e revisa as indicações dessa droga nas doenças reumatológicas e seus eventos adversos.
Controle de Glicemia no Paciente Internado
Hiperglicemia hospitalar está associado a piores desfechos e maior risco de complicações. Em julho de 2024, a Sociedade Brasileira de Diabetes (SBD) publicou uma diretriz com recomendações práticas sobre hiperglicemia em pacientes não críticos no hospital. A Society of Critical Care Medicine (SCCM) também trouxe atualizações sobre metas e indicações do controle glicêmico no paciente crítico. Este tópico aborda o controle de glicemia no paciente internado.
Prevenção de Pneumonia Hospitalar
A prevenção de pneumonia associada à ventilação (PAV) é rotina nas UTI. A Society for Healthcare Epidemiology of America (SHEA) publicou em março de 2022 uma atualização nas recomendações de prevenção de PAV, modificando pontos polêmicos. Vamos discutir as recomendações em 3 grupos: descontaminação, manutenção do circuito de ventilação e medidas para diminuir ou evitar intubação. A lista completa de recomendações está em anexo.
AVC Isquêmico Maligno
AVCi maligno é uma doença grave com até 78% de mortalidade. O tratamento é semelhante aos outros tipos de AVCi, com poucas condutas específicas que mudem seu desfecho. Em 07 de abril foi publicado um artigo original no New England Journal of Medicine sobre terapia endovascular em AVCi maligno. Vamos aproveitar para revisar esse tópico e avaliar o que essa nova evidência acrescenta na prática.
Fibromialgia: Como Diagnosticar
Fibromialgia é uma síndrome dolorosa crônica e não inflamatória associada à fadiga, sono não reparador, transtornos psiquiátricos e dificuldades cognitivas. O diagnóstico é clínico e não há biomarcadores específicos nem exames complementares padrão-ouro. Este tópico revisa o diagnóstico da doença.
