Ácido Acetilsalicílico (AAS) no Perioperatório
O Guia já abordou o manejo de algumas medicações no perioperatório em "Manejo Medicamentoso no Perioperatório" e especificamente de anticoagulação no perioperatório em "Anticoagulação no Perioperatório".
O artigo ASSURE-DES, publicado no Journal of the American College of Cardiology (JACC) em agosto de 2024, avaliou a suspensão ou manutenção do ácido acetilsalicílico como prevenção secundária no perioperatório [1]. Este tópico aborda o ácido acetilsalicílico no perioperatório e os resultados do estudo.
Uso de ácido acetilsalicílico no perioperatório: recomendação das diretrizes
A decisão de manter ou suspender o ácido acetilsalicílico (AAS) no perioperatório deve considerar os riscos de eventos tromboembólicos e de sangramento. Vários trabalhos, incluindo o POISE-2, mostram que o uso do AAS aumenta a probabilidade de sangramentos nesse período (risco absoluto 1.2%; p < 0.05) [2]. Por outro lado, estudos observacionais evidenciam uma alta incidência de MACE após cirurgias, incluindo trombose de stent, com cerca de 2% a 8% de eventos em pacientes com angioplastia prévia [3-5]. Os fatores de risco para MACE após a cirurgia não cardíaca estão disponíveis na tabela 1.
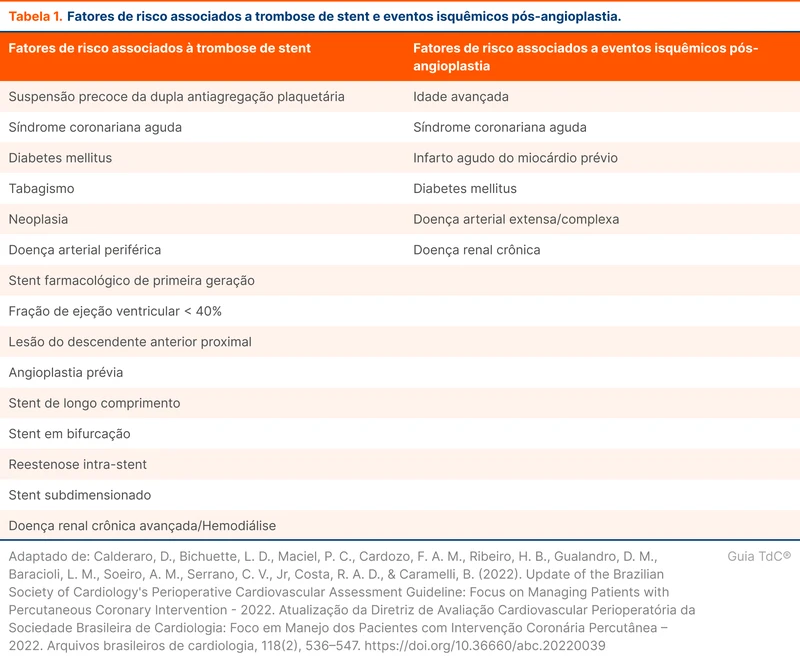
O primeiro ponto a ser considerado é o motivo do uso do AAS pelo paciente: prevenção primária ou secundária. Em pacientes que usam AAS para prevenção primária, o risco de eventos isquêmicos é habitualmente baixo. Nesses casos, a diretriz de 2022 da European Society of Cardiology (ESC) recomenda a suspensão da medicação antes de cirurgia não cardíaca [6].
Quando o AAS é utilizado para prevenção secundária, de uma maneira geral a orientação é manter a medicação. Como muitos desses pacientes estão em uso de dupla antiagregação plaquetária (DAPT), a dúvida maior está em o que fazer com o segundo antiplaquetário. A decisão depende se houve intervenção coronariana percutânea (angioplastia) e/ou síndrome coronariana aguda (SCA), além do tempo em que esses eventos ocorreram.
Em pacientes com DAPT após angioplastia, a ESC recomenda adiar cirurgias não cardíacas eletivas até seis meses após a angioplastia por doença coronariana crônica e 12 meses após uma SCA (classe IA - recomendação forte com alto nível de evidência). A Sociedade Brasileira de Cardiologia (SBC) também recomenda o uso de DAPT por 12 meses após a angioplastia, principalmente em pacientes que realizaram angioplastia por SCA. O intervalo pode ser reduzido para seis meses e, excepcionalmente, um mês em caso de procedimentos urgentes ou sensíveis ao tempo [7]. Estudos recentes indicaram que a redução da duração da DAPT para um a três meses após intervenção coronariana com stent farmacológico está associada a taxas aceitáveis de MACE e trombose de stent em pacientes de risco cardiovascular baixo e moderado [8].
A nova diretriz do American College of Cardiologists (ACC/AHA) sobre o manejo perioperatório em cirurgias não cardíacas foi publicado em setembro de 2024 e reitera as recomendações acima [9]:
- Adiar a cirurgia em um ano para pacientes que realizaram angioplastia após SCA (recomendação forte, nível de evidência moderado);
- Adiar a cirurgia em seis meses para pacientes que realizaram angioplastia por doença coronariana crônica (recomendação moderada, nível de evidência moderado);
- Considerar o adiamento da cirurgia em três meses, se o risco de adiar a cirurgia é maior que o risco de MACE (recomendação moderada, nível de evidência moderado)
- Em pacientes com angioplastia há menos de um mês, não realizar cirurgias eletivas (recomendação forte, nível de evidência moderado)
Quando os pacientes estão no período de DAPT e a cirurgia não pode ser adiada, as diretrizes da ESC e da SBC recomendam manter o AAS na dose de 100 mg/dia durante todo o perioperatório e suspender o segundo antiplaquetário. Uma novidade das novas diretrizes da ACC/AHA de 2024 é que, para pacientes com menos de três meses após colocação de stent farmacológico, o recomendado é manter a DAPT a não ser que o risco de sangramento seja considerado maior que o de trombose do stent (recomendação forte, nível de evidência moderado).
Uma exceção são neurocirurgias ou procedimentos de alto risco de sangramento (veja tabela 2), em que o AAS também deve ser suspenso sete dias antes da cirurgia [6]. Após o procedimento, a terapia antiplaquetária deve ser reiniciada em até 48 horas (recomendação forte, nível de evidência fraco).
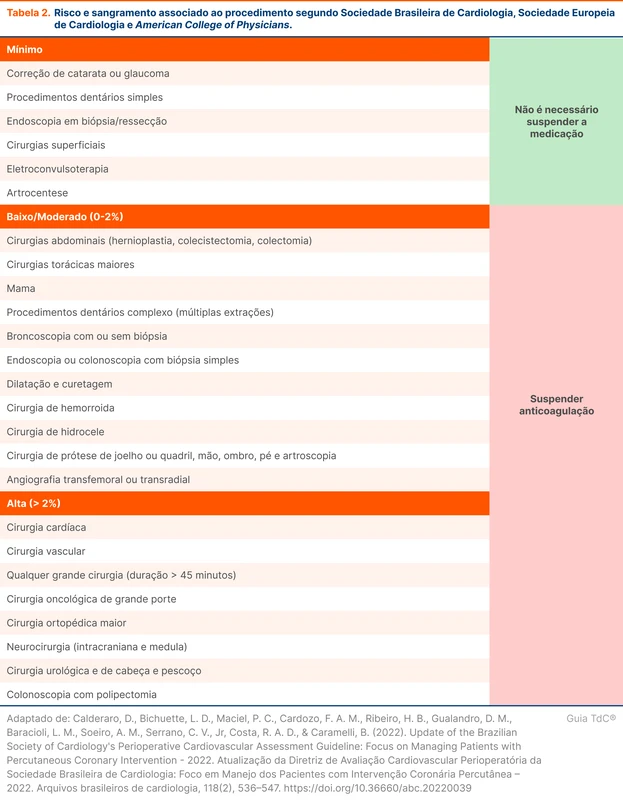
O fluxograma 1 resume as orientações da ESC de manejo do inibidor da P2Y12 no perioperatório de cirurgias não cardíacas.
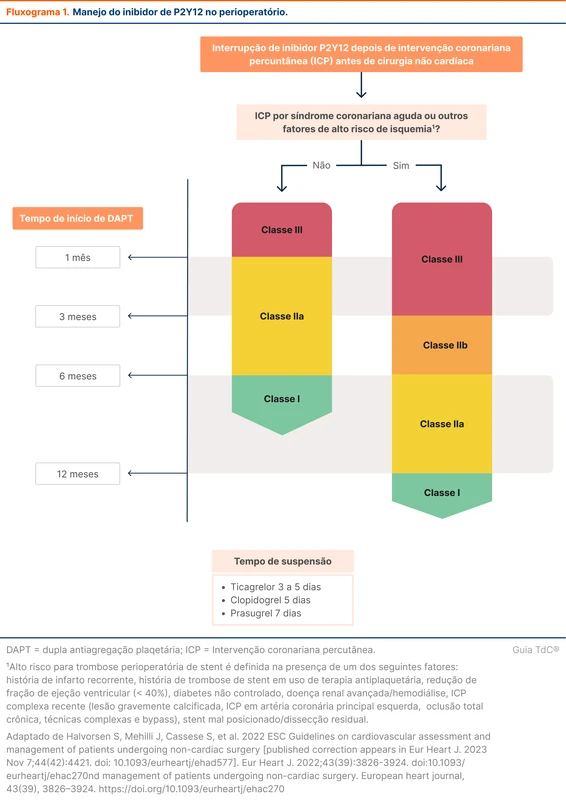
Em pacientes com aspirina em monoterapia com um ano após o evento, as diretrizes recomendam manter a medicação. Existia incerteza sobre a robustez dessa recomendação, considerando alguns estudos observacionais que não viram aumento de eventos com a suspensão [10-12]. Nesse contexto foi realizado o estudo ASSURE-DES.
O estudo ASSURE-DES
O ASSURE DES foi um ensaio clínico randomizado, não cego, realizado na Coreia, Índia e Turquia. Os pesquisadores compararam a manutenção de AAS 100 mg/dia em monoterapia com a suspensão do AAS e demais antiplaquetários antes de uma cirurgia não cardíaca. Os pacientes tinham doença arterial coronariana com stent farmacológico realizado há mais de um ano antes do procedimento cirúrgico.
O critério de inclusão continha angioplastia com pelo menos um stent farmacológico há mais de um ano e proposta de cirurgia eletiva não cardíaca. Alguns critérios de exclusão foram fração de ejeção menor ou igual a 30% ou doença valvar, necessidade de anticoagulação ou risco muito alto de sangramento (tabela 1). O desfecho primário avaliado foi um composto de morte por todas as causas, infarto, trombose de stent ou AVC entre cinco dias antes e 30 dias após a cirurgia. A suspensão do AAS ocorreu cinco dias antes da cirurgia. A terapia antiplaquetária foi reiniciada em até 48 horas após a cirurgia na ausência de contraindicação.
Após randomização, permaneceram 926 pacientes ao total (462 pessoas no grupo manutenção e 464 no grupo suspensão do AAS). As cirurgias mais comuns foram abdominais (39%), ortopédicas (23%) e urológica ou ginecológica (18%). A maioria das cirurgias foi classificada como de baixo a intermediário risco cardiovascular e de sangramentos. A média de tempo de angioplastia até a cirurgia foi de 5,1 anos.
O desfecho primário ocorreu em três pacientes (0,6%) no grupo manutenção e em quatro pacientes (0,9%) no grupo suspensão (diferença absoluta -0,2%; IC 95% -1,3 a 0,9; p > 0,99). Não houve trombose de stent em nenhum dos grupos. A incidência de sangramento maior não teve diferença significativa entre os grupos (6,5% vs. 5,2%; p= 0,39), enquanto o sangramento menor foi mais frequente no grupo do AAS (14,9% vs. 10,1%; p = 0,027).
O baixo número de eventos cardiovasculares associado ou não ao uso do AAS pode estar relacionado à era moderna das angioplastias, como evidenciado em alguns trabalhos mais recentes [13]. O uso de stents farmacológicos de novas gerações contribui para uma maior segurança ao paciente.
A baixa incidência dos eventos pode ser um reflexo do risco cardiovascular relativamente não tão elevado da população estudada. Além disso, não houve uma monitorização de troponina no pós-operatório, não sendo possível identificar injúria miocárdica não isquêmica, um desfecho que se associa a pior prognóstico e que já foi abordado com terapia antitrombótica [14]. Por fim, a maior parte dos pacientes realizaram cirurgias de baixo a intermediário risco cardiovascular e o tipo de procedimento é um dos principais fatores para o prognóstico de eventos isquêmicos ou de sangramento[15].
O estudo atesta os avanços e a segurança das angioplastias com stents farmacológicos atuais. O baixo número de eventos e o baixo risco dos procedimentos limita o impacto dos resultados. É possível que as diretrizes mantenham a recomendação atual, sendo necessário ponderar riscos individuais do paciente e do procedimento, além do tempo após a angioplastia.
Aproveite e leia:
Novo Paradigma de Infarto: Oclusão Coronariana Aguda
Uma nova classificação propõe distinguir o infarto agudo do miocárdio conforme a presença ou ausência de oclusão coronariana, em contraste com a abordagem tradicional baseada no supradesnivelamento do segmento ST. Duas publicações recentes reforçam essa proposta. Este tópico explora essa nova perspectiva.
Nova Diretriz de Perioperatório da AHA: Risco Cardiovascular
O American College of Cardiology/American Heart Association Joint Committee publicou uma diretriz de manejo cardiovascular no perioperatório de cirurgias não cardíacas em setembro de 2024. Essa publicação atualizou a diretriz de 2014. Este tópico aborda os principais pontos da nova diretriz.
Anticoagulação no Perioperatório
O manejo de anticoagulantes no perioperatório gera muitas dúvidas. Em abril de 2023, o American College of Physicians publicou uma revisão sobre o tema. Vamos aproveitar para revisitar algumas recomendações importantes.
Manejo Medicamentoso no Perioperatório
Em agosto de 2022, ocorreu o congresso da European Society of Cardiology (ESC) e foi apresentada a nova Diretriz de Avaliação Perioperatória para cirurgias não cardíacas. Vamos aproveitar para revisar o manejo medicamentoso no perioperatório e comentar as principais atualizações.
Atualizações no Tratamento de Doença Arterial Obstrutiva Periférica
Em novembro deste ano, o New England Journal of Medicine publicou o artigo BEST-CLI comparando as estratégias de revascularização na doença arterial obstrutiva periférica (DAOP). Vamos ver o que essa nova evidência acrescentou e revisar o tópico.
