Caso Clínico #4
O caso clínico abaixo é apresentado em partes. O negrito é a descrição do caso, as partes que não estão em negrito são os comentários. Ao final, você encontrará a resolução e os pontos de aprendizagem resumidos.
Uma mulher de 61 anos é levada para a sala vermelha do hospital por dispneia e fraqueza.
A paciente queixa-se de fadiga, palpitações, dispneia e fraqueza global iniciados no dia anterior, enquanto realizava exercícios. Os sintomas haviam melhorado após repousar, mas retornaram no final do dia e pioraram até a chegada ao hospital.
O exame físico mostra um tempo de enchimento capilar lentificado, frequência cardíaca de 120 bpm, pressão arterial de 108/66 mmHg, frequência respiratória de 30 irpm, saturação de oxigênio de 88% em ar ambiente, turgência jugular patológica e estertores pulmonares em bases.
A paciente está em choque circulatório. Essa síndrome ocorre quando há hipóxia celular por perfusão insuficiente dos tecidos [1]. Na maioria das vezes há hipotensão arterial, mas a sua presença não é obrigatória. Pressão arterial normal com sinais de má perfusão tecidual (tempo de enchimento capilar aumentado, oligúria, alteração do nível de consciência) também caracteriza choque circulatório.
Existem sintomas de choque que são inespecíficos (mal estar, fraqueza e fadiga) e aqueles decorrentes da má perfusão de órgãos, como:
- Pele: tempo de enchimento capilar lentificado, moteamento ou livedo reticularis, cianose e diminuição da temperatura
- Cardiovascular: hipotensão, taquicardia
- Rim: oligúria
- Sistema nervoso central: alteração do estado mental
Choque é uma emergência médica e a abordagem inicial deve incluir os seguintes passos: avaliar vias aéreas, garantir boa ventilação e oxigenação, estabelecer acesso venoso periférico e considerar expansão volêmica mesmo antes do final da avaliação.
Exames de sangue gerais devem ser solicitados neste momento, como gasometria e lactato arterial, hemograma, coagulograma, funções renal e hepática. Dependendo da suspeita, hemoculturas, troponina e BNP podem ser colhidos e eletrocardiograma (ECG) realizado na sala de emergência.
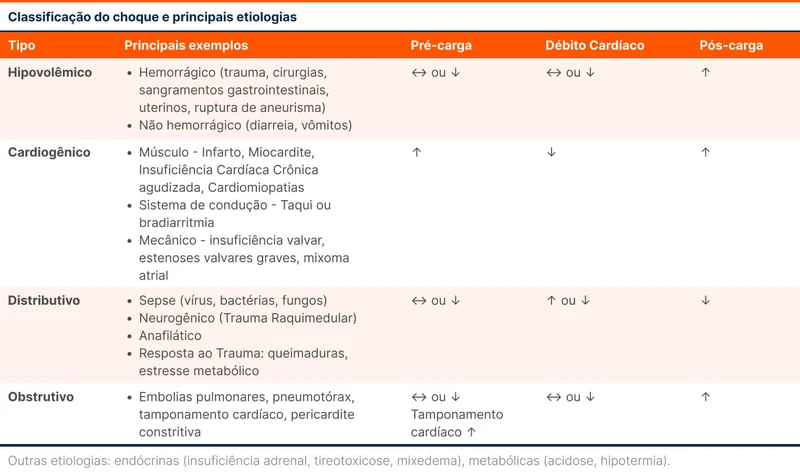
O tratamento do choque varia conforme a causa. A classificação pelo perfil hemodinâmico do choque e suas principais causas estão na tabela 1.

Outra forma de olhar para a fisiopatologia do choque é dividi-la em três grupos (tabela 2): função cardíaca (bomba), volume intravascular (tanque) e resistência vascular sistêmica (canos).
A cateterização da artéria pulmonar (cateter de Swan-Ganz) é uma forma de aferir vários parâmetros que detalham o choque. Utilizado com frequência no passado, vários estudos não encontraram benefícios de sua aplicação, de modo que muitas diretrizes não recomendam mais o uso de rotina [2-4]. Apesar disso, o manejo de algumas situações ainda é auxiliado pelo cateter de Swan-Ganz (ex.: hipertensão pulmonar, choque cardiogênico grave).
História e exame físico guiam as primeiras hipóteses e o manejo inicial do choque. Frequentemente não esclarecem o diagnóstico etiológico e é necessário aprofundar a investigação. O ultrassom à beira leito (point-of-care) é um aliado para definição rápida da etiologia e das condutas subsequentes. Protocolos como o RUSH podem ser realizados [5]. Para saber mais sobre o protocolo RUSH, veja este vídeo.
Quando a causa não for identificada com os exames já mencionados, o mnemônico ABCDE pode ajudar:
- Acidose metabólica
- Bócio (hipo/hipertireoidismo)
- Cálcio baixo (hipocalcemia)
- Drogas (medicamentos)
- Esteróide (Insuficiência Adrenal)
O início súbito associado a turgência jugular patológica sugerem origem cardiogênica para o choque. A dispneia e os estertores na ausculta respiratória indicam edema pulmonar.
Choque cardiogênico ocorre quando uma doença primariamente cardíaca leva a baixo débito. A disfunção cardíaca pode ocorrer por problemas nas valvas, miocárdio, sistema de condução ou pericárdio, como já exemplificado na tabela 1.
Existem quatro formas de apresentação da descompensação do ventrículo esquerdo (VE), que se definem pelos sinais e sintomas de congestão (úmido ou seco) e de hipoperfusão (frio ou quente). No choque cardiogênico, o paciente pode estar mal perfundido e congesto (frio e úmido) ou mal perfundido e sem congestão (frio e seco).
Existe a possibilidade do paciente em choque cardiogênico não ter sinais de má perfusão periférica. Isso ocorre quando há um choque distributivo associado que leve à vasodilatação (por exemplo, choque séptico) ou quando o próprio choque cardiogênico ocasiona vasodilatação pela ativação da cascata de inflamação.
Em torno de 80% dos choques cardiogênicos são causados por infarto agudo do miocárdio. As complicações mecânicas do infarto - ruptura de músculo papilar, defeito do septo ventricular e ruptura de parede livre - podem aparecer nas primeiras 24 horas da internação, apesar de serem chamadas de complicações tardias. A presença de sopro no exame físico sugere a presença de complicação mecânica, assim como uma rápida deterioração hemodinâmica.
Insuficiência cardíaca crônica agudizada pode representar até 1/3 dos casos de choque cardiogênico. A avaliação das comorbidades e dos medicamentos de uso contínuo são essenciais para identificação da doença nesses pacientes.
A American Heart Association sugere que todos os pacientes com suspeita de choque cardiogênico façam ECG, radiografia de tórax e ecocardiograma focado na identificação da causa da instabilidade hemodinâmica. Angiotomografia de tórax e ecocardiograma transesofágico devem ser solicitados na suspeita de dissecção aórtica [6].
Foram solicitados exames que identificaram troponina elevada, BNP 15.000 pg/ml, lactato elevado e leucocitose com neutrofilia. O eletrocardiograma mostra inversão de onda T em V4 a V6.
O ecocardiograma identificou disfunção sistólica grave do ventrículo esquerdo, com fração de ejeção de 30% e hipocinesia apical, acinesia média e hipercinesia basal, sem alterações valvares.
Ainda na sala de emergência foram iniciados noradrenalina e dobutamina em infusão contínua para adquirir maior estabilidade clínica, enquanto a paciente aguardava o cateterismo cardíaco.
A paciente foi levada para a sala de hemodinâmica. A angiografia não identificou obstruções significativas nas artérias coronárias. A ventriculografia está no vídeo a seguir:
O achado de disfunção grave do ventrículo esquerdo com hipocinesia/acinesia apical e coronárias sem lesões obstrutivas é o quadro típico da síndrome de Takotsubo, também chamada de cardiomiopatia induzida por estresse [7].
A fisiopatologia não é completamente compreendida. Ativação neuronal cardíaca excessiva ocasionada por catecolaminas parece ter um papel importante. Prejuízo da perfusão microvascular, inflamação miocárdica e alterações eletrofisiológicas também são mecanismos propostos.
Alguns autores consideram a cardiomiopatia por estresse um tipo de infarto agudo do miocárdio sem obstrução coronariana (MINOCA) [8]. Já a quarta definição universal de infarto de 2018 a considera um tipo de injúria miocárdica aguda [9].
De uma maneira ou de outra, a apresentação é muito semelhante ao infarto por obstrução coronariana. Dor torácica é o sintoma mais comum. Dispneia e síncope podem ocorrer. Choque cardiogênico se desenvolve em 10% dos casos.
Alterações eletrocardiográficas fazem parte do quadro. O achado mais comum é o supradesnivelamento de segmento ST (40% dos casos), principalmente em derivações precordiais. Infradesnivelamento de segmento ST, prolongamento do intervalo QT, inversão de onda T e onda Q patológica também são descritos. Na maioria dos pacientes, há elevação de troponina e peptídeo natriurético [10].
Por conta da grande semelhança com infarto e por ser bem mais rara, a cardiomiopatia induzida por estresse é manejada inicialmente como suspeita de síndrome coronariana aguda até que um exame de imagem das coronárias seja feito. Aproximadamente 1% dos pacientes com troponina elevada e suspeita de síndrome coronariana aguda têm cardiomiopatia por estresse [11].
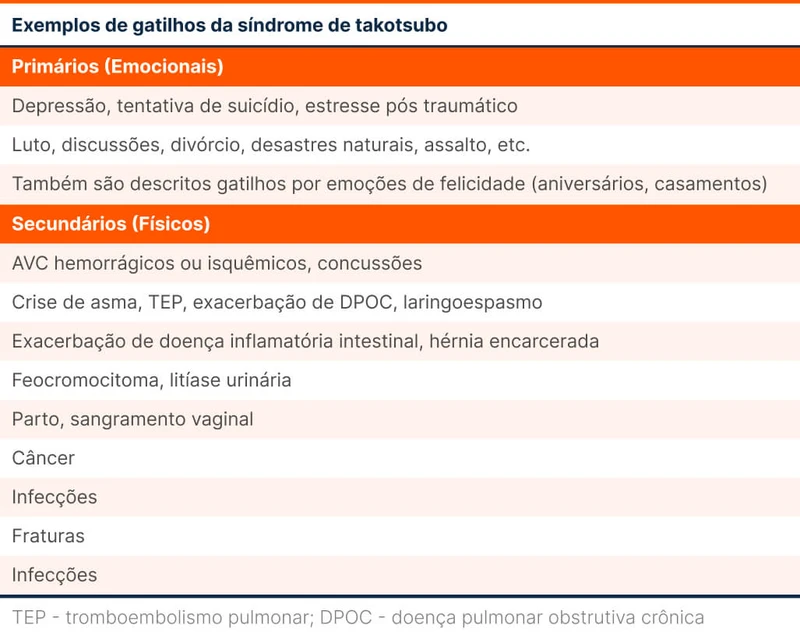
A maior parte dos pacientes são mulheres na pós menopausa. Os gatilhos que levam à ativação adrenérgica intensa e desencadeiam a doença podem ser primários (gatilhos emocionais) ou secundários (gatilhos físicos). Em até 25% dos casos, não há gatilho identificado [7].
As alterações de motilidade do ventrículo esquerdo (VE) na cardiomiopatia por estresse podem se apresentar de 5 formas:
- Acometimento apical com o achado de balonamento apical do VE (80% dos casos)
- Acometimento da região média do ventrículo com preservação do ápice (segundo tipo mais comum)
- Hipocinesia basal com a região média e apical normais (Takotsubo reverso)
- Tipo focal - um segmento isoladamente comprometido
- Global - hipocinesia global
Na maior parte dos casos, a alteração da motilidade da parede se estende além do território de uma única coronária.
A paciente evoluiu com necessidade de intubação orotraqueal e drogas vasoativas, sendo transferida para unidade de terapia intensiva (UTI). A equipe conversou com a família da paciente para aprofundar a anamnese inicial.
A paciente trabalhava como profissional de saúde, não tinha comorbidades e não usava medicamentos. Seu pai infartou aos 60 anos de idade. Os exames laboratoriais não identificaram alterações na função tireoidiana ou de eletrólitos. O painel viral foi negativo.
A ressonância magnética cardíaca confirmou hipocinesia médio apical, poupando a base, e excluiu o diagnóstico de miocardite.
A paciente manteve-se na UTI com marcante labilidade pressórica, variando entre 60/40 mmHg a 140/110 mmHg.
A ausência de gatilhos emocionais e a relação com esforço físico motivou investigação adicional. A tomografia de crânio, tórax e abdome identificou nódulo na adrenal direita de 3.6 cm x 3.2 cm x 3.6 cm. As metanefrinas urinárias vieram elevadas.
Diagnóstico final: cardiomiopatia induzida por estresse devido a feocromocitoma.
O diagnóstico de cardiomiopatia por estresse passa por excluir síndrome coronariana aguda por obstrução coronariana, o que foi feito no caso. Além disso, a ausência de realce miocárdico tardio na ressonância magnética enfraquece a hipótese de miocardite aguda, uma condição que também pode se apresentar de maneira similar.
Após a confirmação de cardiomiopatia por estresse, foram buscados gatilhos citados na tabela 3. Diante da labilidade pressórica, a hipótese de feocromocitoma foi levantada e confirmada por exames complementares.
A tempestade de catecolaminas causada pelo feocromocitoma é capaz de induzir uma disfunção do ventrículo esquerdo praticamente indistinguível de cardiomiopatia por estresse. Alguns autores consideram essa cardiomiopatia um tipo de cardiomiopatia por estresse, enquanto outros consideram uma cardiomiopatia a parte específica do feocromocitoma [12].
O prognóstico da cardiomiopatia por estresse varia conforme a causa. O quadro não é tão benigno como se imaginava. Um a cada cinco pacientes têm quadros graves, necessitando de drogas vasoativas e ventilação invasiva ou não invasiva, podendo evoluir com choque e parada cardiorrespiratória. Em torno de 4% dos pacientes evoluem para óbito. Esse prognóstico é semelhante ao do infarto agudo do miocárdio. O envolvimento do ventrículo direito é o único preditor independente de morte, rehospitalização, insuficiência cardíaca e cardiomiopatia recorrente.
O tratamento da cardiomiopatia por estresse não é guiado por ensaios clínicos randomizados. Todas as diretrizes são baseadas em opiniões de especialistas e envolvem o uso de drogas vasoativas, expansão volêmica ou balão intra aórtico, dependendo da gravidade. Esse manejo é semelhante ao de choque cardiogênico por outras etiologias.
Este caso foi adaptado do New England Journal of Medicine. Veja o caso completo no site do NEJM.
Alguns pontos de aprendizagem sobre o caso que você não pode esquecer:
- Choque é uma síndrome considerada emergência médica. O quadro clínico é feito de sintomas inespecíficos e disfunções orgânicas (oligúria, confusão mental). Hipotensão não é obrigatória para caracterizar choque.
- Em torno de 80% dos choques cardiogênicos são causados por infarto agudo do miocárdio.
- Disfunção grave do ventrículo esquerdo com hipocinesia/acinesia apical e coronárias sem lesões obstrutivas é o quadro típico da cardiomiopatia por estresse, também chamada de síndrome de Takotsubo.
- A apresentação de cardiomiopatia por estresse é muito semelhante à de infarto. Dor torácica e alterações no eletrocardiograma, como supradesnivelamento do segmento ST, fazem parte do quadro. Inicialmente, a maior parte dos pacientes é conduzida como suspeita de síndrome coronariana aguda
- Apesar do quadro de cardiomiopatia por estresse ser classicamente reversível, um a cada cinco pacientes têm quadros graves, evoluindo com necessidade de suporte ventilatório ou com drogas vasoativas, podendo evoluir com parada cardiorrespiratória. Em torno de 4% dos pacientes evoluem para óbito.
Aproveite e leia:
Síndrome de Wellens
A análise do eletrocardiograma (ECG) na dor torácica tem como divisor de águas a presença de supradesnivelamento do segmento ST (supra de ST). Alguns argumentam que o foco excessivo no supra de ST pode desviar a atenção de outros padrões relevantes no ECG. Aproveitando publicações recentes, vamos revisar o padrão de Wellens, um ECG que sempre deve ser lembrado.
