Oxigenoterapia Domiciliar
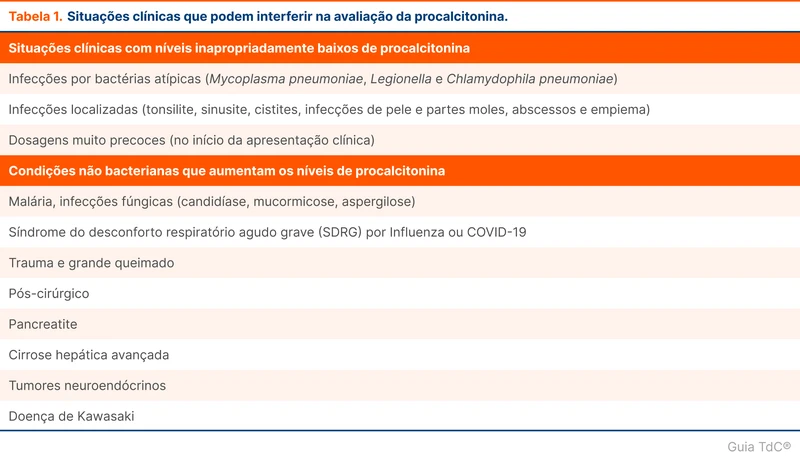
Oxigenoterapia domiciliar pode reduzir a mortalidade de pacientes com hipoxemia grave. Há dúvidas sobre quantas horas diárias são necessárias para atingir esse benefício. O estudo REDOX comparou 15 horas por dia contra 24 horas por dia [1]. Esse tópico traz os resultados do trabalho e discute aspectos práticos sobre o tema.
Indicações de oxigenoterapia domiciliar
Oxigênio domiciliar reduz mortalidade e hospitalizações em pacientes com doença pulmonar obstrutiva crônica (DPOC) e hipoxemia grave (fluxograma 1). Parece também melhorar a qualidade de vida, a hemodinâmica pulmonar e o desempenho cognitivo.
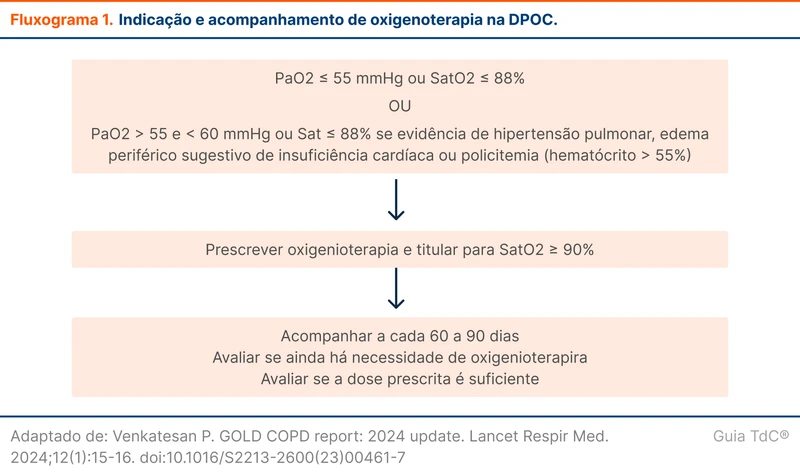
Em pacientes com exacerbações de DPOC recentes que preenchem os critérios de oxigenoterapia domiciliar, a indicação de suplementação deve ser reavaliada em um a três meses após o início do tratamento. Aproximadamente metade desses pacientes não precisará manter a oxigenoterapia durante o acompanhamento ambulatorial [2].
É incerto o benefício dessa terapia para outras doenças pulmonares, como doenças intersticiais, tromboembolismo pulmonar e hipertensão pulmonar. Nesses casos, a oxigenoterapia domiciliar é indicada por consensos de especialistas, que reconhecem o baixo nível de evidência da recomendação em diretrizes como da Sociedade Brasileira de Pneumologia e da American Thoracic Society [3, 4].
A British Thoracic Society, a American Thoracic Society e a Sociedade Brasileira de Pneumologia recomendam oxigênio durante o esforço para pacientes que ficam hipoxêmicos em exercícios físicos, com saturação arterial de oxigênio (SatO₂) menor ou igual a 88%, e que melhoram a tolerância ao exercício com o uso do oxigênio [3-5]. Essa indicação pode ser implementada em programas de reabilitação e não inclui o uso contínuo em domicílio. O GOLD 2024 faz recomendação contra oxigenoterapia domiciliar de longo prazo para pacientes com hipoxemia que ocorre apenas durante o esforço [6]. Mais informações sobre as recomendações do GOLD e suas últimas atualizações de 2024 podem ser encontradas na revisão "Doença Pulmonar Obstrutiva Crônica - GOLD 2023" e no tópico "Atualização de DPOC: GOLD 2024".
A oxigenoterapia domiciliar não melhorou desfechos em pacientes com DPOC que ficam hipoxêmicos apenas durante o sono [7]. Também não foi encontrado benefício em pacientes com hipoxemia moderada, definida por SatO₂ de 89 a 93% ou queda da SatO₂ entre 80 e 90% no teste da caminhada de 6 metros [8, 9]. Apesar disso, a diretriz brasileira faz indicação de oxigênio para pacientes que ficam hipoxêmicos durante a noite, com SatO₂ menor ou igual a 90% em mais de 30% do período e que têm evidência de hipertensão pulmonar ou eritrocitose [4].
Para saber mais sobre oxigênio no tratamento de dispneia no contexto de cuidados paliativos, veja "Controle Farmacológico de Sintomas".
Evidências para oxigenoterapia domiciliar e o estudo REDOX
Dois estudos clássicos definiram a indicação da oxigenoterapia em pacientes com hipoxemia grave: o Medical Research Council Working Party (MRC) e o Nocturnal Oxygen Therapy Trial Group (NOTT) [10, 11]. Ambos incluíram apenas pacientes com DPOC. O estudo MRC acompanhou pessoas com hipoxemia grave por 5 anos e comparou a suplementação de oxigênio domiciliar por no mínimo 15 horas por dia e placebo. Houve redução de mortalidade no grupo que usou oxigenoterapia. O NOTT comparou uso noturno por 12 horas e suplementação contínua de oxigênio. Após um ano, a mortalidade foi maior no grupo que usou apenas durante o período noturno.
Algumas sociedades pontuam que o uso de oxigênio por 24 horas pode trazer benefício adicional em relação a usar por no mínimo 15 horas diárias, baseado em estudos não randomizados [5]. Contudo, o uso contínuo tem consequências para os pacientes, como menor mobilidade e isolamento social [12, 13]. O estudo REDOX avaliou se há diferença significativa entre o uso por 24 horas em relação ao uso por no mínimo 15 horas diárias [1].
Esse trabalho foi um ensaio clínico randomizado, multicêntrico, controlado e não cegado. A instrução para o grupo de 15 horas por dia era utilizar sempre durante a noite e durante o dia ficar 9 horas sem oxigênio. Os dois grupos tinham como meta a titulação do oxigênio para atingir mais de 90% de saturação periférica de O₂ no oxímetro (SpO₂). Os critérios da indicação de oxigenoterapia domiciliar foram os de hipoxemia grave (fluxograma 1).
Foram incluídos 241 pacientes e DPOC foi a doença mais comum (70%), seguida de doença intersticial pulmonar (14%). Outros pacientes tinham como diagnóstico principal hipertensão pulmonar, tromboembolismo crônico e insuficiência cardíaca, mas essas doenças foram pouco representadas no estudo. Os pacientes foram acompanhados por um ano e utilizaram em média 1 a 2 L/min.
Na análise por intenção de tratar, não houve diferença entre os grupos para o desfecho composto de mortalidade e hospitalizações (124,7 eventos por 100 pessoas-ano; 95% IC], 96,5 a 152,9 [75 eventos no total]; e 124,5 eventos por 100 pessoas-ano; 95% CI, 97,0 a 151,9 [79 eventos no total]). A terapia de uso contínuo 24 horas por dia não foi superior à estratégia de 15 horas, com uma razão de risco (hazard ratio) de 0,99 (95% CI, 0,72 a 1,36, p = 0,007 para não superioridade). O estudo não evidenciou diferenças em outros desfechos como dispneia, fadiga, estado cognitivo e bem-estar.
A SpO₂ média em ar ambiente foi de 80% e a mortalidade em um ano nos dois grupos foi em torno de 30%, indicando a gravidade dessa população.
Durante o estudo, houve alteração do desfecho primário de morte para um desfecho composto de morte e hospitalizações. Além disso, os pesquisadores mudaram a margem de superioridade, o que tornou o critério menos rigoroso. As mudanças permitiram que o estudo atingisse significância estatística com 230 pacientes, ao invés de mais de 2.000 pacientes, como inicialmente planejado. Essas modificações no decorrer do estudo diminuem a confiança no trabalho. Um estudo maior poderia mostrar diferenças de mortalidade entre as estratégias. Também não foram avaliados os efeitos das duas estratégias após 1 ano de uso.
Aspectos práticos da oxigenoterapia domiciliar
Um estudo de pacientes brasileiros com DPOC identificou que 20% relataram ter usado oxigênio domiciliar no último ano. Oxigenoterapia domiciliar foi o maior contribuidor para custos relacionados à saúde dos pacientes com DPOC, na frente de medicamentos e internações [14].
Como solicitar e monitorar
A oxigenoterapia domiciliar é fornecida pelo SUS. Os pacientes são incluídos nos programas a partir do cadastro na atenção primária em unidades básicas de saúde.
Os protocolos são estaduais ou municipais. O critério de elegibilidade usualmente utilizado é o de hipoxemia grave (fluxograma 1) [4]. Fontes de oxigênio disponíveis, fornecedor, fluxos de acompanhamento e documentos a serem preenchidos variam conforme o local.
A gasometria arterial, em repouso e ar ambiente, durante doença estável, é o exame solicitado para liberação da oxigenoterapia. Alguns protocolos solicitam apenas oximetria para crianças até 16 anos, pacientes acamados e com dificuldade de locomoção e para tratamentos paliativos.
A prescrição deve conter:
- Fonte do oxigênio.
- Dispositivo de entrega do oxigênio (por exemplo, cateter nasal ou máscara).
- Número mínimo de horas a ser utilizado.
- Fluxo em L/min em repouso, no exercício e no sono.
- Alvo de SpO₂ desejado (geralmente acima de 90%). O limite superior varia conforme a doença.
O fluxo de oxigênio no esforço físico e sono é habitualmente 0,5-1 L/min a mais do que o prescrito para o repouso.
Alguns exemplos de protocolos são os de: São Paulo, Belo Horizonte, Bahia, Distrito Federal, Espírito Santo e Rio de Janeiro.
Fontes de oxigênio e dispositivos
Fontes estacionárias são instaladas no domicílio e fontes portáteis são utilizadas para deslocamentos fora de casa. Três fontes podem ser utilizadas (tabela 1):
- Cilindros de gás sob pressão.
- Concentradores de oxigênio.
- Cilindros de oxigênio líquido.

Quando pacientes que utilizam cilindros portáteis são atendidos em unidades de saúde, devem utilizar a fonte de oxigênio do local e desligar sua fonte para evitar seu esgotamento.
Concentradores aumentam o consumo de energia elétrica. É lei o desconto na conta de energia elétrica para famílias inscritas no CadÚnico, com renda mensal de até três salários mínimos e que tenham membro portador de doença que necessite de uso continuado de aparelhos que demandem consumo de energia.
O vídeo a seguir mostra dispositivos e acessórios para oxigenoterapia domiciliar.
Orientações ao paciente
Orientações para o uso seguro do oxigênio estão na tabela 2.
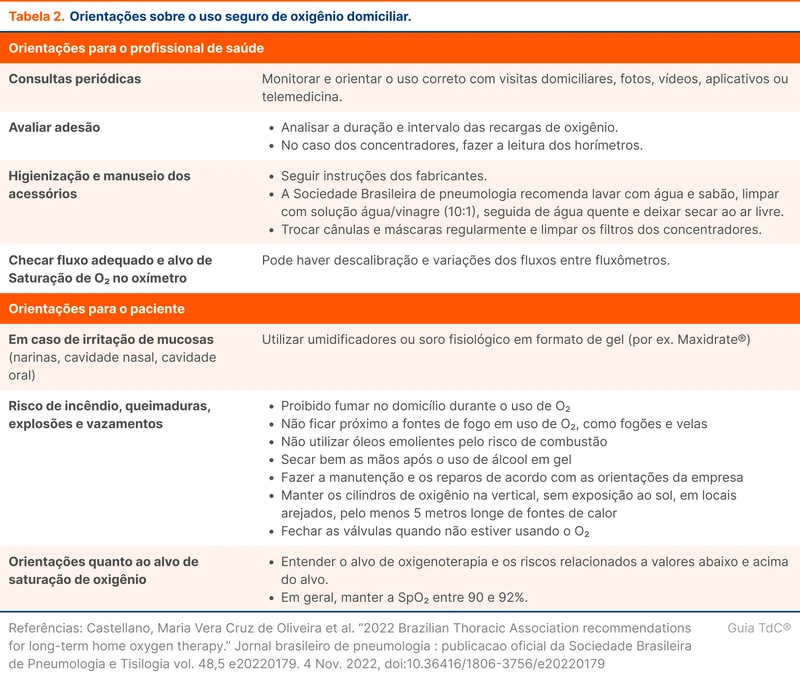
Independentemente da fonte de oxigênio, fumar aumenta o risco de incêndio e é considerado uma contraindicação ao uso de oxigenoterapia domiciliar. A umidificação com frascos de água aquecida (32–36 °C) pode ser necessária para pacientes com necessidade de altos fluxos de oxigênio, acima de 5 L/min. Não há indicação para fluxos menores e pode haver aumento do risco de infecções.
Uso de oxigênio durante voos
Cabines pressurizadas de avião equivalem a uma altitude em torno de 2500 metros. Uma pessoa saudável nessas condições tem queda da PaO₂ para 60–75 mmHg e da SatO₂ para 89%–94% [15, 16]. Pacientes que já utilizam oxigenoterapia domiciliar podem necessitar em torno de 2 L/min de fluxo a mais do que o usual. Aqueles que utilizam fluxos acima de 4 L/min devem viajar apenas em transporte aeromédico [4].
Pacientes com doença pulmonar e SpO₂ menor que 92% devem receber suplementação durante o voo. Já aqueles com SpO₂ entre 92 e 95% devem ser avaliados individualmente quanto a sintomas no esforço e pode ser indicado o teste de caminhada em 6 minutos ou o teste de simulação de hipóxia antes de viajar. Queda de SpO₂ abaixo de 84% em um dos testes é indicação de oxigênio durante o voo [4, 17]. Apenas pacientes avaliados clinicamente e considerados estáveis são aptos para voar [15].