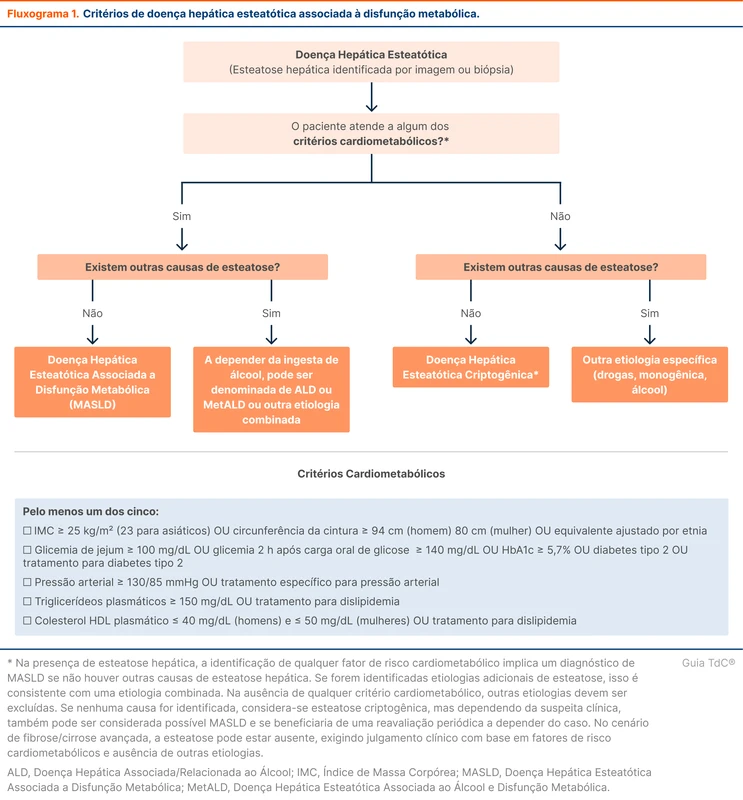
Estado de Mal Epiléptico
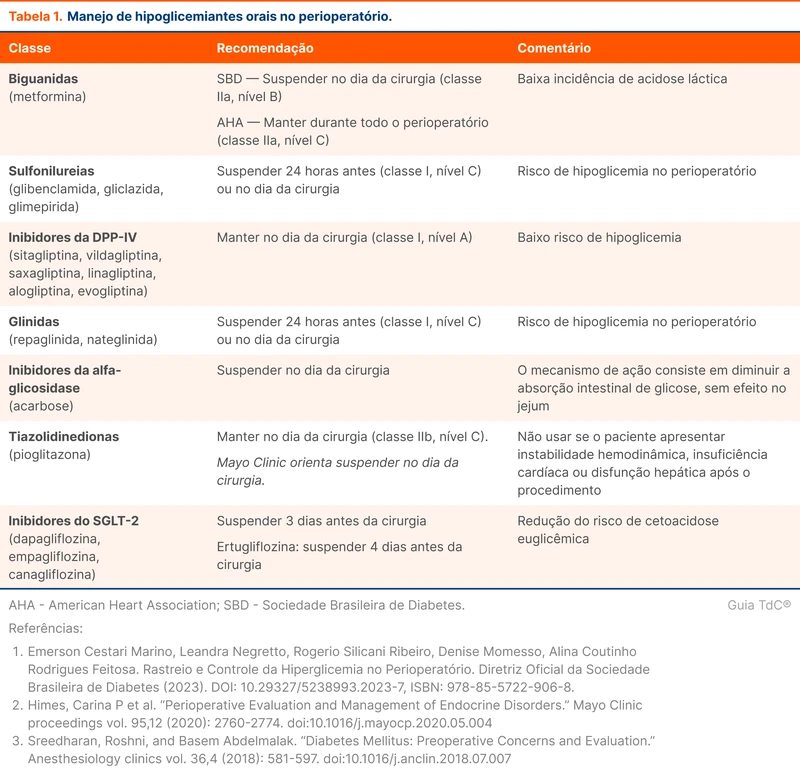
O estado de mal epiléptico é uma emergência neurológica ameaçadora à vida. É causado por precipitantes específicos ou falha nos mecanismos de término da crise epiléptica, resultando em crises anormalmente prolongadas e com possíveis efeitos deletérios permanentes [1]. Esse tópico revisa o diagnóstico e o manejo do estado de mal epiléptico.
Diagnóstico de estado de mal epiléptico
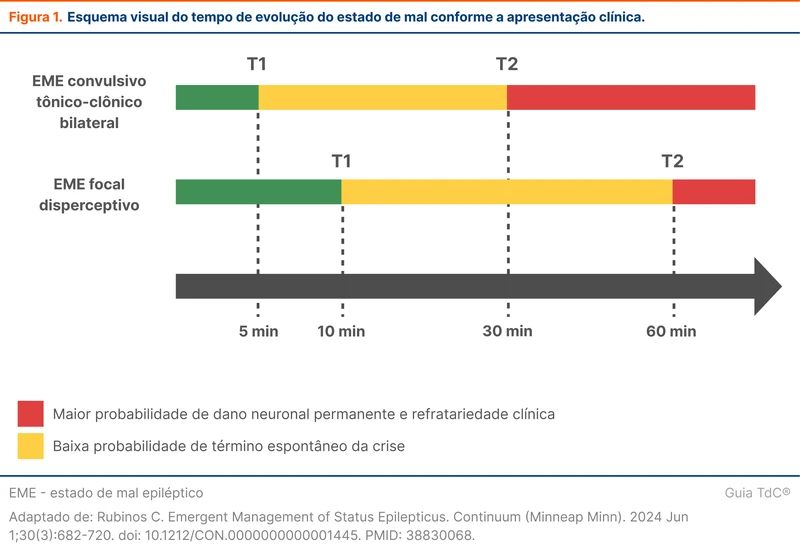
O estado de mal epiléptico generalizado é definido como uma crise contínua por mais de 5 minutos ou crises que recorrem sem que haja recuperação completa da consciência com duração maior que 5 minutos [1]. Pode ser convulsivo ou não convulsivo. O estado de mal convulsivo ocorre quando há sintomas motores proeminentes, como nas crises tônico-clônicas bilaterais, e nas crises focais disperceptivas prolongadas com prejuízo da consciência.
O tempo de 5 minutos para caracterizar o estado de mal se apoia no fato de que crises tônico-clônicas bilaterais isoladas têm uma duração média inferior a 2 minutos e estudos observacionais demonstram que não ultrapassam de 5 minutos [2]. As crises com duração maior do que 5 minutos possuem baixa probabilidade de terminar espontaneamente e devem ser prontamente tratadas. Nas crises focais disperceptivas, a duração a partir da qual é improvável que a crise termine por conta própria é de 10 minutos. Esse limiar de tempo que indica baixa chance de resolução espontânea é denominado de T1 (5 minutos em tônico-clônicas bilaterais, 10 minutos em focais disperceptivas).
O estado de mal epiléptico pode causar consequências a longo prazo se durar um determinado tempo. Esse tempo é chamado de T2 e é de 30 minutos para crises tônico-clônicas bilaterais e de 60 minutos para crises focais disperceptivas (figura 1). O conceito de T2 reforça que essa é uma condição sensível ao tempo e o tratamento deve ser instituído o mais brevemente possível.
O estado de mal não convulsivo é caracterizado pela ausência de sintomas motores proeminentes. Esse é um importante diagnóstico diferencial de rebaixamento de nível de consciência sem causa clara. Estado de mal não convulsivo pode estar presente em até 20% dos pacientes em coma em UTI [3]. Uma etapa importante do exame físico em situação de rebaixamento de nível de consciência é procurar ativamente por sinais clínicos sutis que sugiram crise epiléptica, como movimentação repetitiva de membros, alteração da motricidade ocular, afasia ou clonias.
Um diagnóstico prévio de epilepsia é o maior fator de risco isolado para o estado de mal epiléptico [4]. O baixo nível sérico de anticonvulsivantes, seja por dificuldades com o tratamento ou interação medicamentosa, parece ser o principal motivo para a ocorrência.
Nos pacientes sem história de epilepsia, o AVC isquêmico ou hemorrágico é a principal causa de estado de mal epiléptico. O AVC pode se apresentar como estado de mal no contexto agudo ou ser um fator facilitador para a sua ocorrência no futuro [5]. Uma situação que pode gerar hesitação é a presença de paresia após um estado de mal resolvido, causando dúvida entre paralisia de Todd e um déficit por AVC. Um déficit motor após crise epiléptica em um paciente sem diagnóstico prévio de epilepsia deve ser encarado como suspeita de AVC isquêmico ou hemorrágico e conduzido como tal [6].
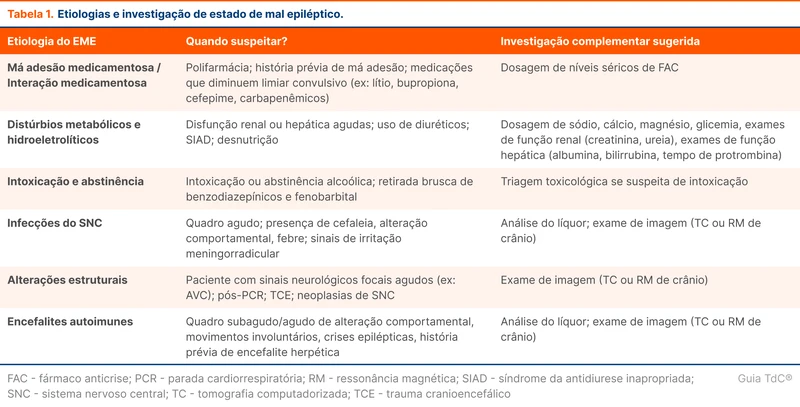
A glicemia capilar deve ser aferida rapidamente em todos os pacientes em estado de mal epiléptico, pois as disglicemias são causas que podem ser rapidamente revertidas. Veja a tabela 1 para etiologias de estado de mal epiléptico.
Tratamento do estado de mal epiléptico
O paciente em estado de mal epiléptico deve ser manejado em sala de emergência ou UTI. O tratamento é sensível ao tempo e deve ocorrer o mais rápido possível.
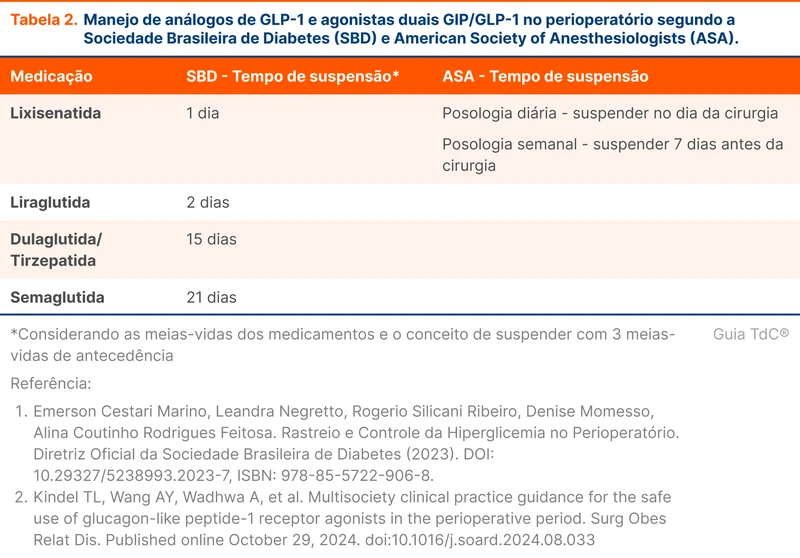
A primeira medida é administrar um benzodiazepínico. Essa etapa deve ser realizada ainda no ambiente pré-hospitalar, quando possível. As drogas de escolha são o diazepam 10 mg via intravenosa (IV) ou midazolam 10 mg intramuscular.
Se a crise persistir ou o nível de consciência não retornar, o segundo passo é a administração de anticonvulsivantes IV. A opção mais disponível é a fenitoína (hidantal ®). A administração IV de fenitoína também é conhecida como hidantalização. O fluxograma 1 resumo as etapas do tratamento do estado de mal epiléptico.
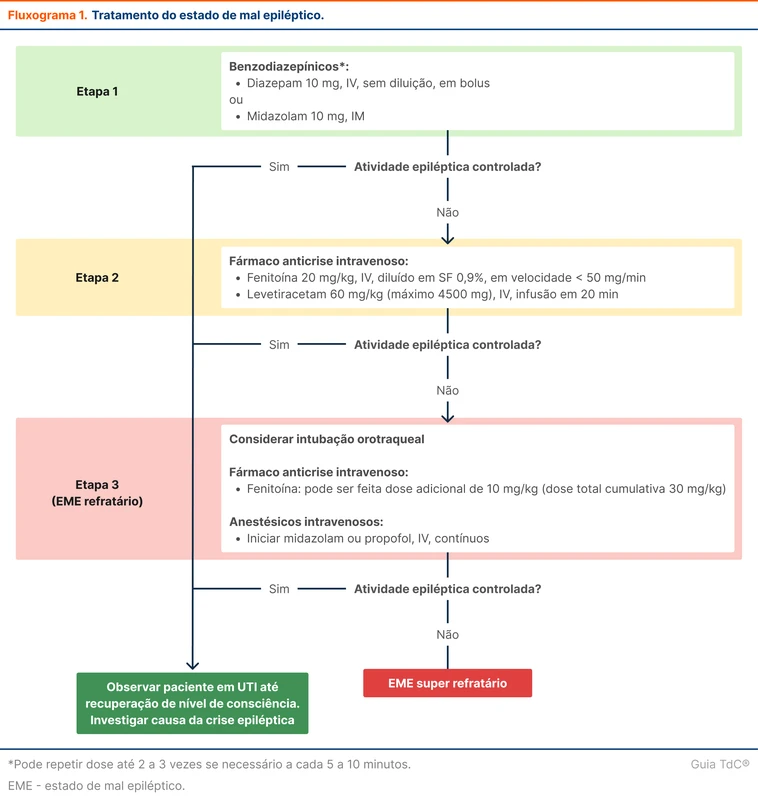
O estudo ESETT comparou valproato, levetiracetam e fosfenitoína (derivado da fenitoína) intravenosos para tratamento do estado de mal epiléptico [7]. Não houve superioridade de qualquer uma das drogas. O valproato intravenoso está indisponível no Brasil até o momento da publicação deste tópico.
Acompanhamento e tratamento de estado de mal refratário
Os pacientes com estado de mal epiléptico devem ser monitorizados, idealmente com eletroencefalograma (EEG) contínuo. Esse recurso é pouco disponível em hospitais brasileiros. Uma opção é realizar EEG intermitente diário ou na maior frequência possível.
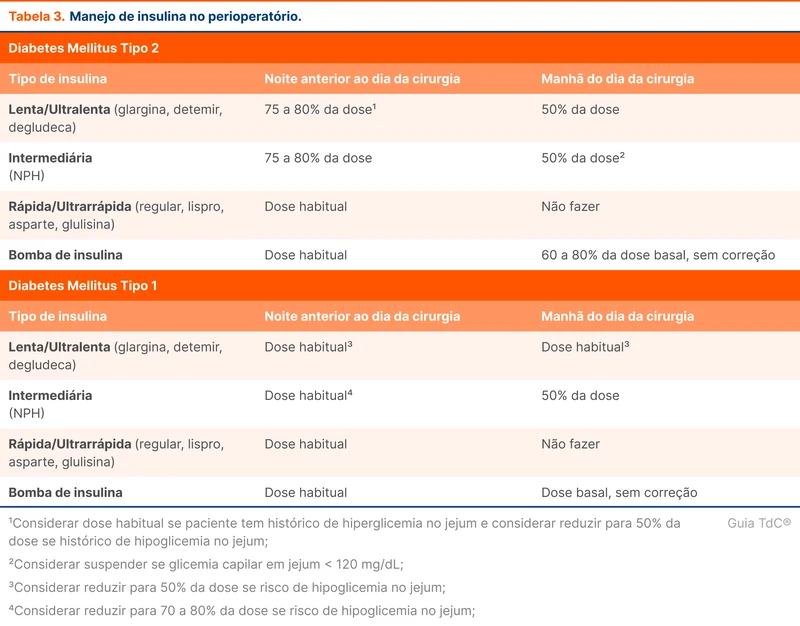
A persistência do quadro mesmo após a segunda droga caracteriza um estado de mal epiléptico refratário. Nas coortes no departamento de emergência, até 33% dos pacientes com estado de mal evoluem para refratariedade [8]. Quando a refratariedade do estado de mal ocorre em pessoas sem história prévia de crises epilépticas, o quadro é definido como NORSE (do inglês, new onset refractory status epilpeticus). Nesses casos, 50% dos pacientes permanecem sem etiologia definida após investigação, 20% são relacionados a encefalites autoimunes e 8% causados por infecções do sistema nervoso central [9].
O estado de mal epiléptico refratário é grave e tem mortalidade de até 25% [8]. A próxima etapa do tratamento é a administração de anestésicos intravenosos. As principais opções são midazolam e propofol (veja tabela 2).
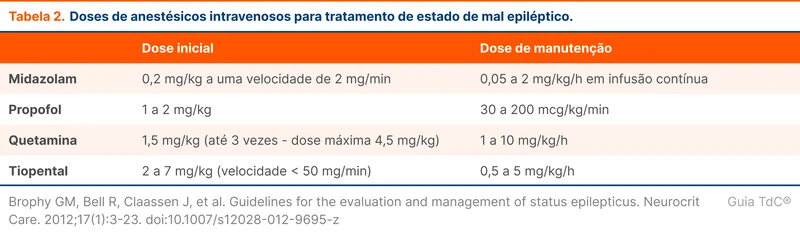
Em caso de refratariedade a essas duas drogas, o que caracteriza um estado de mal epiléptico super refratário, há evidências crescentes do papel da quetamina [10]. Os barbitúricos, como o tiopental, são opções menos interessantes nesse cenário por efeitos adversos hemodinâmicos graves.
Quando intubar?
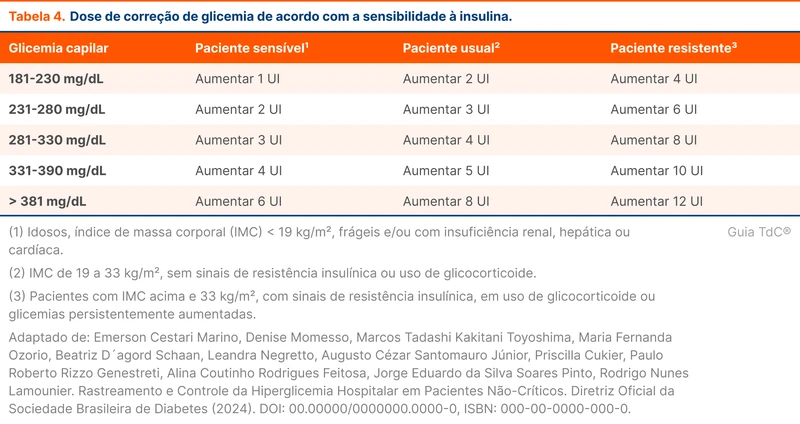
A decisão de intubar é individual e influenciada pela resposta inicial ao tratamento. Os pacientes em estado de mal refratário devem ser submetidos a intubação orotraqueal antes da administração de anestésicos intravenosos. A intubação precoce em contexto pré-hospitalar não resultou em menor mortalidade [11].
Quando diminuir a dose das medicações?
A intensidade e duração do tratamento com anestésicos intravenosos é definida pelo EEG. O objetivo é manter o paciente sem crises no EEG por 24 a 48 horas antes de diminuir ou interromper qualquer tratamento [12]. A identificação da etiologia e o tratamento da causa de base são determinantes para o sucesso do tratamento.