Acetazolamida para Insuficiência Cardíaca Descompensada
Um destaque do congresso de 2022 da European Society of Cardiology (ESC), o estudo ADVOR avaliou o uso de acetazolamida na descompensação de insuficiência cardíaca (IC) e seus desfechos clínicos [1]. Em um cenário comum, porém com menos estudos do que gostaríamos, o ADVOR chega para ser um dos maiores trabalhos de diureticoterapia na IC. Vamos aprofundar nesse estudo e na sua pergunta clínica.
Sobre acetazolamida
Acetazolamida é um diurético inibidor da anidrase carbônica. A droga reduz a reabsorção tubular proximal de sódio, agindo em um local do néfron que não é atingido pelos diuréticos de alça, tiazídicos ou poupadores de potássio (veja a figura 1).
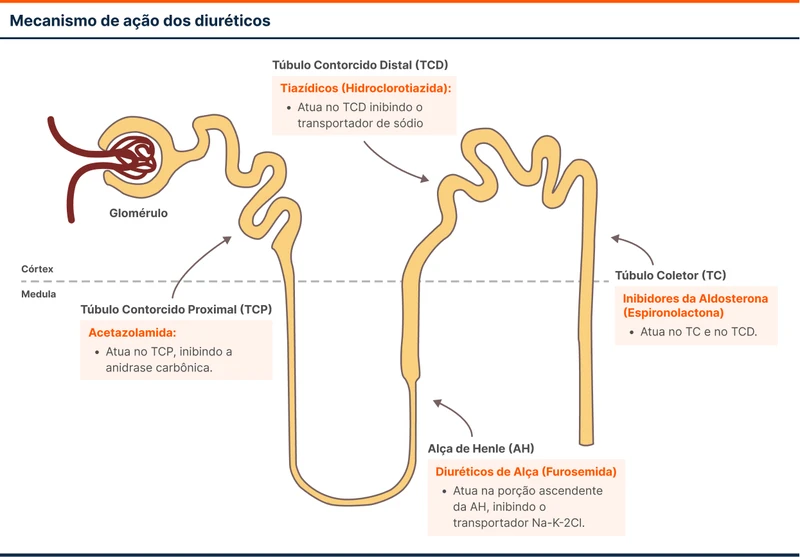
Além de diurético, também é indicado no tratamento do glaucoma, hipertensão intracraniana idiopática e na prevenção e tratamento do mal de atitude. Seus principais efeitos adversos são acidose metabólica, parestesias, disgeusia, poliúria e fadiga.
Como diurético, a acetazolamida é indicada principalmente em pacientes que permanecem congestos após uso de diuréticos e que desenvolveram alcalose metabólica provocada pela furosemida ou tiazídico. A acetazolamida consegue melhorar a diurese e a alcalose metabólica ao mesmo tempo.
Por mais que a terapia diurética inicial do paciente com insuficiência cardíaca (IC) descompensada seja com diuréticos de alça, o número de pacientes que permanecem hipervolêmicos após 72h de terapia é alto: o trabalho ADHERE constatou que dos pacientes que recebem alta após uma descompensação de IC, 20% vão acima do seu peso basal [2].
Sobre o estudo ADVOR
O estudo ADVOR é um ensaio clínico belga, multicêntrico e sem envolvimento da indústria farmacêutica. Os pesquisadores randomizaram pacientes internados por descompensação da IC com pelo menos um sinal de sobrecarga de volume (edema, derrame pleural ou ascite) e também um NT-proBNP acima de 1000pg/ml ou BNP acima de 250pg/ml. Todos os pacientes eram usuários crônicos de diuréticos, necessitando de uma dose maior igual a 40mg de furosemida (ou equivalente) por pelo menos um mês antes da internação.
Eram excluídos aqueles que já utilizavam acetazolamida ou uma gliflozina, quem apresentava pressão arterial sistólica abaixo de 90mmHg ou taxa de filtração glomerular (TFG) abaixo de 20 ml/min. Após a admissão, os pacientes não podiam ter recebido uma dose acima de 80 mg de furosemida antes da randomização.
Os diuréticos por via oral eram interrompidos e os pacientes recebiam 500mg de acetazolamida intravenosa (IV) uma vez ao dia ou placebo. Além disso, era administrada por via intravenosa o dobro da dose de diurético de alça que utilizavam em casa. Essa dose dobrada era dada em bolus no dia da randomização, e dividida em duas doses nos dias seguintes (veja a tabela 1).
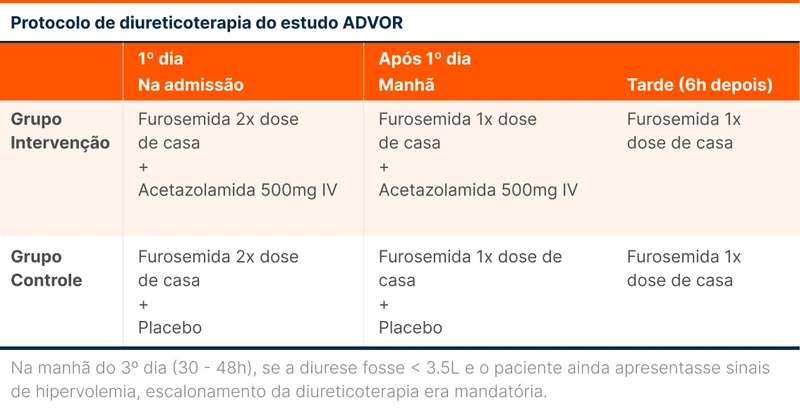
Caso o paciente apresentasse uma diurese menor que 3,5 litros após um período de 30 a 48 horas e ainda mantivesse sinais de congestão, a terapia de descongestão era escalonada. O escalonamento era feito por uma das três opções a seguir a seguir:
- Dobrando a dose de diurético IV;
- Acréscimo de clortalidona 50mg ao dia;
- Diálise.
O desfecho primário foi ausência de sinais de congestão após 3 dias de tratamento, sem a necessidade de escalonamento da terapia. A congestão era avaliada por um escore que envolvia edema de membros inferiores, ascite e derrame pleural.
E o que o trabalhou achou?
Incluindo 519 pacientes, o estudo encontrou o desfecho de ausência de congestão em 42% dos pacientes do grupo acetazolamida e 30% do grupo placebo. Analisando subgrupos, o mesmo achado foi encontrado independente do valor da fração de ejeção, do NT-proBNP. O achado é atenuado em pacientes que utilizavam em casa uma dose de furosemida de 60mg ou mais.
Apesar da maior quantidade de diurese no grupo intervenção, uma das explicações para os resultados do estudo é a maior natriurese provocada pela acetazolamida. A ideia é que a furosemida provoca mais eliminação de água do que sódio, o que pode retardar a resposta nos dias subsequentes. A acetazolamida atuando em conjunto pode impedir esse efeito de retenção relativa de sódio.
Nos desfechos secundários, não houve diferença em mortalidade, reinternação hospitalar e na média de dias de hospitalização, que foi de 8,8 dias no grupo acetazolamida e 9,9 dias no grupo placebo. Nos desfechos de segurança, não houve surgimento de acidose metabólica no grupo acetazolamida e não teve diferença de surgimento de hipocalemia, disfunção renal e hipotensão entre os grupos.
Problemas do estudo
O primeiro questionamento é sobre a população, considerando que 99% dos pacientes estudados eram brancos.
O segundo problema é a exclusão de quem utilizava gliflozinas. No momento da criação do protocolo do estudo, as gliflozinas não possuíam seu grau de recomendação na IC como possuem hoje, o que limita hoje o grupo estudado. A exclusão foi devido a sua ação no mesmo local no túbulo proximal, o que poderia confundir o resultado final. Apesar de agirem na mesma região do néfron, as gliflozinas e a acetazolamida fazem isso por vias diferentes e não possuem o mesmo desempenho, já que a SGLT2 é responsável por reabsorver 5% do sódio enquanto o mecanismo inibido pela acetazolamida é responsável por 60%.
O terceiro apontamento é a dose de furosemida, que foi utilizada no máximo duas vezes ao dia. Diretrizes recentes, como a do ESC, recomendam a reavaliação a cada 6 horas, para possível nova dose de diurético.
O ADVOR não se aplica à primeira descompensação de IC ou aqueles que não utilizavam furosemida em casa tendo em vista seus fatores de inclusão. Pacientes com TFG abaixo de 20 ml/min possuem maior risco de acidose metabólica, efeito adverso que pode ser exacerbado pela acetazolamida. Logo, pacientes que na entrada apresentam disfunção renal importante ou acidose metabólica não são a população alvo deste trabalho.