Hipertensão no Paciente Internado
Você é chamado para ver uma paciente internada por pielonefrite que está com a pressão arterial (PA) de 182/86 mmHg. Ela está assintomática, mas você teve que ser convocado, pois os parâmetros para chamar o médico plantonista incluem PA elevada. O que fazer nessa situação?
Qual a dimensão do problema?
HAS no paciente internado é bastante comum. Estimativas de prevalência variam de 50% a 70% [1]. Apesar de frequente, não há diretriz para guiar o manejo. A consequência é uma grande divergência de condutas, tanto no manejo durante a internação, quanto na alta.
O uso de medicações intravenosas deve ser reservado para pacientes com pressões maiores que 180/120 mmHg com lesão de órgão alvo. Essa situação é rara no contexto de enfermaria. Apesar disso, o tratamento com medicações intravenosas não é incomum, expondo os pacientes aos riscos de reduções bruscas da PA.
Estudo publicado no British Medical Journal em 2018 não encontrou diferença na chance de ter o regime anti-hipertensivo intensificado entre pacientes com maior probabilidade de benefício (ex.: evento cardiovascular prévio) quando comparados àqueles com menor probabilidade de benefício (ex.: baixa expectativa de vida) [2]. Na falta de diretrizes específicas, a decisão de intensificar o tratamento deve levar em consideração o contexto clínico e não apenas o nível pressórico.
Por que tratar HAS no paciente internado pode ser danoso?
Pacientes que possuem PA elevada, mesmo na ausência de lesão de órgão alvo, tem mortalidade alta em 1 ano. Contudo, os eventos sofridos por esses pacientes não são hiperagudos. Além disso, os benefícios do tratamento são conferidos ao longo de meses a anos, não em horas. Mesmo com PA sistólica > 220 mmHg, a taxa de eventos em 7 dias é baixa.
Vários estudos apontam que intensificar o tratamento anti-hipertensivo na internação pode se associar a piores desfechos. Estudo publicado no Journal of the American Medical Association (JAMA) em 2019 associou intensificação do tratamento anti-hipertensivo com maior chance de readmissão hospitalar e eventos adversos (lesão renal aguda, síncope, distúrbios eletrolíticos e hipotensão) [3]. Outro estudo do JAMA de 2020 associou intensificação do regime com lesão renal aguda e injúria miocárdica [4]. Em 2022, estudo publicado no Journal of Clinical Hypertension encontrou na análise ajustada que tratamento exclusivo com medicações intravenosas se associou com quedas excessivas e potencialmente danosas de PA [5].
Outro problema de tratar medidas elevadas de PA no hospital é a dificuldade de realizar a aferição apropriada. Treinamento insuficiente da equipe, equipamento defeituoso e preparo inadequado do paciente podem falsamente elevar as medidas.
O que fazer quando a PA eleva no hospital?
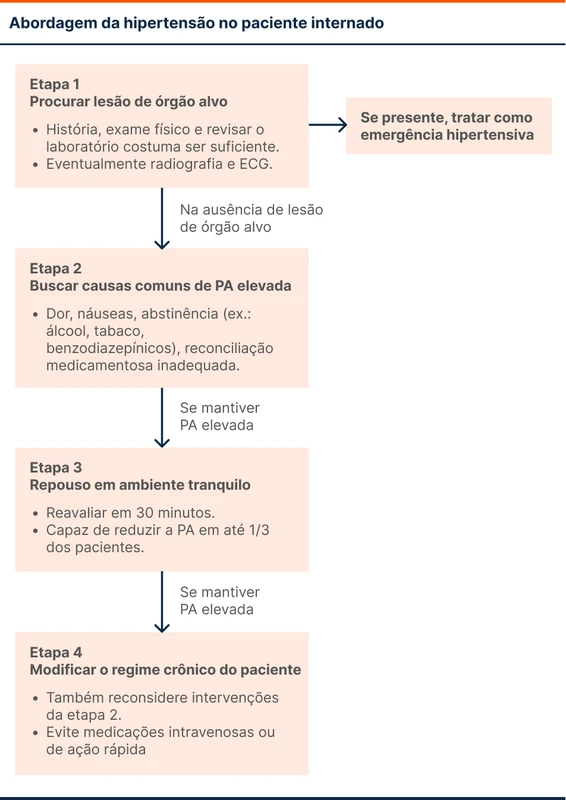
O primeiro passo é buscar lesão de órgão alvo. Isso pode ser feito com anamnese e exame físico cuidadosos, eventualmente com radiografia e eletrocardiograma em casos de dúvida.
A segunda etapa é procurar causas comuns de elevação da PA no hospital. As principais são: dor, náuseas, abstinências e reconciliação medicamentosa inadequada.
O terceiro passo é, nos pacientes sem lesão de órgão alvo que persistem hipertensos, permitir repouso em ambiente tranquilo por 30 minutos. Essa intervenção é capaz de reduzir a PA de maneira significativa em torno de um terço dos pacientes [6].
Por fim, caso a PA se mantenha elevada, evite medicações intravenosas ou de ação rápida. Considere as intervenções da segunda etapa ou modifique o regime crônico do paciente. Garanta retorno precoce para que o ajuste fino seja feito no contexto ambulatorial.