Diagnóstico e Tratamento de Doença do Refluxo Gastroesofágico
A doença do refluxo gastroesofágico (DRGE) acomete por volta de 13% da população mundial. Os sintomas clássicos de pirose e regurgitação, mesmo que leves, podem estar associados a redução da qualidade de vida. Em janeiro de 2022, o American College of Gastroenterology (ACG) publicou uma diretriz sobre DRGE e aproveitamos para revisar o diagnóstico e tratamento [1].
Como fazer o diagnóstico de DRGE?
O diagnóstico é clínico, baseado nos sintomas característicos como pirose e regurgitação.
O tratamento empírico é recomendado se não existirem sintomas de alarme (ver tabela 1). Essa conduta serve como medida terapêutica e diagnóstica, pois se houver resposta à terapia, assume-se que de fato era um caso de DRGE. O tratamento consiste em medidas não farmacológicas e farmacológicas (omeprazol 20mg/dia ou equivalente) por 8 semanas.

A endoscopia digestiva alta (EDA) tem boa sensibilidade e especificidade para o diagnóstico de DRGE erosiva ou esôfago de Barrett. Contudo, apresenta baixa sensibilidade em casos de DRGE não erosivo, responsável por 60 a 70% dos casos [2]. Sua solicitação deve ficar reservada para as seguintes situações:
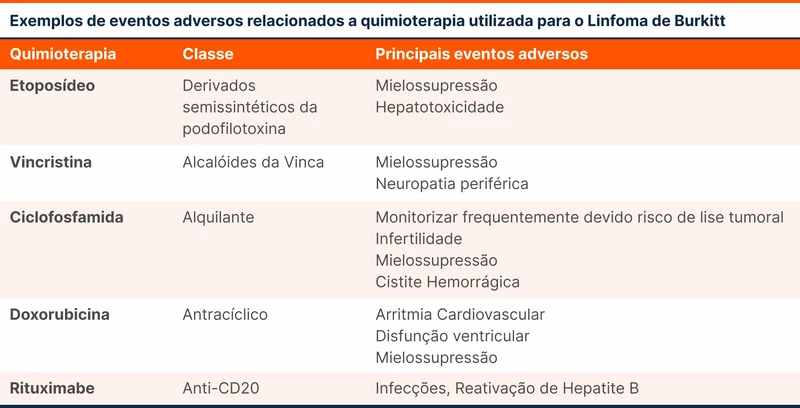
- Presença de sintomas de alarme
- Ausência de resposta ao tratamento empírico por 8 semanas
- Presença de critérios de alto risco para esôfago de Barrett (ver tabela 2)
A EDA deve ser realizada de 2 a 4 semanas após a suspensão do IBP em pacientes que fizeram terapia empírica.

O diagnóstico é confirmado se a EDA encontrar uma esofagite Los Angeles B, C ou D (veja tabela 3) ou presença de esôfago de Barrett. Quando a EDA é normal ou com Los Angeles A, uma confirmação diagnóstica com monitorização de refluxo sem uso de IBP é necessária (veja fluxograma 1).
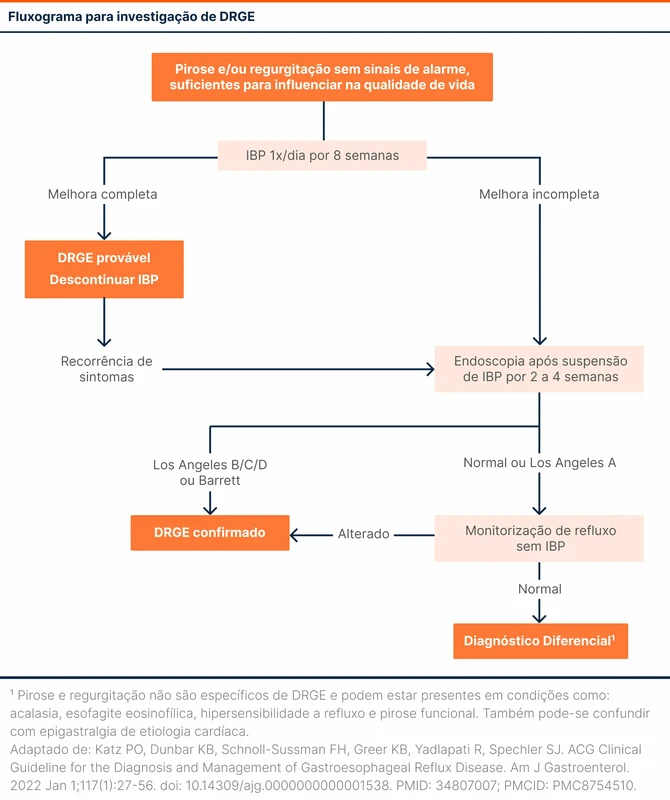
A monitorização de refluxo é feita ambulatorialmente via sonda esofágica transnasal (com ou sem impedância) por 24 horas ou por cápsula esofagiana por até 96 horas. Durante o exame, é avaliado o tempo de exposição ácida e o número de episódios de refluxo. O paciente deve registrar os sintomas durante o exame para correlacionar com os achados. O método com impedância permite avaliação de refluxos não-ácidos, clearance do bolo alimentar e extensão proximal do refluxo.
A manometria esofagiana não tem papel diagnóstico para pacientes com DRGE. Esse exame auxilia no diagnóstico diferencial com transtornos de motilidade e para avaliar a função do esfíncter esofagiano inferior (EEI) em candidatos à cirurgia antirrefluxo.
Tratamento não-farmacológico

As medidas não-farmacológicas com maior evidência são a perda ponderal em pacientes com sobrepeso ou obesidade e a elevação da cabeceira da cama em 15 a 20 cm. Outras recomendações estão na tabela 4.
Tratamento farmacológico
A diretriz da ACG recomenda os IBPs como primeira linha de tratamento na DRGE. Essa recomendação é baseada na superioridade dos IBPs em relação aos antagonistas dos receptores de histamina (ARH) no controle sintomático. Além disso, também apresentam maior taxa de cura de esofagite erosiva [3]. Todos os IBPs disponíveis no mercado conferem esses benefícios [4]. Algumas recomendações no uso de IBP estão na tabela 5.

A terapia com IBP deve ser mantida por 8 a 12 semanas. Se os sintomas melhorarem e não houver esofagite erosiva ou esôfago de Barrett, deve-se tentar descontinuar o IBP e manter apenas seu uso sob demanda (tomar diariamente se sintomas e descontinuar quando ocorrer a melhora) [5]. Uma alternativa é a terapia step-down com os ARH.
A manutenção do IBP de forma indefinida deve ser considerada em pacientes com esofagite erosiva moderada a grave (Los Angeles C e D). Nestes casos, deve-se buscar a menor dose necessária para controle de sintomas e inflamação esofágica.
Em pacientes com sintomas noturnos refratários aos IBPs, os ARH podem ser considerados antes de deitar [6]. Apesar disso, um estudo encontrou que o uso crônico de ARH está associado à taquifilaxia (dessensibilização e perda de resposta) e piora sintomática, sendo ideal manter o uso apenas sob demanda no período noturno [7].
O baclofeno é uma alternativa em casos refratários aos IBPs. A medicação reduz o relaxamento intermitente do EEI, diminuindo os episódios de refluxo [8]. O uso deve ser reservado para pacientes com diagnóstico confirmado pela monitorização ambulatorial de refluxo. Os eventos adversos também são uma limitação: sonolência, tontura e constipação.
Antiácidos, alginatos e sucralfato podem ser utilizados para alívio sintomático intermitente. Estas medicações são de curta duração e não previnem os sintomas de DRGE. São a primeira escolha de tratamento na gravidez, já que todos os IBPs são categoria B, exceto o omeprazol, que é C.
O uso de procinéticos não é recomendado para o tratamento de qualquer subtipo de DRGE. Devem ser utilizados em casos de associação com gastroparesia.