Antibióticos Anti-Anaeróbios e Piores Desfechos Hospitalares
A microbiota intestinal tem um papel de proteção contra os germes patogênicos. O uso de antibióticos contra anaeróbios pode comprometer a microbiota nativa. Nessa linha, esse trabalho de outubro de 2022 publicado no European Respiratory Journal avaliou se a exposição a antibióticos anti-anaeróbios poderia levar a piores desfechos [1].
Quando cobrir anaeróbios?
Bactérias anaeróbias estão presentes na flora bacteriana das mucosas e da pele. Quando participam de um quadro infeccioso, geralmente estão em processos polimicrobianos como abscessos.
Apesar de presentes em algumas infecções, os anaeróbios são isolados com dificuldade. Eles necessitam de meio de cultura próprio e não crescem facilmente em culturas, tornando a confirmação diagnóstica incomum. Considerando esse impasse, existem indicações de tratamento empírico de anaeróbios.
Na diretriz de 2014 de infecções de pele e subcutâneo, a Infectious Disease Society of America (IDSA) recomenda o uso de terapias anti-anaeróbias em infecções de sítio cirúrgico que envolvem a axila, trato gastrointestinal, períneo ou trato genital feminino, assim como em casos de fasceíte necrotizante ou mordida por animais [2].
Em relação a infecções abdominais, a última diretriz é de 2021 de um conglomerado de sociedades de cirurgiões [3]. O documento recomenda a cobertura de anaeróbios para todas as infecções intra-abdominais, citando que essa medida pode não ser essencial em infecções do trato gastrointestinal alto.
Nas pneumonias, a diretriz de 2019 da IDSA em conjunto com a American Thoracic Society (ATS) cita que as principais indicações de cobrir anaeróbios em pacientes com pneumonia são a presença de abscesso pulmonar ou empiema [4]. Artigos mais antigos sugeriam que pacientes com aspiração tinham maior risco de infecções por anaeróbios, porém novos estudos questionam essa indicação devido a baixa prevalência encontrada.
Em infecções do pescoço, tanto a angina de Ludwig - celulite dos espaços sublinguais e submandibular - quanto a síndrome de Lemierre - tromboflebite supurativa da veia jugular - tem indicação de terapia empírica contra anaeróbios.
Abscessos ainda não citados, como abscesso cerebral, hepático ou odontológico, geralmente são polimicrobianos e se beneficiam do uso dessa terapia.
O que cobre anaeróbio?
Os principais germes anaeróbios relacionados a processos infecciosos são Clostridioides difficile (colite), Fusobacterium necrophorum (síndrome de Lemierre), Bacteroides fragilis (infecções intra-abdominais). Cada bactéria tem seu padrão de resistência e que muda a depender da epidemiologia local.
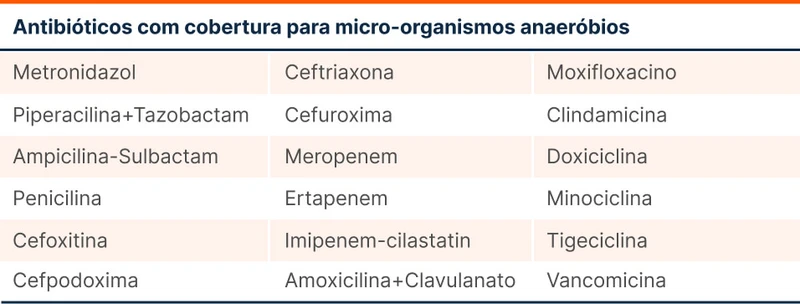
O Bacteroides fragilis tem aumentado sua resistência para clindamicina, cefalosporinas e quinolonas. Como a principal ocorrência dessa bactéria é nas infecções intra-abdominais, o uso isolado desses antibióticos deve ser evitado nesse cenário. Anaeróbios podem produzir betalactamases, limitando o efeito das cefalosporinas nesse cenário.
Vancomicina pode atuar contra anaeróbios gram positivos, como Clostridium. Penicilinas de amplo espectro com inibidores de betalactamases podem cobrir outras espécies de Clostridium, mas diferente da vancomicina, não possui ação contra Clostridium difficile.
E o trabalho?
Há uma relação estabelecida das bactérias do trato gastrointestinal com a ocorrência de pneumonia associada ao ventilador (PAV) e desfechos graves em pacientes críticos. Existem trabalhos pesquisando a descontaminação do trato gastrointestinal em pacientes já intubados na tentativa de reduzir PAV (veja o tópico "Prevenção de Pneumonia Hospitalar"). Com o aumento de terapias anti-anaeróbias em pacientes graves nos últimos anos, o trabalho em questão avaliou se isso poderia repercutir nos pacientes em ventilação mecânica
Esse estudo retrospectivo avaliou 3032 pacientes intubados que receberam pelo menos uma dose de antibioticoterapia. Os pesquisadores compararam os que usaram e os que não usaram antibióticos com cobertura anti-anaeróbica. O desfecho primário foi tempo livre de PAV, definido pelo tempo do momento da intubação até o diagnóstico de PAV ou de um óbito. Os grupos foram equilibrados em relação a gravidade da doença (APACHE IV médio de 89,9 versus 90,1) e de carga de comorbidades.
O trabalho encontrou que pacientes expostos à terapia anti-anaeróbia tiveram piores taxas de tempo livre de PAV em 30 dias (65% versus 72%) com significância estatística.
Em uma sub-análise de 116 pacientes deste estudo, foi avaliado a densidade de bactérias no intestino através de swab retal no início e após um período de internação. Os pacientes que utilizaram terapia anti-anaeróbica inicialmente apresentaram menor densidade de bactérias no swab retal, seguido posteriormente de uma expansão de enterobactérias, aumentando a população destas bactérias de maneira desproporcional em relação ao grupo controle.
Este estudo, apesar de retrospectivo, é mais um argumento no debate de racionalização do uso de antibióticos.