Clortalidona versus Hidroclorotiazida para Prevenção de Eventos Cardiovasculares
Existe uma briga entre os tiazídicos: entre clortalidona e hidroclorotiazida, qual mais protege de eventos cardiovasculares? Qual causa mais distúrbio eletrolítico? O New England Journal of Medicine (NEJM) publicou um estudo em dezembro de 2022 para responder essas questões [1].
Sobre os tiazídicos
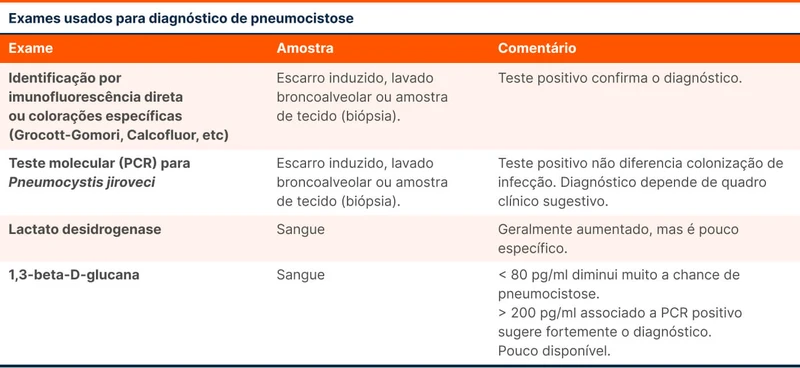
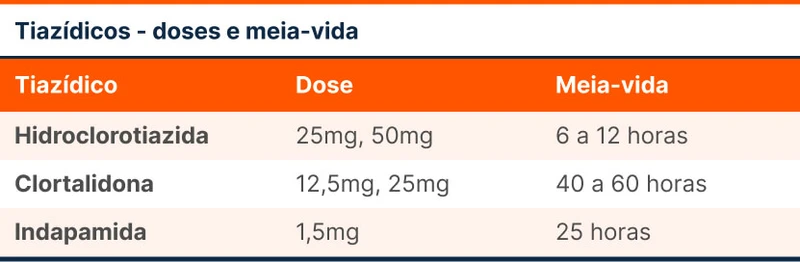
Clortalidona e hidroclorotiazida são os principais diuréticos tiazídicos. Apenas a hidroclorotiazida é um tiazídico verdadeiro. A clortalidona é considerada um "tiazídico-like'' por ser um derivado da sulfonamida que simula a ação dos tiazídicos. A meia vida dessas drogas é diferente, como visto na tabela 1.
Os tiazídicos são uma das primeiras escolhas no tratamento de hipertensão arterial (HAS), muito devido ao trabalho ALLHAT, que encontrou benefício em eventos cardiovasculares com essa droga [2]. Tiazídicos também podem ser utilizados na prevenção de cálculos renais formados por cálcio.
Alguns trabalhos anteriores relacionaram a clortalidona a um maior controle pressórico. Uma das possíveis explicações é a maior meia vida da clortalidona, quando comparada com a hidroclorotiazida. Devido a esses achados, o estudo SPRINT, um dos maiores sobre HAS, preferiu a clortalidona como o tiazídico de escolha [3].
Ao mesmo tempo, alguns trabalhos observacionais indicam maior taxa de distúrbios eletrolíticos em quem utilizava a clortalidona. Foi nesse contexto de dúvidas de benefícios e malefícios que o trabalho que motivou esse tópico foi feito.
O que o trabalho encontrou?
O estudo selecionou 13.523 pacientes com 65 anos ou mais que estavam utilizando hidroclorotiazida. Os pacientes foram randomizados para continuar com a hidroclorotiazida na dose que usavam (25mg ou 50mg) ou trocar para clortalidona na dose (12,5mg ou 25mg, respectivamente). A média de anti-hipertensivos em uso era 2,6 medicamentos e 94% dos pacientes randomizados estavam utilizando a dose de 25mg de hidroclorotiazida.
O desfecho primário foi um composto de síndrome coronariana aguda, acidente vascular cerebral, internação por insuficiência cardíaca e morte não relacionada à neoplasia.
Com uma média de seguimento de 2,4 anos, o estudo não encontrou diferença do desfecho primário entre os dois grupos. A única diferença encontrada foi uma incidência maior de hipocalemia no grupo clortalidona, porém sem repercussões clínicas.
Um dos problemas do estudo está no seu desenho. Como todos os pacientes utilizavam hidroclorotiazida antes da randomização, aqueles que foram randomizados para clortalidona tendiam a atribuir qualquer novo evento adverso à nova medicação. Isso contribuiu para uma maior troca de clortalidona para hidroclorotiazida (15,4% do grupo clortalidona trocou para hidroclorotiazida versus 3,8% do grupo hidroclorotiazida trocou para clortalidona).
Quem não pode utilizar tiazídicos?
É necessário atenção a distúrbios eletrolíticos. Os tiazídicos estão relacionados a hipocalemia (como visto no estudo) e hiponatremia. Pode ser necessário trocar de classe de anti-hipertensivo em casos mais graves desses distúrbios. Hiperglicemia e hiperuricemia também estão relacionados a essa classe.
Tiazídicos podem causar hipercalcemia. Muitos pacientes que desenvolvem hipercalcemia após introdução de tiazídicos possuem hiperparatireoidismo primário que foi desmascarado pela droga [4]. Se a hipercalcemia ocorrer, a droga deve ser suspensa e os níveis de cálcio e PTH reavaliados após três meses.
Na doença renal crônica avançada, acreditava-se que os tiazídicos não funcionavam ou causavam lesão renal. Esse receio foi abordado no estudo CLICK [5]. O trabalho encontrou que a clortalidona é efetiva em quem tem doença renal crônica estágio 4 (taxa de filtração entre 30 a 15 ml/min). Contudo, a medicação pode ocasionar uma piora da função renal, principalmente quando utilizada em conjunto com diurético de alça. Essa piora tende a reverter em 12 semanas após a introdução da droga. Acredita-se que essa oscilação da função renal pode estar relacionada a um melhor controle pressórico inicial, alterando a regulação hemodinâmica renal.
Existe um receio de alergia à clortalidona por ser um derivado da sulfonamida, mas o risco parece ser baixo.