Profilaxia de Hemorragia Digestiva Alta em Uso de Anticoagulação Oral
O American Journal of Medicine publicou em junho de 2022 uma revisão sistemática sobre a associação de terapia anti-secretora com hemorragia digestiva alta em pacientes em anticoagulação oral [1]. Vamos ver o que o estudo encontrou e revisar o tema.
Qual é o risco de sangramento?
O uso de anticoagulantes aumenta o risco de sangramento maior. Sangramento maior é definido como sangramento significativo com necessidade de hemotransfusão ou sangramento em sítio crítico (por exemplo, intracraniano ou com síndrome compartimental) ou necessidade de intervenção (cirurgia, endoscopia, etc).
O sítio mais comum é o trato gastrointestinal com cerca de 40% dos casos de sangramento em pacientes com anticoagulação oral [2-5].
Os inibidores de bomba de prótons (IBP) reduzem o risco de hemorragia digestiva alta em pacientes que usam ácido acetilsalicílico (AAS) e anti-inflamatórios não esteroidais (AINEs). No entanto, o uso de IBP em pacientes com anticoagulação permanente continua incerto porque estes pacientes foram excluídos da maioria desses estudos.
Inibidores de bomba de prótons
A proteção gástrica com um IBP é prescrita para muitas pessoas em anticoagulação terapêutica, especialmente aqueles com fatores de risco. Contudo, ainda existe incerteza sobre essa conduta, por conta da falta de estudos.
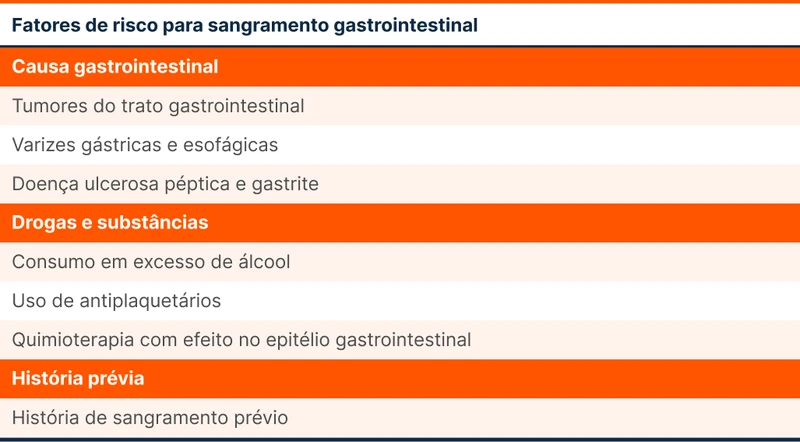
Os fatores de risco adicionais específicos de sangramento gastrointestinal podem ser divididos em três grupos e estão disponíveis na tabela 1.
Uma coorte retrospectiva de 2018 com mais de 1,6 milhão de pacientes que receberam um anticoagulante (a maioria por fibrilação atrial) encontrou que o uso concomitante de IBP se associou a um menor risco de hospitalização por sangramento gastrointestinal (taxa de incidência 0,66, IC 95% 0,62-0,69) [6]. A análise de subgrupos revelou que o efeito foi visto individualmente para cada anticoagulante. Os sangramentos que exigiram hospitalização ocorrem com maior probabilidade no grupo em uso de rivaroxabana.
O UpToDate orienta o uso de IBP em pacientes com histórico de sangramento gastrointestinal que não foram adequadamente tratados ou em indivíduos com maior risco, como aqueles com uso concomitante de AINE. Ressalta-se a preferência por IBP, pois há melhores evidências para o IBP do que para um bloqueador do receptor H2 (brH2).
O que o estudo acrescenta?
A revisão sistemática e metanálise publicada em junho de 2022 avaliou a associação de terapia anti-secretora, seja com IBP ou brH2, em pacientes anticoagulados na prevenção de hemorragia digestiva alta (HDA).
Os pacientes avaliados nos estudos deveriam ter mais de 18 anos e estar em uso de varfarina ou anticoagulante oral direto (DOAC), independente da dose. Os estudos deveriam comparar IBP ou brH2 com placebo ou ausência de terapia; ou comparar IBP com brH2. Pelo baixo número de ensaios clínicos randomizados, trabalhos observacionais também foram incluídos.
Foram excluídos trabalhos cuja terapia anti-secretora tinha recomendação clara de benefício (ver o tópico "Desprescrição de inibidores de bomba de prótons"). Também foram excluídos trabalhos que não controlavam pelo menos duas variáveis de confusão que interferissem no risco de sangramento.
Após a revisão sistemática, sete estudos eram elegíveis para metanálise, sendo dois de caso-controle, quatro coortes retrospectivas e um ensaio clínico randomizado. Apenas um estudo avaliou o brH2 como terapia anti-secretora.
Em pacientes anticoagulados, os IBPs foram associados a uma menor probabilidade de HDA, com um risco relativo de 0,67 (IC 95% CI 0,61, 0,74) e baixa heterogeneidade estatística (I² = 15%, p = 0,32). O tamanho do efeito protetor foi relativamente consistente em populações que utilizavam varfarina e DOACs.
O efeito foi maior em pacientes com maior risco de HDA - por exemplo, uso simultâneo de AINE ou AAS ou alta pontuação de risco de sangramento. O único estudo observacional avaliando a associação de brH2 com HDA encontrou um risco relativo de 0,69 (IC 95% 0,24-2,02).
O trabalho tem duas limitações importantes. A primeira é a possibilidade de vieses dos estudos, considerando principalmente os trabalhos observacionais. A segunda é a diversidade da população e dos métodos. Entretanto, os autores afirmam que a consistência da associação negativa entre IBPs e HDA nos estudos observacionais e a baixa heterogeneidade estatística na metanálise é animadora.
O uso de IBP parece prevenir HDA em pacientes em anticoagulação, mas o benefício varia bastante a depender do risco individual. Para aqueles sem fatores de risco adicionais, o benefício é mínimo. Para aqueles com fatores de risco, pode-se considerar a prescrição de um IBP para minimizar o risco de HDA.