Hiponatremia na Emergência
Hiponatremia é um dos distúrbios eletrolíticos mais comuns. O American Journal of Emergency Medicine publicou um artigo de revisão sobre o tema em outubro de 2022, com foco na perspectiva do médico na sala de emergência [1]. Vamos revisar esse tema neste tópico.
Entendendo a hiponatremia
Hiponatremia é um problema comum na sala de emergência, com uma prevalência de 3 a 10% a depender da coorte. Idosos e pacientes com agudização de doença renal crônica têm o distúrbio com maior frequência. A incidência aumenta no verão, provavelmente devido a maior estímulo a bebidas hipotônicas.
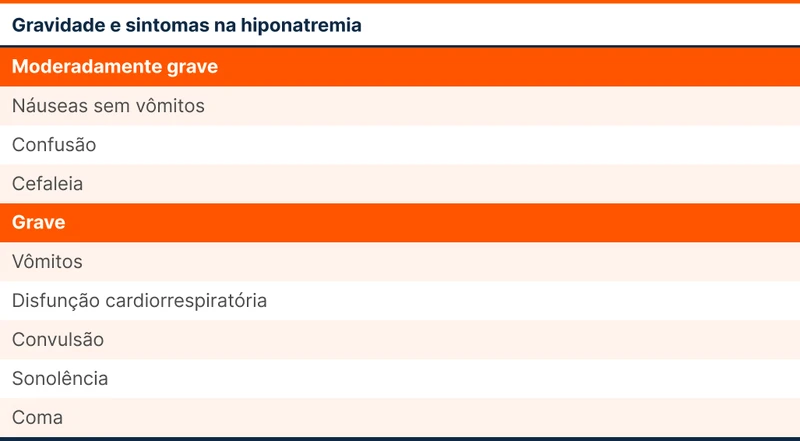
Os sintomas de hiponatremia variam muito, podendo ser leves e inespecíficos como mal-estar, até ameaçadores à vida como sintomas de edema cerebral. As queixas mais comuns no departamento de emergência são náusea, fraqueza muscular, vertigem e histórico de quedas. Os sintomas mais graves estão na tabela 1.
Hiponatremia que surge de maneira súbita é o maior preditor do aparecimento de sintomas graves.
Durante um estado de hiponatremia, o meio extracelular fica hiposmolar. O cérebro se adapta através da excreção de solutos do meio intra para o extracelular. Esse mecanismo de defesa demanda tempo. Na hiponatremia súbita, o meio extracelular se torna hiposmolar muito rápido, dificultando a adaptação. O resultado é um fluxo de água do sangue para o cérebro, ocasionando edema.
Primeiro passo
As primeiras coisas a serem feitas diante de uma hiponatremia no departamento de emergência são:
- Afastar que a hiponatremia é por hiperglicemia ou pseudohiponatremia. Hiponatremia por hiperglicemia é uma hiponatremia hiperosmolar e não causa os sintomas de edema cerebral. Pseudohiponatremia é suspeitada quando a história é compatível com hipertrigliceridemia ou hiperproteinemia (ex.: pancreatite por hipertrigliceridemia, xantomas eruptivos, quadro clínico sugestivo de mieloma).
- Avaliar função renal e outros eletrólitos. Principalmente potássio, já que a coexistência com outros distúrbios eletrolíticos é comum.
- Identificar se o paciente possui sintomas moderados a graves e avaliar se esses sintomas são explicados pela hiponatremia.
Diante de um paciente com hiponatremia aguda - menos de 48 horas de instalação - e com sintomas graves, deve-se infundir 150 ml de NaCl 3% (ou 2 ml/kg) em um período de 20 minutos. O sódio sérico deve ser medido novamente após 20 minutos do fim da infusão. O objetivo desse tratamento é aumentar a concentração sérica de sódio em 5 mmol/L.
Caso o paciente ainda mantenha sintomas e a meta de 5 mmol/L não tenha sido atingida, deve-se repetir a infusão, repetindo também a dosagem do sódio sérico. Se o sódio aumentar 5 mmol/L ou mais e o paciente mantiver sintomas de edema cerebral, deve-se investigar outras causas. A hipótese nessa situação é de que a hiponatremia seja apenas uma consequência de um outro processo no sistema nervoso central responsável pelos sintomas.
O limite de aumento do sódio é de 8 a 10 mmol/L em 24 horas. Após correção, o sódio deve ser monitorizado a cada 4 a 6 horas, a depender da gravidade.
A diretriz europeia sugere tratar pacientes com sintomas moderadamente graves de maneira similar aos pacientes com sintomas graves [2]. Contudo, por conta da falta de evidência nesse cenário, a diretriz faz a ponderação de que pode haver tempo para procurar a etiologia da hiponatremia e tratar a causa.
Na urgência, uma solução de NaCl próxima de 3% pode ser feita através da combinação de 100 ml de NaCl 0,9% e 10 ml de NaCl 20%. Isto resulta em uma solução de 110 ml de NaCl 2,6%.
Pacientes assintomáticos
Em pacientes assintomáticos, a primeira etapa é classificar se o distúrbio é agudo (em menos de 48 horas) e se houve queda de mais de 10 mmol/L de sódio nesse período. Nesses casos, o paciente pode ser tratado como os pacientes sintomáticos.
Caso o distúrbio não seja agudo ou não exista comprovação se é agudo ou não, a causa da hiponatremia deve ser tratada, principalmente quando há uma etiologia óbvia, como pacientes nos extremos da volemia (expansão volêmica para pacientes hipovolêmicos e restrição de fluidos para pacientes hipervolêmicos). Medicações que causam ou contribuem com a hiponatremia devem ser suspensas, como tiazídicos e outros diuréticos.
O artigo de revisão se posiciona contra iniciar o manejo de um paciente com hiponatremia crônica e assintomática no departamento de emergência. Esses pacientes necessitam de uma abordagem diagnóstica complexa e a terapia empírica errada pode agravar a hiponatremia ou falsear exames como o sódio urinário.
Supercorreção
Durante a correção da hiponatremia, o valor do sódio pode seguir um curso impreciso e se elevar acima do limite (8 a 10 mmol/L em 24 horas). Isso pode resultar em síndrome de desmielinização osmótica (SDO). Essa síndrome também pode ocorrer quando o sódio está em um nível normal, mas que se eleva abruptamente, como em pacientes fazendo infusão de soluções com alta concentração de sódio.
A SDO pode ocasionar alteração do nível de consciência e fraqueza muscular com padrão de primeiro neurônio motor. Os sintomas tipicamente surgem de 2 a 6 dias após a supercorreção. Na suspeita de SDO, deve-se solicitar ressonância magnética de crânio que pode mostrar alterações sugestivas de desmielinização.
Não há tratamento para SDO com boas evidências. Algumas terapias experimentais incluem corticoide, imunoglobulina e plasmaférese.
O escore SHOR (veja a tabela 2) discrimina pacientes com alto risco para supercorreção [3]. A correção do sódio nesses pacientes deve ser feita de maneira mais gradual e com maior vigilância.
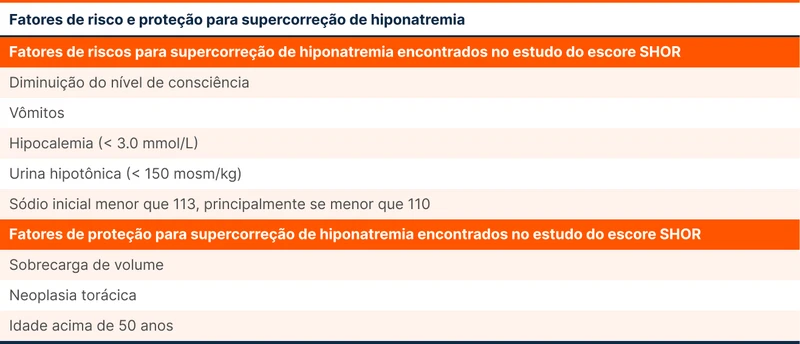
Caso ocorra supercorreção, deve-se reduzir com urgência os valores de sódio para abaixo do limite recomendado. Isso pode ser feito com solução de glicose (2 a 3 ml/kg/hora) associado ou não a desmopressina via intravenosa (2–4 μg a cada 6-8 horas).