Nefropatia por Contraste
Há décadas, a infusão de contraste iodado tem sido associada a lesão renal aguda. Em janeiro de 2023, a Intensive Care Medicine publicou um estudo sobre nefropatia induzida por contraste em pacientes com lesão renal aguda pré-existente [1]. Aproveitamos a publicação para revisar e atualizar o tema neste tópico.
O que é nefropatia induzida por contraste e quem é o paciente de risco?
Nefropatia induzida por contraste (NIC) é definida por uma piora da função renal (> 0,3 mg/dL de creatinina) nas primeiras 24 a 48 horas após a infusão de contraste iodado em pacientes sem outros fatores para lesão renal aguda (LRA). Outro termo utilizado é nefropatia associada ao contraste (NAC), usado para situações em que não é possível estabelecer causalidade com o contraste por existirem outros fatores de risco para LRA que geram confusão.
O conceito de NIC surgiu na década de 60, baseado principalmente em relatos de casos e experimentos em animais. Apesar de ser uma ideia bastante aceita, o real papel dos contrastes iodados no desenvolvimento de LRA é motivo de debate [2]. Na época dos primeiros estudos de NIC, predominavam os contrastes de primeira geração, que eram hiperosmolares (> 1.400 mOsm/kg), com potencialmente maior risco. Além disso, muitos estudos não tinham grupo controle e misturavam indicações diferentes de uso do contraste (angiografia de coronárias e tomografia, por exemplo).
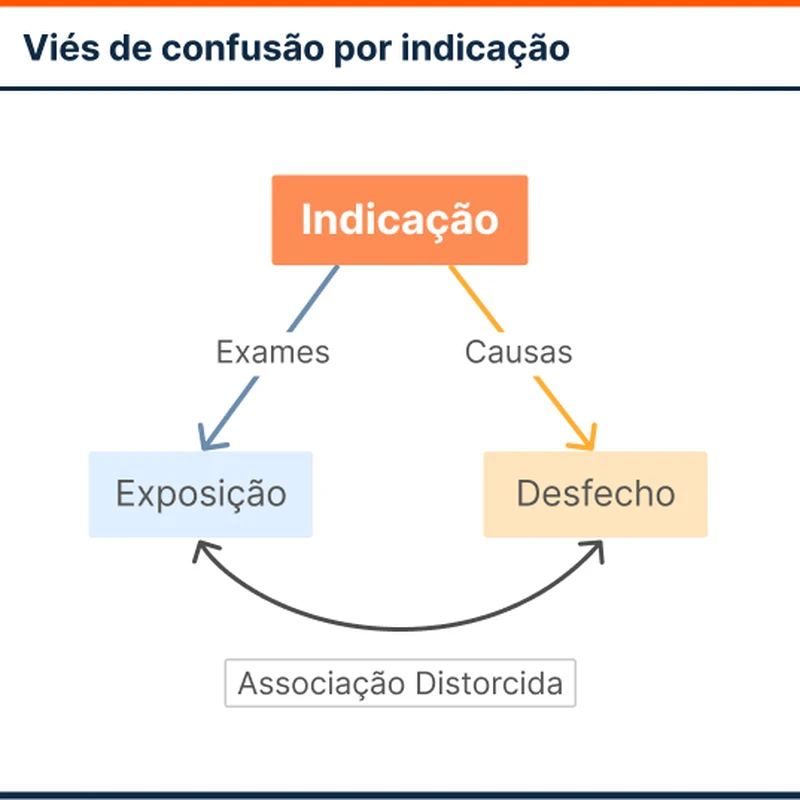
Alguns estudos recentes não encontraram associação independente entre o uso de contraste iodado e LRA. [3-6]. Uma possível explicação para essa inconsistência é o viés de confusão por indicação. Nesse viés, atribui-se falsamente um desfecho (lesão renal aguda) a uma exposição (uso de contraste), quando a real causa do desfecho é o motivo da exposição. Assim, pacientes que precisam de exames contrastados possuem uma série de fatores (comorbidades, doenças agudas, uso de nefrotóxicos, hipovolemia) que respondem tanto pela necessidade de realizar um exame contrastado quanto pelo risco aumentado de LRA.
Na tentativa de encontrar indivíduos com maior risco de NIC, um estudo estratificou os pacientes por taxa de filtração glomerular (TFG) [7]. Os pesquisadores encontraram associação de NIC com TFG < 30 mL/min/1.73m² e uma tendência a associação com TFG entre 30 e 44. Não observou-se associação para TFG ≥ 45. Assim, considera-se TFG prévia < 45 como risco de NIC, sendo esse risco maior quando TFG < 30.
Quais pacientes devem receber profilaxia?
Segundo o consenso da American College of Radiology e National Kidney Foundation de 2020, os seguintes grupos devem receber profilaxia:
- Pacientes com LRA
- Pacientes com TFG menor que 30 mL/min/1.73m² e que não estão em regime de hemodiálise
Em pacientes com TFG de 30 a 44, pode-se considerar a profilaxia quando existem múltiplos fatores de risco (hipertensão, diabetes, LRA recente ou TFG limítrofe). O documento reforça que a presença de diabetes não deve ser fator único para considerar profilaxia nesta faixa de TFG.
A profilaxia deve ser feita com NaCl 0,9% em um volume de 1 a 3 mL/kg/hora, de uma hora antes do procedimento até 3 a 12 horas após. A infusão de solução bicarbonatada pode ser uma opção, mas não acrescenta benefício, necessita de manipulação e tem custo maior [8-11].
O principal risco da profilaxia é hipervolemia, devendo-se evitar em pacientes com sinais de congestão [12].
O consenso reforça que TFG < 30 não deve ser uma contraindicação absoluta ao uso de contraste iodado e exames de urgência e emergência não devem ser postergados pelo risco de NAC.
A recomendação expõe que para pacientes com LRA pré-existente as evidências são ainda mais limitadas.
O que o estudo acrescenta?
O estudo avaliou a associação entre administração de contraste iodado com LRA persistente em indivíduos com LRA pré-existente. Foi um estudo retrospectivo que analisou uma coorte de visitas ao departamento de emergência de 3 hospitais dos Estados Unidos, sendo incluídos pacientes adultos e que fechavam critérios para LRA baseado na definição do Kidney Disease: Improving Global Outcomes (KDIGO). O desfecho primário avaliado foi LRA persistente, com desfecho secundário de necessidade de hemodiálise em 180 dias.
Ao todo foram 14.449 visitas ao departamento de emergência, sendo que o contraste foi administrado em 2.659 destas visitas. Os grupos apresentavam características semelhantes (marcadores de gravidade, comorbidades e função renal inicial), exceto que os que receberam contraste eram comparativamente mais jovens e mulheres.
Não foi encontrado associação independente entre administração de contraste e LRA persistente, achado mantido ao ajuste para confundidores. Resultado semelhante foi encontrado quando analisados subgrupos de pacientes com TFG < 30 e pacientes admitidos em UTI. Além disso, o uso de contraste também não associou-se com início de diálise em 180 dias.
Este estudo fortalece as evidências mais recentes que não mostram causalidade do uso de contraste com disfunção renal. Na prática, reforça que exames contrastados, quando bem indicados em situações de urgência e emergência, não devem sofrer atrasos pelo possível risco de nefropatia. Deve-se evitar nefrotóxicos quando possível e considerar profilaxia em pacientes sem contraindicação.