Tratamento de Tromboembolismo Pulmonar de Alto Risco
Até 5% dos pacientes com tromboembolismo pulmonar agudo (TEP) evoluem com instabilidade hemodinâmica, com uma mortalidade que pode chegar a 20%. Em agosto de 2022, saiu uma revisão e atualização sobre o tratamento de pacientes com TEP de alto risco no Journal of Clinical Medicine [1]. Aproveitamos para revisar os principais pontos dessa condição neste tópico.
Quando classificar um TEP como alto risco?
A diretriz de 2019 estratifica o TEP agudo baseado na mortalidade em 30 dias. Nesse sentido, os pacientes são classificados em baixo, intermediário e alto risco (veja tabela 1) [2]. Veja mais sobre estratificação no tópico "Tromboembolismo Pulmonar".
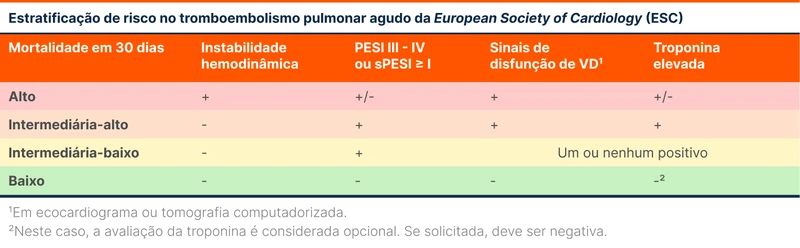
Os pacientes de alto risco são os que apresentam instabilidade hemodinâmica. Assim, entram nessa categoria aqueles que se encaixam em quaisquer das situações abaixo:
- Hipotensão persistente - Pressão arterial sistólica (PAS) < 90 mmHg ou queda ≥ 40 mmHg na PAS por mais de 15 minutos, sem outras causas esclarecidas (sepse, hipovolemia, etc.).
- Choque obstrutivo - hipotensão (PAS < 90 mmHg ou uso de vasopressores) E sinais de hipoperfusão orgânica (rebaixamento do nível de consciência, extremidades frias, tempo de enchimento prolongado, etc.).
- Parada cardiorespiratória.
Os pacientes com TEP de alto risco estão em um espectro de gravidade (veja figura 1). O desenvolvimento dessa forma mais grave ocorre inicialmente por disfunção gradual do ventrículo direito (VD), seguido por comprometimento do ventrículo esquerdo (VE) e choque.

Na maioria das vezes, o choque apresenta-se com hipotensão. Contudo, em alguns casos, pode ocorrer hipoperfusão sem hipotensão absoluta. Em casos de deterioração, estes pacientes também podem ser considerados como alto risco e elegíveis para trombólise, mesmo sem hipotensão [3, 4].
Papel da ecocardiografia à beira-leito (POCUS)
O POCUS é uma ferramenta muito útil para o paciente com TEP de alto risco. Em um paciente instável, a ausência de sinais de sobrecarga de VD praticamente exclui o TEP como causa da instabilidade.
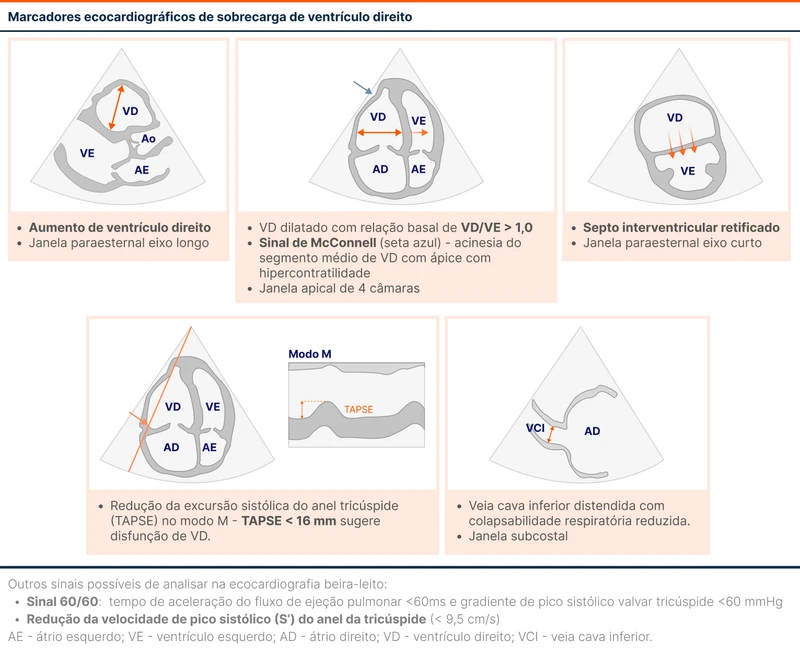
O POCUS também ajuda a reforçar a suspeita de TEP em um choque sem causa definida. Se o paciente está instável, tem alta probabilidade pré-teste de TEP e sinais inequívocos de sobrecarga de VD no POCUS (veja figura 2), a terapia de reperfusão está justificada. Essa alternativa é útil especialmente em cenários de impossibilidade de realização de angiotomografia [2].
Anticoagulação e trombólise
Segundo a diretriz da ESC, pacientes com probabilidade de TEP intermediária e alta pelo escore de Wells devem ser anticoagulados enquanto esperam os resultados dos exames diagnósticos. Esta recomendação considera o atraso comum no diagnóstico de TEP, em média de 2,4 horas em centros dos Estados Unidos. Além disso, há um potencial benefício de anticoagulação empírica. Isso ocorre principalmente quando o atraso esperado é maior que 2,3 horas para probabilidade intermediária e 20 minutos para probabilidade alta [5].
Inicialmente, a anticoagulação de escolha no pacientes de alto risco deve ser a heparina não fracionada (HNF) pela facilidade de manejo durante a trombólise. A infusão de HNF pode ser interrompida durante a administração do trombolítico e retornada após o seu término. Em casos de sangramento grave, há a possibilidade de reversão do anticoagulante com a protamina.
Existem dados de segurança que respaldam o início de heparina de baixo peso molecular (HBPM), fondaparinux e rivaroxabana após 24 horas da infusão do trombolítico em pacientes com evolução estável [6, 7].
Terapias de reperfusão
A trombólise sistêmica com dose completa é o tratamento inicial de escolha em pacientes com TEP de alto risco. Essa é a terapia mais estudada e é mais facilmente aplicável quando comparada a técnicas cirúrgicas. O maior benefício é nas primeiras 48 horas do início dos sintomas, mas pode ser considerada em até 14 dias do início do quadro [8].
O principal risco da trombólise é o sangramento grave, especialmente o intracraniano. Por conta desse risco, alguns estudos retrospectivos compararam doses menores com as doses completas de trombolítico. Um estudo recente comparou a dose de 50 mg de alteplase com a dose completa de 100 mg [9]. Os pacientes que receberam a dose de 50 mg tiveram maior chance de necessitar de nova dose de trombolítico ou cirurgia de resgate, sem que houvesse redução nos sangramentos ou na necessidade de transfusão. Portanto, a recomendação atual é de utilizar as doses completas, conforme especificado na tabela 2, sempre levando em consideração as contraindicações.

A terapia direcionada por cateter, tanto com trombólise in situ quanto com tromboaspiração, é reservada para pacientes que falham com trombólise ou que tem contraindicação (recomendação classe IIa, diretriz da ESC 2019). A embolectomia cirúrgica também é recomendada em casos de resgate após trombólise ou com contraindicação ao trombolítico (recomendação classe I).