Abordagem à Elevação de Enzimas Hepáticas
Marcadores de lesão e função hepática são exames comuns dentro e fora do hospital. Aproveitando uma revisão recente, vamos aprofundar no assunto [1].
Quais os principais marcadores de lesão e função hepática?
Aspartato aminotransferase (AST/TGO) e alanina aminotransferase (ALT/TGP) são conhecidas como transaminases. São marcadores de lesão hepatocelular, mas podem estar presentes em outros tecidos (ex.: músculo). A ALT é mais específica para lesão hepática do que a AST. Os valores de normalidade variam conforme o laboratório.
Fosfatase alcalina (FA) e gama-glutamil transferase (GGT) são enzimas presentes no trato biliar. FA também está presente no osso e GGT em vários outros tecidos (ex.: pâncreas, rim, vesículas seminais). A elevação de GGT é indicativa para doença biliar quando há elevação de outros marcadores de lesão em conjunto.
Albumina é uma proteína utilizada como marcador de função hepática. Várias outras causas podem reduzir a albumina. Essa proteína é considerada um marcador inflamatório negativo, pois está reduzida em inflamação sistêmica. O valor de normalidade está entre 3,5 e 5.
O INR/TAP reflete a atividade de fatores de coagulação produzidos no fígado. Também é um marcador de função. O TTPa não aumenta tanto quanto o TAP. A razão é que o fator VIII e o fator de von Willebrand (envolvidos no TTPa) são produzidos em outros órgãos além do fígado. TAP e TTPa não são marcadores fidedignos do risco de sangramento em pacientes cirróticos.
A bilirrubina não é um marcador de função propriamente. Contudo, sua excreção e conjugação estão relacionadas à função hepática como um todo.
Reconhecendo padrões de elevação
Para interpretar os marcadores de lesão hepática é necessário reconhecer o padrão da alteração.
A primeira etapa é dividida em padrão hepatocelular (predomínio de AST e ALT) e colestático (FA e GGT). O segundo passo é classificar em agudo ( < 6 semanas), subagudo (6 semanas e 6 meses) ou crônico (> 6 meses).
Nem sempre é fácil identificar o padrão. Todas as enzimas se elevam em conjunto e possuem valores de referência diferentes. Um valor de 60 é alto para ALT, mas é normal para FA.
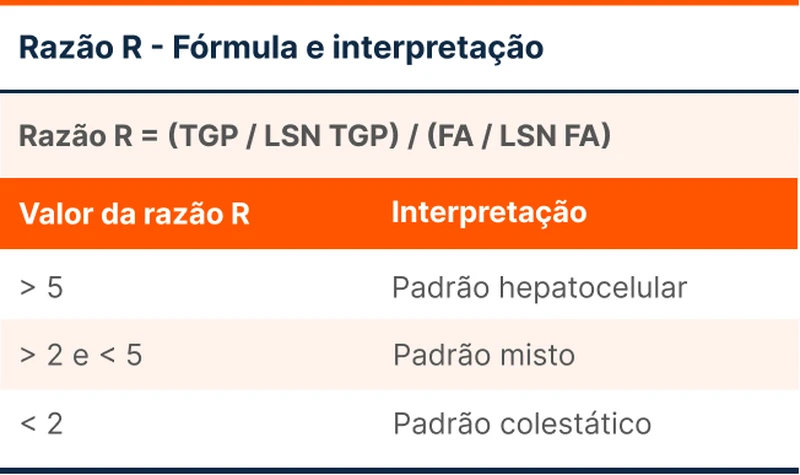
Para auxiliar na comparação, deve-se utilizar o limite superior da normalidade (LSN). O valor do exame deve ser dividido pelo LSN, com o objetivo de saber quantas vezes acima do LSN está aumentado. Em seguida, compara-se o valores de ALT e FA na razão R, expressa na Tabela 1 (use também esta calculadora para a Razão R).
Padrão hepatocelular e colestático
O padrão hepatocelular pode ser dividido em leve ( < 5x o LSN), moderado (entre 5 e 15x o LSN), grave (> 15x o LSN). Apesar da nomenclatura, o nível de elevação não se correlaciona bem com gravidade, porém auxilia no diagnóstico diferencial.
Aumentos leves são comuns na prática. Em geral são por medicações, álcool ou doenças hepáticas crônicas. Aumentos moderados a graves ocorrem por exacerbações agudas de doenças hepáticas (especialmente hepatite B, doença de Wilson, hepatite viral aguda e hepatite autoimune), lesão hepática induzida por droga (DILI) e lesão hepática isquêmica. Em casos de obstrução biliar, aumentos expressivos podem ocorrer, resolvido rapidamente após alívio do fator obstrutivo.
O padrão colestático se caracteriza pelo aumento de FA. A GGT é utilizada para corroborar que a origem da FA é colestase e não doença óssea. Obstruções anatômicas e doenças autoimunes são as causas que mais levam a esse padrão.
Como abordar estas alterações?
A primeira etapa é sempre perguntar sobre uso de medicações, fitoterápicos, drogas e álcool.
Se o padrão for hepatocelular, sorologias virais e ultrassonografia (USG) são a primeira linha de investigações. O USG auxilia na busca por DHGNA (doença hepática gordurosa não alcoólica) e doenças macroscópicas (abscessos, litíase) que eventualmente podem elevar as transaminases. Caso esses exames não esclareçam, doenças autoimunes são os próximos suspeitos.
Se o quadro se mantiver obscuro, doenças raras como doença de Wilson e deficiência de alfa-1 antitripsina devem ser procuradas. Por fim, se as transaminases se mantiverem elevadas e nenhum exame tiver esclarecido, a biópsia deve ser considerada.
Se o padrão for colestático, a hipótese inicial é uma obstrução anatômica. O USG costuma ser o primeiro exame, mas a colangioressonancia e a colangiopancreatografia retrógrada endoscópica (CPRE) podem auxiliar. Caso nenhum fator anatômico seja encontrado, uma causa intra-hepática de colestase devem ser responsáveis pelo quadro. O anticorpo antimitocôndria (AMA) deve ser solicitado nesse cenário. Outras etiologias devem ser consideradas se o quadro se mantiver obscuro, como: nutrição parenteral total, drogas, colestase da gravidez.