Avaliação de Cálculo Ureteral
Em fevereiro de 2023, o American Journal of Emergency Medicine publicou o estudo CURIOUS sobre o uso de tomografia computadorizada na avaliação de cálculo ureteral na emergência [1]. Este tópico revisa a investigação de cálculo ureteral no pronto socorro e traz o que o estudo acrescenta.
Apresentação clínica
Dor é o sintoma mais comum de cálculo ureteral, sendo tipicamente em cólica. As crises de dor intensa duram de 20 a 60 minutos.
Quando a obstrução ocorrer na pelve renal ou no ureter proximal, espera-se dor em flanco. Se a obstrução ocorrer no ureter distal, a dor pode irradiar para testículo ou grande lábio ipsilateral. Apesar dos padrões descritos, esse sintoma não é suficiente para definir a localização do cálculo.
Hematúria, macroscópica ou microscópica, ocorre na maioria dos pacientes com litíase sintomática. Por outro lado, a ausência de hematúria não exclui o diagnóstico, pois não é detectada em 10 a 30% dos pacientes com nefrolitíase [2-6]. O tempo entre o início da dor e a realização do exame de urina influencia o resultado desse achado, tendo menor presença após o terceiro dia [5].
Outros sintomas como náuseas, vômitos, disúria e urgência urinária também podem estar presentes. A presença de infecção urinária associada a cálculo ureteral requer intervenção urológica de emergência devido à potencial gravidade do quadro.
Como fazer o diagnóstico?
Indica-se avaliação da função renal e exame de urina para detectar a presença de hematúria em toda suspeita de cálculo ureteral.
A tomografia computadorizada (TC) sem contraste é o padrão ouro para o diagnóstico radiológico em casos suspeitos.
O protocolo de TC com baixa dose de radiação é a escolha na maioria dos adultos por ter um bom desempenho para detectar hidronefrose e alta acurácia para identificar nefrolitíase (sensibilidade 97% e especificidade 95%) [7-10].
A TC com dose padrão de radiação tem sensibilidade > 94% e especificidade > 97% para detectar litíase ureteral [7, 8, 11]. Na avaliação do tamanho do cálculo os dois métodos têm resultados equivalentes [12]. A TC com baixa dose é menos acurada em pacientes com IMC > 30 kg/m² e para detectar cálculos menores que 2 mm.
Quando não é possível realizar a TC, a ultrassonografia de rins e vias urinárias (USRV) associada ou não com a radiografia de abdome é a segunda escolha. A sensibilidade e especificidade da USRV para identificação de hidronefrose é de 81% e 100%, respectivamente, variando entre as diversas referências [1]. Outras opções, como ressonância magnética de abdome e pelve e pielografia intravenosa, só devem ser consideradas na impossibilidade de realizar TC ou USRV.
A hidronefrose pode ser detectada com precisão usando ultrassonografia à beira leito ( point-of-care ultrasound - POCUS), sendo um achado que reforça a suspeita de cálculo. A presença de hidronefrose aumenta o risco de complicações subsequentes. A ausência de hidronefrose no POCUS é insuficiente para excluir cálculos.
Quando comparado a TC, o POCUS tem sensibilidade de 70% e especificidade de 75% para detectar hidronefrose [13-16]. A menor especificidade do POCUS em comparação com a ultrassonografia tradicional pode ser devido a resultados falso positivos como cistos parapiélicos, malformações vasculares e outros confundidores.
Uma estratégia diagnóstica simples e segura para identificar pacientes de baixo risco sem utilizar TC ainda não está definida.
Falamos sobre abordagem no pronto socorro e avaliação da composição do cálculo no Episódio 110: Litíase renal.
O que o estudo acrescenta?
O trabalho CURIOUS é uma coorte retrospectiva com 4000 adultos atendidos numa emergência na Califórnia. Todos os pacientes foram submetidos a uma TC por suspeita de cálculo ureteral entre janeiro de 2016 a dezembro de 2020.
O desfecho primário foi a presença de cálculo clinicamente importante, definido como cálculo no trato urinário ou distal à junção ureteropélvica que resulta em hospitalização ou procedimento urológico dentro de 60 dias. O objetivo do estudo foi criar um fluxograma para orientar a indicação de imagem baseado no risco de litíase clinicamente importante. Os pesquisadores desenvolveram o fluxograma e aplicaram na população estudada. A ferramenta avaliava a presença de hidronefrose (avaliada por ultrassonografia), hematúria e história de cálculo.
Um cálculo clinicamente importante foi encontrado em 354 pacientes. Assumindo uma probabilidade de pelo menos 2% de ter um cálculo, o fluxograma de decisão clínica (ver fluxograma 1) previu litíase clinicamente importante com sensibilidade de 95%, especificidade de 59%, valor preditivo positivo de 18% e valor preditivo negativo de 99,3% . A área sob a curva ROC do fluxograma foi de 0,81.
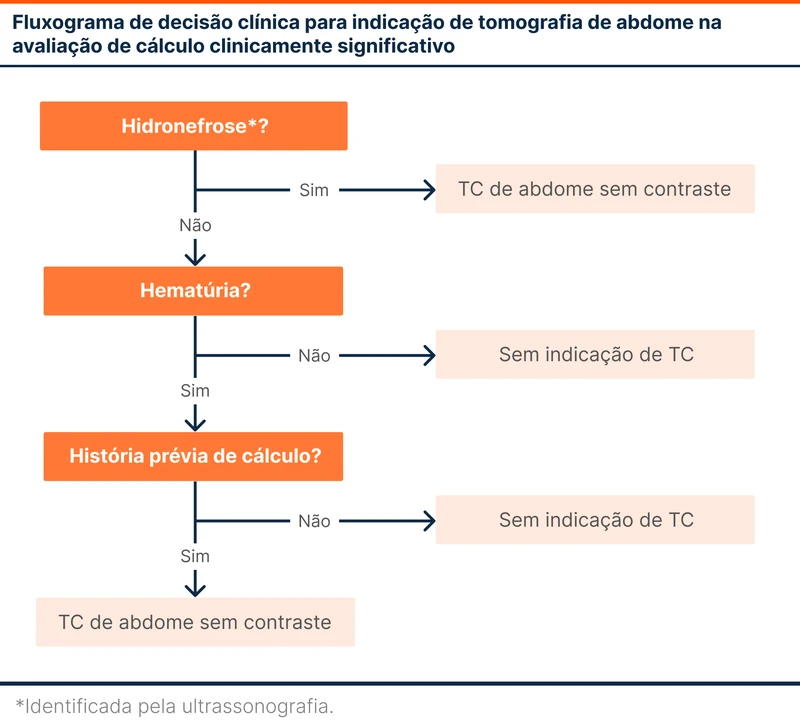
A aplicação desta regra de decisão clínica às decisões de imagem teria levado a 63% menos TCs com uma taxa de classificação inadequada de apenas 0,4%.
Uma limitação foi a aplicação do fluxograma de decisão somente nos pacientes que foram submetidos à TC por suspeita de cálculo ureteral. O fluxograma não se aplica em pacientes com hipótese de cólica nefrética que não realizaram a TC porque a ultrassonografia ou o histórico eram suficientes para o diagnóstico.
Apesar de eficiente, o fluxograma precisa de validação para ser formalmente recomendado.