Benzodiazepínicos, Drogas-Z e Quedas
Benzodiazepínicos e agonistas de seus receptores - as "drogas Z" - são medicações para manejo de condições como insônia e ansiedade. Possuem efeitos adversos graves, incluindo dependência, quedas e fraturas. Uma revisão sobre o risco de quedas com o uso dessas drogas foi publicada pelo Jornal da European Geriatric Medicine em dezembro de 2022 e aproveitamos para trazer detalhes a respeito do assunto [1].
Quedas provocadas por benzodiazepínicos e drogas-Z
Quedas são eventos frequentes, especialmente em pessoas acima de 65 anos. Estima-se uma queda por ano em um terço desta população. Dentre as diversas consequências das quedas, destacam-se internações, fraturas e mortalidade - implicando em cerca de 600 mil mortes por este mecanismo. Um dos fatores de risco de quedas mais frequente e modificável é o uso de medicações psicotrópicas. Diversos estudos já demonstraram que benzodiazepínicos e drogas-Z (zolpidem e zopiclona) aumentam a incidência de quedas [2-4].
Os mecanismos que aumentam o risco de quedas relacionado aos benzodiazepínicos e drogas-Z incluem a própria sedação pelas medicações, mas também a ocorrência de delirium, hipotensão ortostática, transtornos do movimento (fraqueza e sintomas extrapiramidais) e alterações visuais [1, 3].
Nos idosos, os efeitos adversos com essas medicações são mais comuns. Isso ocorre por [1-3, 5]:
- Alteração da farmacocinética devido à mudança da composição corporal
- Interação medicamentosa em uma população com maior prevalência de polifarmácia
- Coexistência de outras condições que também aumentam o risco de quedas (transtornos do movimento, déficits sensoriais, etc)
Quais são as alternativas para benzodiazepínicos e drogas-Z?
Benzodiazepínicos e as drogas-Z são frequentemente prescritos para o manejo de insônia e ansiedade. No entanto, seu benefício se sustenta, em média, por 4 semanas. Após esse período, a eficácia no controle dessas condições diminui, enquanto os efeitos adversos permanecem [1, 2].
Manejo adequado de insônia crônica
O manejo de pacientes com insônia primária crônica tem como base a terapia não farmacológica. Terapia cognitivo comportamental, associada a estratégias como higiene do sono, são a primeira linha de tratamento [1, 2].
Pacientes com insônia crônica devem ter uma avaliação minuciosa de fatores que perpetuam a condição - averiguando especialmente as medicações. Entre essas, merecem destaque os alfa e beta bloqueadores, corticoesteroides e inibidores de acetilcolinesterase [1].
Casos específicos podem necessitar de terapia farmacológica, como melatonina [3]. As opções terapêuticas foram melhor detalhadas no episódio de insônia.
Manejo adequado do transtorno de ansiedade
No contexto do transtorno de ansiedade generalizada (TAG), os benzodiazepínicos têm ainda menor evidência. Devem ser reservados para casos graves ou refratários.
A primeira linha para o manejo é sempre não farmacológica - com destaque novamente para a terapia cognitivo-comportamental. Estratégias farmacológicas também podem ser usadas, sendo a escolha os inibidores de recaptação de serotonina ou inibidores de recaptação duais (serotonina e noradrenalina) [1, 3].
Como desprescrever benzodiazepínicos e drogas-Z?
Desprescrição é o processo sistemático de descontinuação ou redução gradual de medicamentos inadequados [6]. A desprescrição de benzodiazepínicos e drogas-Z deve ser lenta, com o objetivo de evitar síndrome de retirada da medicação ou abstinência e piora de sintomas previamente controlados, como ansiedade [2].
O fluxograma 1 detalha as características de pacientes que se beneficiam da desprescrição dos benzodiazepínicos e drogas-Z. Alguns protocolos de desprescrição já foram criados para facilitar o controle do processo. A maioria deles recomenda redução em 25% da dose a cada 2 semanas, como discutido no episódio TdC em bolus - como desmamar benzodiazepínico [2, 7].
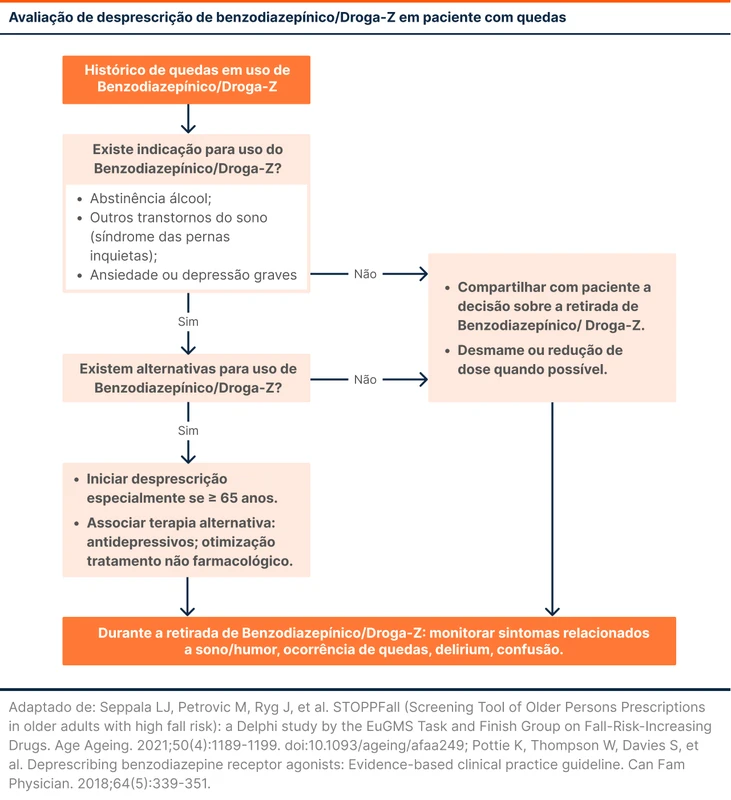
Durante a desprescrição, deve-se atentar a sintomas como irritabilidade, sudorese, cefaleia, delirium e convulsões. O paciente deve ser informado quanto a esses efeitos e os benefícios da descontinuação da medicação sempre devem ser enfatizados [1].