Videolaringoscopia versus Laringoscopia Direta no Paciente Crítico
O videolaringoscópio (VL) é reconhecido como uma ferramenta para otimizar a visualização durante a intubação. Sua capacidade de reduzir falhas na primeira tentativa de intubação ainda é uma dúvida. Em junho de 2023, foi publicado o estudo DEVICE no New England Journal of Medicine, avaliando o uso do VL na intubação [1]. Este tópico revisa a técnica de videolaringoscopia e traz detalhes do estudo.
Tipos de videolaringoscópio
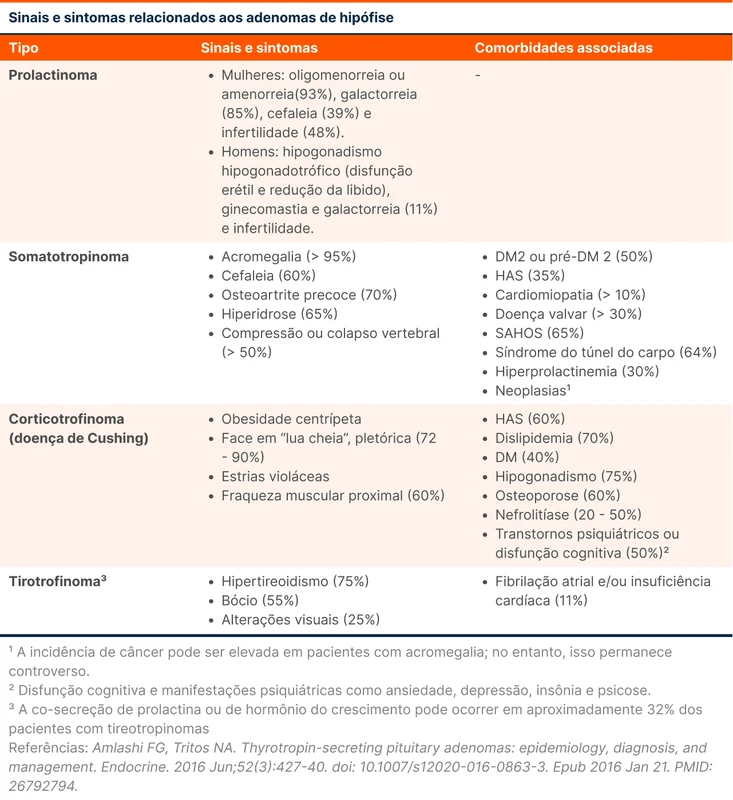
Existem algumas empresas que produzem videolaringoscópios, sendo as principais marcas o C-MAC (da Karl Storz™) e o GlideScope (da Verathon™). Os VL devem ser classificados de acordo com o formato da lâmina (veja figura 1) e a técnica de laringoscopia varia de acordo com essa classificação:
- Lâmina com geometria padrão - como a lâmina Macintosh dos laringoscópios diretos (lâmina curva padrão)
- Lâmina hiperangulada - presença de uma angulação (por volta de 60º) na ponta da lâmina, criada para otimizar a visão laríngea
Além disso, as lâminas curvas podem ter presença de um canal para guiar a passagem do tubo orotraqueal.
Os potenciais benefícios da videolaringoscopia são [2-4]:
- Otimização da visualização laríngea
- Visualização da via aérea por profissionais auxiliares
- Documentação para uso acadêmico
- Potencial benefício no sucesso na primeira tentativa de intubação
O VL é empregado principalmente em pacientes com preditores de via aérea difícil e sua taxa de sucesso depende do treinamento do operador [5]. A técnica de videolaringoscopia difere da laringoscopia direta (LD).
O que muda na técnica de videolaringoscopia?
Ser treinado no uso da laringoscopia direta não garante sucesso no uso do VL [6]. Características técnicas da videolaringoscopia devem ser reconhecidas especialmente de acordo com a lâmina utilizada (padrão ou hiperangulada).
Algumas particularidades da videolaringoscopia são comuns para as lâminas padrão e hiperanguladas:
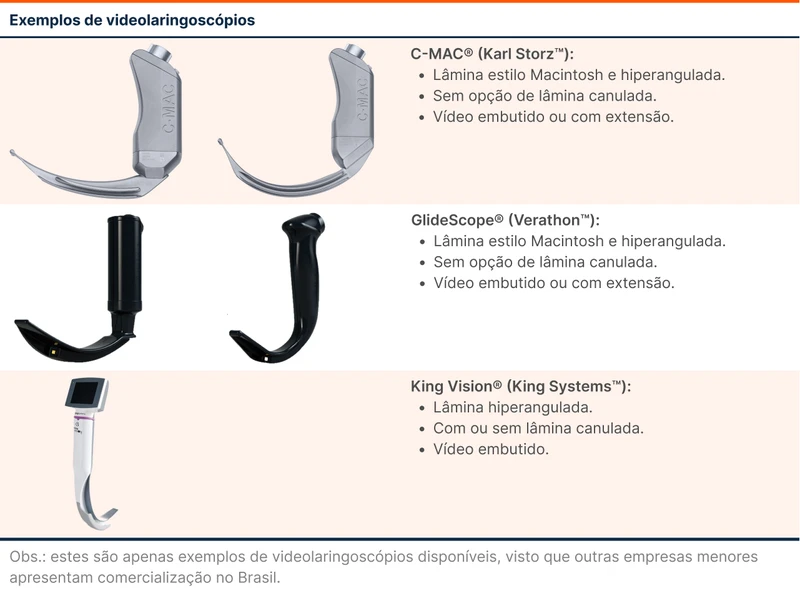
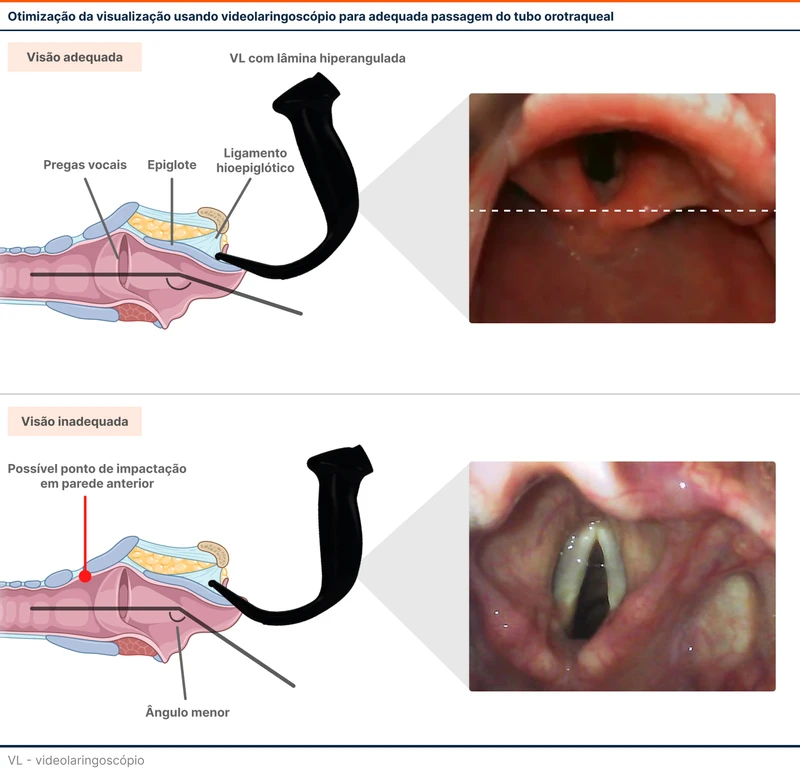
- A lâmina deve ser introduzida pela linha média da língua, permitindo o reconhecimento adequado das estruturas no vídeo (úvula, base da língua, epiglote e laringe). Essa posição otimiza a centralização da ponta do laringoscópio na valécula, ajudando no engajamento do ligamento hioepiglótico (veja figura 2).
- O fio guia deve ser moldado para respeitar a curvatura da lâmina, principalmente nas hiperanguladas. Caso contrário, a passagem do tubo pode ser difícil, já que a língua não é lateralizada na técnica de videolaringoscopia.
Lâminas com geometria padrão
Em geral, os passos para laringoscopia e a passagem do tubo tendem a seguir os padrões da laringoscopia direta. A lâmina pode ser introduzida na linha média da língua ou conforme técnica de laringoscopia direta.
Pelo trajeto mais retilíneo da lâmina, o fio guia pode ser usado no formato tradicional straight-to-cuff (ponta angulada 25º com corpo reto) ou com angulação semelhante à lâmina.
O uso do bougie também é padrão (retilíneo ou com extremidade distal curvada em até 60º), tomando cuidado com deflexões na lâmina e com sua impactação nos anéis traqueais que podem impedir sua progressão.
Lâminas hiperanguladas
A lâmina deve ser introduzida na linha média da língua, reconhecendo os marcos anatômicos pelo vídeo (úvula e pilares amigdalianos) ao avançar. A lateralização da língua como na laringoscopia direta pode dificultar esse reconhecimento.
A lâmina deve ser avançada até a visualização da epiglote, com objetivo de reconhecimento da valécula e engajamento do ligamento hioepiglótico para a elevação da epiglote.
Ao elevar a epiglote, a visualização da via aérea (laringe e pregas vocais) deve ser mantida na metade superior da tela do vídeo. Essa é a visualização ideal por não prejudicar a passagem do tubo (veja figura 3). Manter a via aérea mais próxima ou na parte inferior do vídeo, reduz o ângulo entre a lâmina e traqueia , dificultando a passagem do tubo (veja esse vídeo exemplificando a visualização ideal com o videolaringoscópio).
O fio guia rígido deve ser moldado com o tubo para se adaptar à curvatura da lâmina. Aconselha-se lubrificar o fio guia para facilitar sua retirada do tubo. Ao atingir as pregas vocais, o tubo pode ficar impactado na traqueia anterior devido sua angulação. Neste momento, o fio guia deve ser gradualmente retirado por um assistente enquanto o operador introduz o tubo.
Com a lâmina hiperangulada, o uso do bougie pode ser dificultado por deflexões associadas à curvatura da lâmina (veja esse vídeo sobre o uso do bougie com o VL do dr. George Kovacs, minuto 13:06).
Veja também esse vídeo do Dr. Richard Levitan sobre a videolaringoscopia completa usando uma lâmina hiperangulada.
O que o estudo encontrou?
O estudo DEVICE foi um estudo controlado randomizado, multicêntrico em hospitais americanos, não cego, que comparou o uso do VL com a laringoscopia direta em pacientes adultos críticos [1].
O modelo do VL e tipo de lâmina eram determinados pelo operador. Fio guia ou bougie eram recomendados nos dois grupos.
O desfecho primário avaliado foi sucesso na primeira tentativa de intubação. Complicações graves foram avaliadas como desfechos secundários (hipoxemia < 80%, hipotensão com pressão sistólica < 65 mmHg, uso de vasopressor, parada cardíaca ou morte).
O estudo foi interrompido precocemente na primeira análise interina pré-especificada (1000 pacientes randomizados), pois a taxa de sucesso na primeira tentativa foi significativamente maior com o uso de VL (85,1% vs. 70,8%, diferença absoluta do risco 9,9 - 18,7, IC 95%, p < 0,001). A visualização das pregas vocais também foi melhor com o VL (grau 1 da classificação de Cormack-Lehane). Não houve diferença significativa do desfecho secundário.
A maioria dos operadores tinha alguma experiência com uso de VL, muitos deles médicos em formação, como residentes e fellows. Isso indica um aumento na disponibilidade do VL e uma maior ênfase em treinamentos para seu uso em certos centros nos Estados Unidos.
A incidência de falha na primeira tentativa associada a erro de passagem do bougie ou fio guia foi semelhante entre VL e laringoscopia direta (7,0% vs 7,2%). Isso também pode ser explicado pela familiaridade crescente com o uso de VL. Em estudos prévios, dificuldades na passagem do tubo com fio guia ou passagem do bougie podem ter reduzido o impacto da VL no sucesso na primeira tentativa.
Este estudo cria um novo paradigma - com operadores treinados, usar VL parece otimizar o sucesso na primeira tentativa de intubação, o que sabidamente reduz eventos adversos associados ao procedimento. Apesar do VL ter limitações de disponibilidade, locais com esse recurso devem ter programas de treinamento e o uso deve ser considerado em primeira tentativa, mesmo fora do contexto de via aérea difícil.