Febre de Origem Indeterminada
Febre de origem indeterminada (FOI) é reconhecida há mais de um século. Ao longo dos anos sua definição já foi revisitada algumas vezes. Independente dessas definições, FOI deve ser considerada quando um paciente apresenta febre sem uma causa clara, mesmo com investigação hospitalar ou ambulatorial adequada, por um período de tempo suficiente para excluir febre autolimitada. Em fevereiro de 2022, foi lançada uma revisão no New England Journal of Medicine sobre o tema e trazemos os principais pontos aqui [1]:
Como definir FOI?
FOI é uma síndrome febril sem etiologia esclarecida, com definição ainda em evolução ao longo dos anos, sendo as principais:
- Febre > 38.3ºC por 3 semanas sem diagnóstico, apesar de uma semana de investigação hospitalar (1961, Petersdorf and Beeson);
- Febre sem diagnóstico, apesar de 3 dias de investigação hospitalar ou ao menos 3 visitas ambulatoriais (1991, Durack and Street’s).
Porém, como não há consenso sobre sua definição e pela dificuldade de unificar um critério universal, devemos pensar em flexibilizar critérios rígidos temporais e considerar uma investigação mínima e individualizada, direcionada para clínica e epidemiologia de cada paciente.
Qual a investigação mínima antes de definir FOI?
Na anamnese e exame físico, alguns pontos chave podem ser esquecidos na hora de avaliar um paciente com febre sem uma etiologia clara. É importante sempre procurar:
- Exame físico de linfonodos, pele (incluindo plantas, visto o melanoma acral poder causar febre) e articulação.
- Uso de medicamentos diários.
- Histórico de viagem.
- Dieta (ex.: consumo de leite não pasteurizado).
- Exposição animal.
Dos exames laboratoriais, uma investigação inicial mínima pode incluir:
- Hemograma, proteína C reativa, velocidade de hemossedimentação.
- Sorologias para HIV, HCV, HBV e sífilis.
- Culturas conforme hipótese diagnóstica.
- Imagem baseada nos sintomas e exame físico.
Uma investigação mais avançada pode ser necessária conforme sinais, sintomas e exposições de cada paciente (ex.: painel de autoimunidade, função tireoidiana, sorologias específicas, etc.).
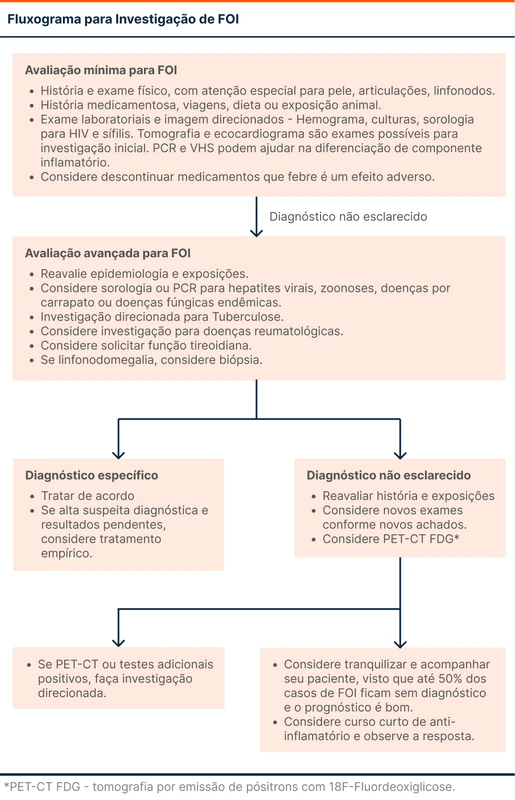
Veja um manejo investigativo possível no fluxograma 1.
Quais as principais etiologias?
Para elencar as principais etiologias, dividimos FOI em: clássica, nosocomial, associada à imunodeficiência e associada à viagem.
As principais etiologias de FOI clássica são:
- Infecção bacteriana - principalmente tuberculose, infecções por salmonella, endocardite infecciosa, abscessos profundos e prostatite.
- Infecção viral - principalmente CMV, EBV, HHV-6 e 7.
- Infecção fúngica - as micoses endêmicas (histoplasmose, blastomicose, paracoccidioidomicose) podem ocorrer tanto no paciente imunocompetente quanto no imunocomprometido.
- Infecções transmitidas por vetores - rickettsioses, leishmaniose, leptospirose, etc.
- Neoplasias - principalmente linfomas, carcinoma de células renais, hepatocarcinoma, câncer ovariano e mixoma atrial.
- Doenças auto-inflamatórias e autoimunes - lembrar de Still do adulto, arterite de células gigantes (principalmente em maiores de 65 anos) e polimialgia reumática.
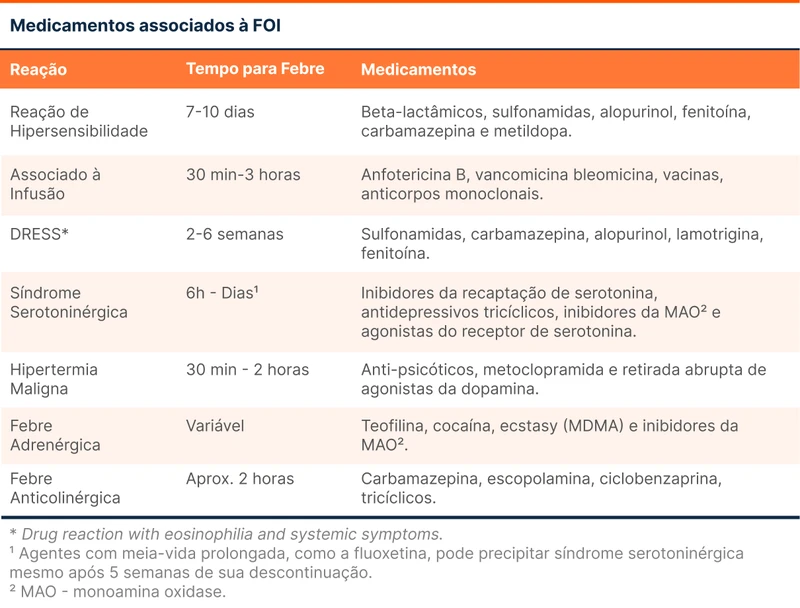
- Medicamentos (tabela 1).
- Miscelânias - tireoidite subaguda, tireotoxicose.
Pacientes com infecção aguda pelo HIV podem manifestar febre, uma síndrome similar a mononucleose e exantema aproximadamente duas semanas após a infecção.
Em pessoas que vivem com HIV sem uso de terapia antirretroviral (TARV), as principais etiologias de FOI são infecções oportunistas (principalmente micobactérias e CMV) e neoplasias (em especial linfomas). Nos que fazem uso regular de TARV, devemos pensar nas causas de FOI clássica e em linfomas. Se início recente de TARV, febre pode ocorrer por síndrome da reconstituição imune.
No grupo de pacientes com transplante de órgão, algumas etiologias devem ser consideradas: doença linfoproliferativa associada ao EBV, HHV-6, HHV-8, síndrome de hiperinfecção por Strongyloides stercoralis e doença do enxerto-versus-hospedeiro. Citomegalovírus também é um etiologia importante, mas em redução com o uso de terapias antivirais preventivas.
Em pacientes hospitalizados, dispositivos são uma causa importante de FOI, principalmente infecções de dispositivos com culturas negativas. Além disso, temos um aumento das etiologias medicamentosas, sendo 3 a 7% das febres em pacientes hospitalizados causadas por drogas.
Um subgrupo importante de FOI no hospital é a febre no pós-operatório. As principais causas incluem fístulas, hematomas, eventos tromboembólicos e manipulação neurocirúrgica. Ao contrário do que se acreditava, não há uma clara associação entre atelectasia e febre.
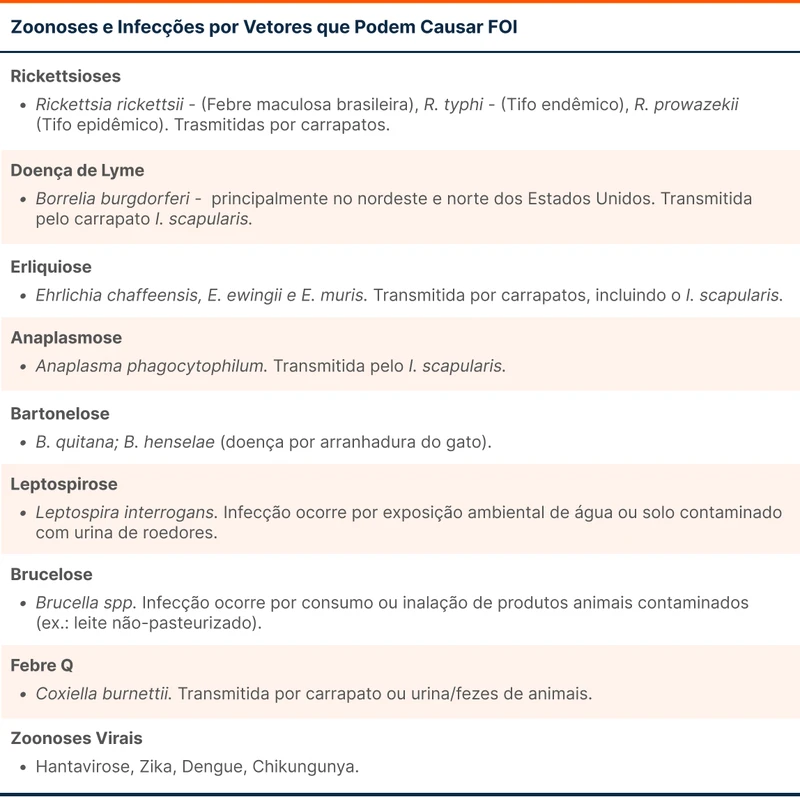
Investigação de febre no viajante deve ser voltada para as principais etiologias infecciosas de cada destino, ao exemplo de malária em viajantes do norte do Brasil, doença de Lyme em viajantes do nordeste norte-americano (Maine, Vermont, Nova Hampshire, etc.) e febre tifoide em viajantes da Índia e proximidades. Outras zoonoses possíveis estão listadas na tabela 2.
Em pacientes com investigação negativa, o que mais podemos fazer?
Uma investigação extensa, sem critério e baseada unicamente em algoritmos deve ser desencorajada em paciente com FOI, visto não ser custo-efetiva e apresentar risco de falso-positivo, principalmente quando a probabilidade pré-teste de cada doença for baixa.
Em situações de piora clínica e imunossupressão, antibióticos ou corticóides empíricos são condutas possíveis a depender do cenário [2]. Caso o paciente não tenha imunossupressão grave e não esteja em piora do estado clínico, o foco deve ser voltado para atingir o diagnóstico em primeiro lugar.
Em pacientes com FOI após uma investigação avançada, o prognóstico é bom (mortalidade de 3.2% em 5 anos) e pode ocorrer até remissão espontânea.
Um teste que vale mencionar é a combinação de tomografia computadorizada com tomografia por emissão de pósitrons marcados com 18F-fluorodeoxyglucose (FDG PET-CT). Algumas meta-análises mostraram desempenho variável, mas com resultado diagnóstico em mais de 50% dos casos. A performance parece ser melhor em pacientes com infecções e neoplasias causadoras de FOI. A principal desvantagem é o custo e a limitação de disponibilidade.