Insulina de Ação Semanal
A insulina icodeca tem duração de uma semana e é a primeira insulina considerada ultra longa. Este tópico traz os quatro ensaios clínicos sobre a icodeca publicados em junho de 2023 e revisa as insulinas basais e suas indicações no diabetes tipo 2.
Insulinas basais: o que são e quais as diferenças entre elas?
Insulinas basais têm objetivo de controle glicêmico durante períodos longos do dia, independentemente das refeições. Atualmente, há quatro opções: NPH, detemir, glargina e degludeca (tabela 1).
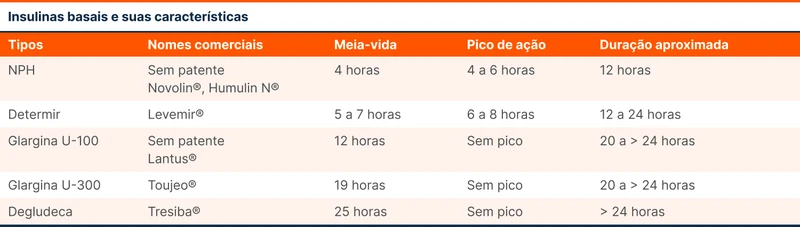
A NPH é a insulina mais disponível no SUS e é classificada como de ação intermediária, com um efeito de aproximadamente 12 horas. Deve ser administrada pelo menos duas vezes ao dia, caso o objetivo seja a cobertura durante todas as 24 horas. Uma vantagem da NPH é que pode ser aplicada junto da insulina regular que é uma insulina prandial. As insulinas prandiais têm ação curta e são aplicadas antes das refeições com o objetivo de controle do pico glicêmico pós prandial. As insulinas prandiais não serão abordadas neste tópico.
A detemir tem ação que pode chegar a 24 horas, caso seja feita em doses acima de 0,8 unidades por quilo. As insulinas glargina e degludeca não fazem pico de dose e são as insulinas com maior meia-vida, chegando a mais de 24h de tempo de ação.
A glargina diminui o número de hipoglicemias em comparação com a NPH, sendo uma opção nos pacientes de maior risco desse evento adverso [1]. Esse benefício com a glargina ocorre por conta de uma ação melhor distribuída ao longo do tempo. A glargina concentrada (U-300) está disponível no Brasil, tem duração maior do que 24 horas e tem efeitos semelhantes a fórmula tradicional (U-100).
A degludeca tem duração de ação de mais de 40 horas e atinge níveis estáveis após 3 a 5 dias de uso. Em comparação à glargina, tem resultados semelhantes quanto a desfechos cardiovasculares e causa menos hipoglicemia.
Os principais efeitos colaterais das insulinas são hipoglicemia e ganho de peso [2]. Não há diferença significativa entre eficácia de controle glicêmico entre as insulinas basais [3].
Quando e como prescrever insulinas no diabetes tipo 2?
O diabetes mellitus do tipo 2 (DM2) deve ser tratado com antidiabéticos orais na maior parte dos casos. As insulinas não são melhores do que outros antidiabéticos com relação a desfechos cardiovasculares, desde que o controle glicêmico seja atingido [2]. A meta de hemoglobina glicada (HbA1C) é abaixo de 7% na maioria dos adultos saudáveis.
A insulina está indicada quando há hiperglicemia grave - HbA1C > 10% ou glicemias aleatórias acima de 300 mg/dL - ou sintomática - perda de peso, polidipsia, polifagia ou poliúria [3]. É possível que o controle glicêmico otimize a função das células beta pancreáticas e melhore a sensibilidade à insulina. Em alguns casos, os pacientes conseguem substituir a insulina por antidiabéticos orais [4].
Os antidiabéticos orais são discutidos mais a fundo no episódio 15: Segunda Droga em Diabetes.
O esquema de insulina inicial recomendado no DM2 é o de insulina basal. Não há diferenças em relação a desfechos cardiovasculares na comparação entre insulinas basais e prandiais. O uso inicial de basal é associado a maior satisfação dos pacientes e menos hipoglicemias [5, 6].
A Associação Americana de Diabetes (ADA) recomenda a dose inicial de insulina de 0,1 - 0,2 UI/kg/dia. Caso a insulina basal seja a NPH, essa dose deve ser feita preferencialmente antes de dormir. O uso de esquemas complexos em que se combina insulinas basais e prandiais é o método de escolha no diabetes mellitus tipo 1 (DM1) e pode ser utilizado em casos de difícil controle no diabetes tipo 2.
Após o início da insulina, é sugerida a suspensão de sulfonilureias e glinidas para redução do risco de hipoglicemias.
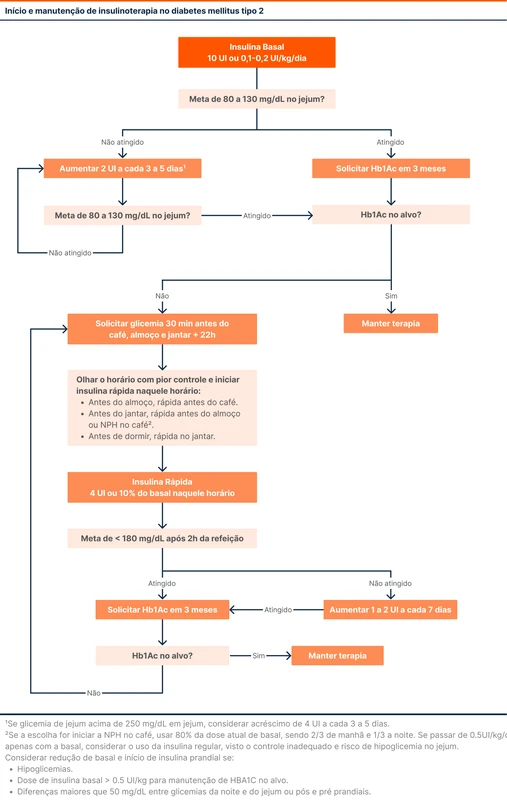
O fluxograma 1 traz sugestões de como deve ser manejado o esquema de insulina no DM2. Detalhes sobre esse esquema estão no episódio 131: Insulinoterapia no DM2.
Icodeca - a insulina de duração semanal
Publicados no New England Journal of Medicine, Journal of the American Medical Association (JAMA) e Lancet, os ensaios clínicos ONWARDS 1, 2, 3 e 4 foram estudos de fase 3 que testaram a insulina icodeca [7-10]. Esse tipo de insulina tem duração de uma semana. A medicação foi desenvolvida pela Novo Nordisk e todos os trabalhos foram desenhados e patrocinados pela empresa.
Todos os quatro estudos foram multicêntricos, com mais de 500 pacientes e avaliaram a aplicação de icodeca em pacientes com DM2 e HbA1C >7% que precisavam intensificar o tratamento. O desfecho primário foi a diferença no controle de HbA1C antes e após a intervenção.
A icodeca foi superior a glargina e degludeca no controle de HbA1C nos pacientes com DM2 que não utilizavam insulina previamente. A diferença foi pequena e o impacto clínico discutível. As doses iniciais foram 70 unidades por semana com ajustes de 20 unidades por semana após aferição por 3 dias consecutivos previamente ao dia da aplicação. Icodeca foi superior à degludeca e não inferior à glargina no controle de HBA1C, nos pacientes com DM2 que utilizavam esquema basal e prandial (basal-bolus).
A icodeca levou a mais episódios de hipoglicemias em todos os trabalhos, mas que foram considerados raros e dentro do esperado para insulinas basais. Os eventos em sua maioria eram de hipoglicemia nível 1 (70 a 54 mg/dL) ou 2 (< 54 mg/dL sem sintomas cognitivos com necessidade de assistência).
O desfecho de alvo glicêmico é um desfecho importante e está relacionado a complicações da diabetes. Esses estudos não avaliaram diretamente as complicações da diabetes, até porque a duração de acompanhamento não seria suficiente para chegar a conclusões.
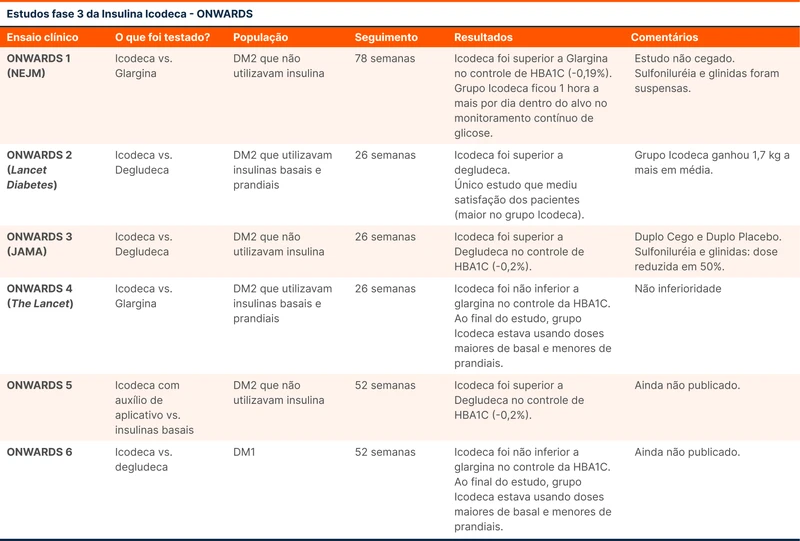
A diferença de eficácia em relação às outras insulinas lentas parece ser pequena, porém essa nova insulina precisa de menos aplicações, o que pode facilitar a aderência. É preciso vigilância em relação a hipoglicemias, especialmente fora de um contexto supervisionado como um ensaio clínico.