Tratamento de Lombalgia Aguda
Lombalgia não específica é comum e autolimitada na maioria dos casos. Dor intensa ou persistente exige tratamento sintomático e o papel dos opioides no manejo ainda gera dúvidas. Em julho de 2023, foi publicado um estudo no Lancet sobre o uso dessas medicações em pacientes com dor lombar [1]. Este tópico revisa as estratégias terapêuticas para lombalgia aguda e traz os resultados do artigo.
O que é lombalgia aguda inespecífica?
Dor lombar pode ser classificada de acordo com a duração do sintoma [2]:
- Aguda: duração de até quatro semanas
- Subaguda: quatro a doze semanas
- Crônica: duração superior a doze semanas
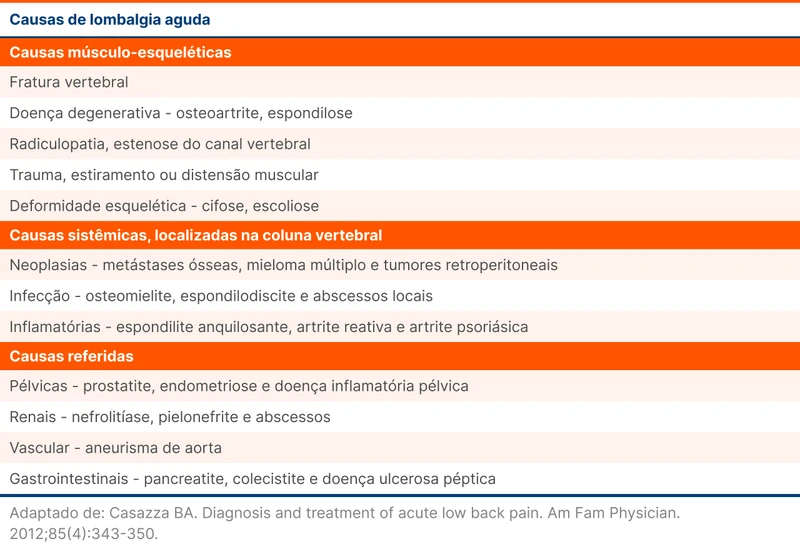
Existem muitas causas de dor lombar aguda, descritas na tabela 1. A lombalgia é considerada inespecífica quando não são identificadas doenças ou condições patológicas que justifiquem o sintoma [3]. Isso acontece em até 90% dos casos de dor lombar. Provavelmente existe interação entre fatores psicossociais, ambientais e comportamentais [4].
A prevalência de lombalgia aguda ao longo da vida é de aproximadamente 40%. Os episódios podem recorrer em até metade dos pacientes. A maioria dos casos tem resolução espontânea, mesmo quando existe recorrência [5].
Lombalgia aguda leva mais de 2 milhões de pessoas nos Estados Unidos a procurarem o pronto atendimento. Destes, cerca de 60% recebem prescrição de opioides [4].
Quais as opções de tratamento não farmacológico?
Todos os pacientes com lombalgia aguda inespecífica devem receber orientações sobre o diagnóstico. As principais recomendações incluem: reforçar a evolução benigna da doença e orientar a manutenção de atividades habituais, conforme toleradas. Repouso absoluto é contraindicado pela maioria dos documentos [4-7].
A diretriz do American College of Physicians ressalta o papel da terapia não farmacológica e da educação do paciente. Essa deve ser a primeira intervenção nos casos de lombalgia aguda inespecífica [2].
Outras terapias não farmacológicas incluem massagem, acupuntura e aplicação de calor local. Não há consenso a respeito de fisioterapia ou melhor atividade física para controle da dor [7].
Quais as opções de tratamento farmacológico?
O tratamento farmacológico tem como objetivo alívio da dor. Por isso, são usados essencialmente analgésicos no manejo da lombalgia aguda inespecífica.
Antiinflamatórios não esteroidais (AINEs) são a primeira escolha para casos muito sintomáticos [4, 6, 7]. Promovem melhor controle da dor lombar aguda quando comparados ao placebo. Os efeitos adversos devem ser monitorados (doença ulcerosa péptica, nefrotoxicidade, eventos cardiovasculares). Não há evidências fortes para recomendação de AINE tópico (gel ou pomadas).
Paracetamol não é recomendado para controle da lombalgia aguda [4]. Sua eficácia não é superior à do placebo em controle de dor [2, 3, 8]. Apesar de estudos não mostrarem aumento do risco de eventos graves, a hepatotoxicidade deve ser lembrada como efeito colateral da medicação.
Relaxantes musculares podem ter efeito discreto no controle de dor [9]. Não devem ser prescritos rotineiramente. Efeitos adversos significativos incluem o aumento do risco de quedas e delirium [5, 8]. Esses eventos são mais comuns quando os relaxantes são usados por mais de duas semanas e em pacientes de maior risco (idosos e naqueles em uso de psicotrópicos).
A dipirona é pouco estudada internacionalmente e não há recomendação formal nesse contexto. Um ensaio clínico está em andamento para comparação da dipirona ao ibuprofeno no controle de dor lombar aguda [10].
O que o estudo encontrou?
O estudo publicado pelo Lancet foi randomizado, triplo-cego e controlado que buscou avaliar o controle de dor lombar ou dor cervical aguda com opioides [1]. Um total de 347 pacientes foram randomizados para o grupo opioide (oxicodona associada a naloxona) ou placebo. Foram excluídos indivíduos com patologia medular (como síndrome de cauda equina), fratura vertebral ou contraindicações a opioides.
A intervenção foi mantida até o controle adequado da dor ou pelo período máximo de seis semanas. Todos os pacientes receberam recomendação de terapia não farmacológica. Outras medicações podiam ser usadas, conforme a necessidade. Os pacientes foram acompanhados até a 52ª semana após a randomização.
Não houve diferença no controle de dor entre os grupos. A incidência de eventos adversos foi semelhante entre os pacientes, sendo vômitos, constipação e cefaleia os sintomas mais comuns. O estudo analisou o risco de uso abusivo de opioide pela Opioid Misuse Measure Scale. Ao final da semana 52, pacientes do grupo opioide tinham maior risco de uso abusivo da medicação.
Os autores concluem que o uso de opioide não teve benefício sobre o placebo em controle de dor lombar ou cervical aguda. Adicionalmente, existe risco quanto ao uso abusivo dessas medicações. Essa é mais uma evidência que desencoraja o uso de opioides nesse cenário.