Manejo de Sangramento Maior em Pacientes em Uso de Anticoagulante Oral
Sangramento é o principal evento adverso dos anticoagulantes e deve ser rapidamente identificado e manejado. Em julho de 2023, foi lançado um consenso no European Journal of Emergency Medicine sobre o tratamento de sangramento maior em pacientes em uso de anticoagulantes orais [1]. Este tópico revisa a definição de sangramento maior e as estratégias para reverter a anticoagulação.
Definição de sangramento maior
Sangramento é a principal complicação do uso de anticoagulantes e é um desfecho de segurança avaliado em estudos com estas medicações. A International Society for Thrombosis and Haemostasis (ISTH) define sangramento maior como um dos seguintes [2]:
- Sangramento fatal
- Queda de 2 g/dL de hemoglobina
- Necessidade de transfusão de dois ou mais concentrados de hemácias
- Sangramento com acometimento de órgão ou área crítica (intracraniano, intraespinal, ocular, retroperitoneal, pericárdico, articular ou intramuscular com síndrome compartimental).
Essa definição unifica os termos usados para sangramentos graves na literatura. Isso permite uma comparação de resultados dos medicamentos que interferem com a hemostasia.
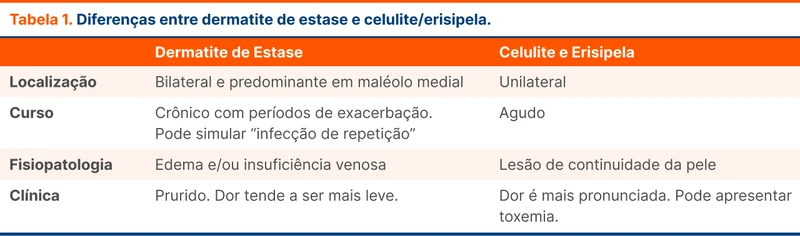
As principais causas de sangramento maior são: associadas ao trauma, hemorragias intracranianas espontâneas e sangramentos gastrointestinais.
A presença de choque associada a história de sangramento deve apontar para hipovolemia como causa. O manejo inicial consiste na monitorização, suporte hemodinâmico e protocolos de transfusão maciça individualizados em cada instituição. Este suporte independe de exames complementares iniciais como hemograma ou hemoglobina.
Pacientes em uso de antagonistas da vitamina K
O antagonista de vitamina K disponível no Brasil é a varfarina, que atua reduzindo a síntese de fatores II, VII, IX e X. Sua meia-vida é de aproximadamente 48 horas.
Em casos de sangramentos maiores com uso de varfarina, o consenso europeu indica o uso combinado do concentrado de complexo protrombínico de 4 fatores (CCP-4F) e reposição de vitamina K. A repleção dos fatores de coagulação isoladamente pode não ser suficiente para reverter o efeito anticoagulante, existindo a possibilidade de efeito rebote da varfarina. Na indisponibilidade de CCP-4F, pode ser usado plasma fresco congelado (PFC).
A dose de vitamina K é 10 mg e deve ser feita intravenosa. O início da ação pode demorar até duas horas.

O CCP-4F contém os fatores II, VII, IX e X, sua ação acontece em menos de trinta minutos. É mais rápido e mais seguro que o PFC, especialmente quando se compara o risco de sobrecarga volêmica. O consenso recomenda que a dose seja conforme o peso e RNI inicial (veja tabela 1). Doses fixas também podem ser consideradas. O RNI deve ser solicitado novamente após 15 minutos da infusão. A dose de CCP-4F pode ser repetida caso o RNI se mantenha acima de 1,5.
Pacientes em uso de anticoagulantes orais diretos
Os anticoagulantes orais diretos (DOACs - direct oral anticoagulants) atuam inibindo fatores específicos:
- Inibidor do fator II ativado (ou inibidores direto da trombina) - dabigatrana é o único exemplo.
- Inibidores do fator X ativado - rivaroxabana, apixabana e edoxabana.
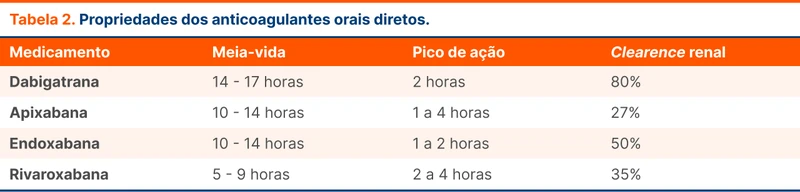
A meia-vida difere entre eles, mas é mais curta que da varfarina. Não possuem efeito rebote considerável (veja tabela 2).
Em caso de sangramento grave em uso de DOACs, devem ser usados reversores específicos.
Em pacientes em uso de dabigatrana, o consenso recomenda reversão com idarucizumabe, um anticorpo monoclonal que se liga à dabigatrana [3]. Apesar de liberado pela ANVISA, sua disponibilidade ainda é limitada pelo custo.
O alfa andexanete é o reversor recomendado no uso de rivaroxabana e apixabana. É uma proteína recombinante do fator Xa que se liga ao inibidor e inativa seu efeito. Não foi aprovado para a reversão de edoxabana, apesar de este DOAC também agir no fator Xa. No estudo ANNEXA-4, que avaliou sua eficácia em pacientes com sangramento maior e uso de inibidores do fator Xa, houve pouca representação de pacientes em uso de edoxabana [4]. Um outro estudo menor que avaliou especificamente o alfa andexanete em pacientes em uso de edoxabana evidenciou bom controle hemostático [5].
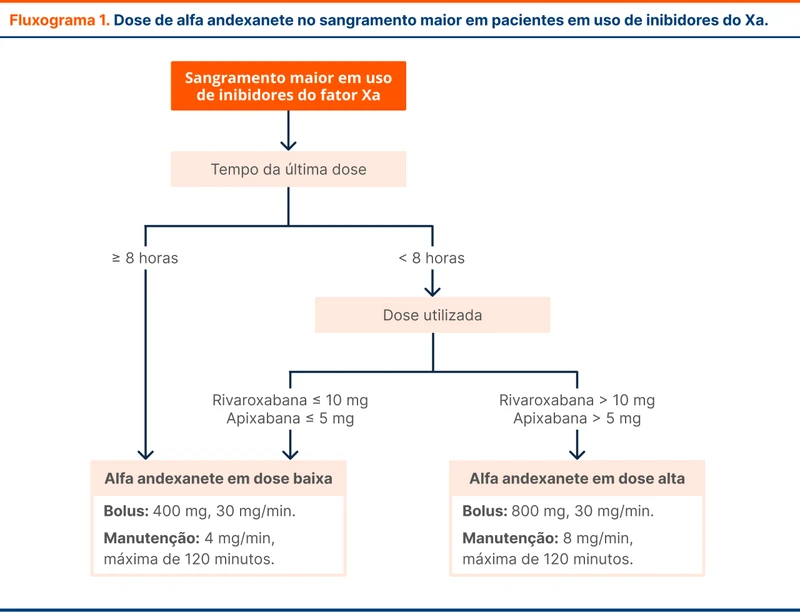
A dose do alfa andexanete depende do tempo desde a última dose de anticoagulante (veja fluxograma 1). É realizada infusão em bolus com ação rápida em até 2 minutos, devendo-se seguir uma dose de manutenção por duas horas para evitar efeito rebote do anticoagulante.
Em casos de indisponibilidade do idarucizumabe ou alfa andexanete, o uso de CPP-4F pode ser considerado [6].
O estudo ANNEXA-I, que compara o alfa adexanete com tratamento usual (incluindo CPP-4F) em hemorragia intracraniana e uso de rivaroxabana e apixabana, foi interrompido precocemente por ter atingido critérios pré-especificados de superioridade no efeito hemostático. Os resultados deste estudo devem ser publicados em breve.