Tratamento de Arterite de Células Gigantes
A arterite de células gigantes (ACG ou arterite temporal) é a vasculite mais comum em pacientes com mais de 50 anos e pode causar perda visual permanente. Recomenda-se o tratamento já na suspeita inicial, porém existe dúvida se a terapia precoce interfere nos resultados dos exames diagnósticos. Um artigo recente avaliou o impacto do uso de corticoides na positividade da biópsia de artéria temporal [1]. Este tópico revisa o tratamento de ACG e aborda os resultados do trabalho.
Qual é o tratamento inicial?
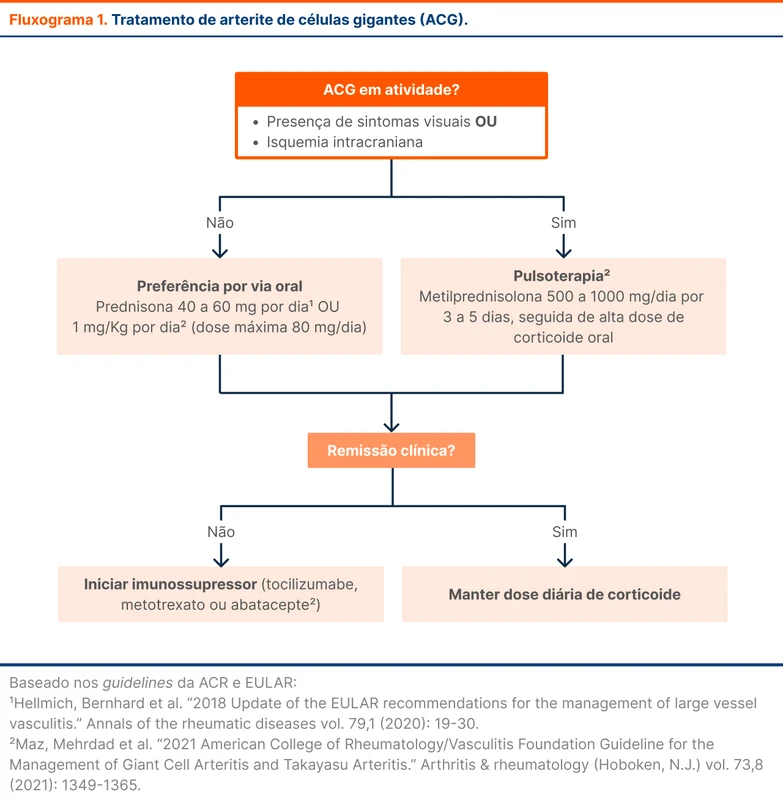
Os glicocorticoides são indicados para todos os pacientes com arterite de células gigantes (ACG). A presença de duas manifestações impacta na dose e via iniciais (fluxograma 1):
- Sintomas visuais - incluindo amaurose fugaz
- Isquemia intracraniana - definida como envolvimento neurológico, incluindo AVC.
Ausência de comprometimento visual e isquemia intracraniana
A preferência é terapia pela via oral. A diretriz da European League Against Rheumatism (EULAR) recomenda prednisona 40 a 60 mg por dia ou equivalente, com objetivo de reduzir sintomas e prevenir a perda visual [2]. A diretriz do American College of Rheumatology recomenda iniciar prednisona em 1 mg/kg de peso ou doses equivalentes, sendo a dose máxima de 80 mg/dia [3].
Em pacientes com diagnóstico recente de ACG, não se deve utilizar dose baixa de corticoide (prednisona < 40 mg por dia) por ausência de estudos com essa dose.
A maioria dos pacientes apresenta melhora clínica em um a sete dias do início do tratamento, mas espera-se uma melhora significativa dos sintomas nas primeiras 24 a 48 horas. Em pacientes sem esse curso, deve-se considerar outras possibilidades diagnósticas.
O desmame da dose de corticoide é progressivo e dependerá da resposta clínica. Recidivas são comuns durante o desmame (veja mais no tópico “como desmamar corticoide” na revisão de Insuficiência Adrenal).
O ACR sugere o uso combinado de corticoide com metotrexato ou tocilizumabe no tratamento. O objetivo é reduzir dose e tempo de uso de corticoide, além dos efeitos colaterais [4, 5]. A decisão de tratamento com dupla terapia ou monoterapia com glicocorticoides deve ser baseada na experiência do médico e nos valores e preferências do paciente.
O EULAR recomenda terapia combinada apenas em pacientes com recidiva, sem resposta após aumentar a dose de corticoide [2].
Presença de comprometimento visual ou isquemia intracraniana
O ACR orienta que a pulsoterapia com corticoide pode ser utilizada em casos de alto risco de perda visual, objetivando a prevenção. Perda visual estabelecida raramente é reversível. A decisão deve ser compartilhada com o paciente [6].
O tratamento consiste em metilprednisolona 500 a 1000 mg/dia por três a cinco dias seguida de alta dose de corticoide oral (1 mg/kg/dia até o máximo de 80 mg/dia de prednisona ou equivalente, segundo ACR, ou 40 a 60 mg/dia, segundo EULAR).
Uma revisão cita que o tempo de início da terapia pode ser mais importante do que a via de administração para prevenção de futuros eventos isquêmicos graves [7].
Como tratar os casos sem remissão?
A abordagem de pacientes sem remissão ou com recorrência é semelhante nos dois grupos de pacientes discutidos anteriormente. Sugere-se adicionar um imunossupressor ao glicocorticoide. As opções são tocilizumabe, metotrexato e abatacepte.
A exceção a essa regra é a recidiva com polimialgia reumática que pode ser controlada apenas com o aumento da dose de glicocorticoides [3].
Tocilizumabe é um anticorpo monoclonal que atua bloqueando os receptores de interleucina 6. Apesar de não ter estudos que comparem esta medicação ao metotrexato, o tocilizumabe tem melhor resposta para evitar uso prolongado de corticoide (“efeito poupador”) [4, 8].
Metotrexato pode ser considerado em pessoas com contraindicação ao tocilizumabe por infecções recorrentes, história de perfurações gastrointestinais ou diverticulite. Também é uma opção de menor custo.
Abatacepte é uma imunoglobulina do antígeno do linfócito T citotóxico (CTLA-4 Ig) que pode ser utilizado em casos de ausência de resposta com as opções anteriores [9].
Qual é o achado do estudo?
A biópsia da artéria temporal (BAT) é um dos critérios diagnósticos de ACG. Apesar da importância, há grande heterogeneidade na sensibilidade do exame [10, 11]. Acredita-se que o uso de corticoides antes da biópsia reduz a positividade dos achados anatomopatológicos.
O artigo, uma coorte retrospectiva canadense, avaliou o impacto do uso de corticoide na positividade da BAT [1]. O diagnóstico de ACG foi definido pela combinação de avaliação clínica, marcadores inflamatórios, BAT e imagem, sem aplicação de critérios diagnósticos.
Os pacientes foram estratificados pelo número de semanas de tratamento com corticoide antes da BAT e foram excluídos os indivíduos que fizeram biópsia após seis semanas.
O estudo incluiu 223 pacientes, destes 48 (21,5%) apresentaram BAT positiva. Do total da coorte, 118 (52,9%) indivíduos foram diagnosticados com ACG, incluindo todos os indivíduos com BAT positiva. Entre os 70 pacientes com BAT negativa, 36 (51,4%) foram diagnosticados por angiografia por ressonância magnética e 34 (48,6%) por critérios clínicos (veja mais no tópico Critérios de Classificação de Arterite de Células Gigantes)
Os indivíduos com BAT positiva apresentavam com mais frequência perda de visão, claudicação da mandíbula, sintomas constitucionais e elevação de VHS e/ou PCR.
Os testes aplicados demonstraram que a terapia com glicocorticoides não afetou a positividade da BAT durante, pelo menos, 6 semanas.
Existem limitações a este estudo. Não foi utilizado um algoritmo diagnóstico padronizado ou avaliação histológica padronizada da BAT, que pode ser afetada pelo uso de corticoide, mas que não afetaria necessariamente o diagnóstico clínico. Além disso, o tamanho da amostra, o agrupamento dos dados em 6 semanas e a natureza retrospectiva do estudo dificultam a generalização dos resultados, particularmente em uso mais prolongado de corticoide.
O ACR recomenda realização de BAT em até 14 dias após o início da corticoterapia. Para os autores, a recomendação é conservadora, já que a utilidade da BAT não é diminuída apesar do uso prévio de corticoide e não deve ser evitada pela possibilidade de falsos negativos.