Fibrilação Atrial Durante Hospitalização
Fibrilação atrial no paciente internado é comum e o manejo tem particularidades quando comparado ao de pacientes ambulatoriais ou em sala de emergência. Em março de 2023, a American Heart Association publicou um posicionamento sobre fibrilação atrial nova em pacientes hospitalizados. Este tópico resume as principais recomendações do documento [1].
Definição e precipitantes
Fibrilação atrial (FA) aguda é definida como a ocorrência de um primeiro episódio de FA em paciente internado por um motivo diferente da arritmia.
A incidência é maior em pacientes com fatores de risco tradicionais para FA, como insuficiência cardíaca, cardiomiopatia, hipertensão, doença renal crônica ou história de cirurgia cardíaca. Estas alterações podem causar remodelamento estrutural cardíaco que predispõe a FA na presença de um precipitante.
Os precipitantes mais comuns em pacientes hospitalizados são infecções e cirurgias não cardíacas (veja figura 1).
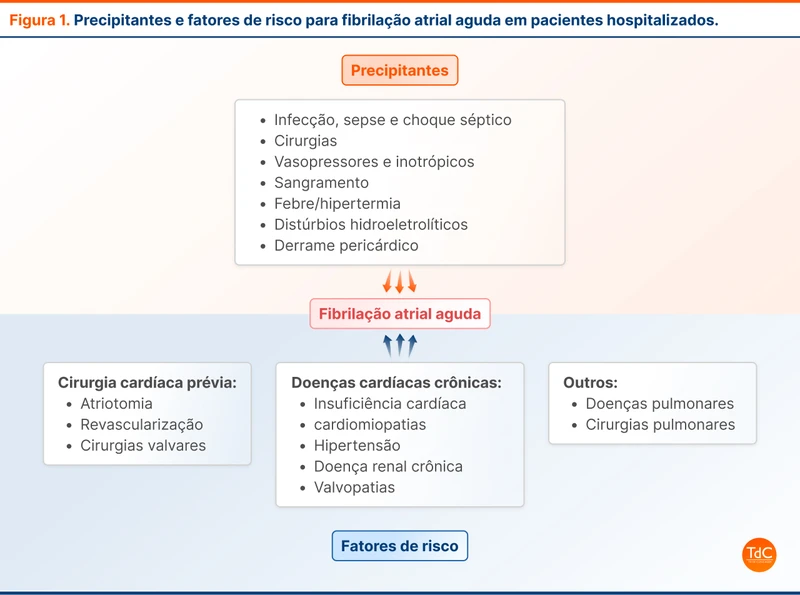
Pacientes com sepse têm maior incidência de FA aguda durante hospitalização, podendo chegar até 44% em pacientes com choque séptico. A ocorrência de FA durante a sepse está associada a maior tempo de hospitalização, mortalidade e recorrência da arritmia.
No pós operatório de cirurgia não cardíaca, a FA aguda acontece em 3% a 16% dos pacientes e também se associa com piores desfechos. Após cirurgias cardíacas, a FA é ainda mais frequente e pode estar associada a fatores precipitantes ou à própria manipulação cirúrgica. O manejo da FA aguda após cirurgia cardíaca é diferente de outros casos.
Risco tromboembólico versus risco de sangramento
Pacientes com FA aguda durante sepse ou após cirurgia não cardíaca têm risco tromboembólico a longo prazo semelhante aos pacientes com FA paroxística prévia [2, 3].
O início da anticoagulação nesta população deve ser individualizado considerando o escore CHA2DS2-VASc e a duração do episódio de FA.
O risco de sangramento é avaliado clinicamente. Ferramentas como o HAS-BLED podem auxiliar a tomada de decisão, mas isoladamente não contraindicam a anticoagulação.
Pós operatório de cirurgias não cardíacas
O início da anticoagulação depende de três fatores: risco de sangramento associado à cirurgia (veja tabela 1), qual anticoagulante será utilizado e avaliação da equipe cirúrgica.

Uma diretriz publicada na CHEST em 2022 sobre terapia antitrombótica no perioperatório recomenda retorno da anticoagulação no paciente estável e sangramento da seguinte forma [4]:
- Anticoagulantes orais diretos (DOAC) ou enoxaparina: iniciar 24 horas após o ato cirúrgico se cirurgia de baixo a moderado risco de sangramento e iniciar 48 a 72 horas após o ato cirúrgico se cirurgia de alto risco de sangramento [5].
- Varfarina: iniciar após 12 a 24 horas do ato cirúrgico.
Sepse
Pacientes com sepse e FA aguda apresentam risco semelhante de eventos tromboembólicos a curto prazo quando comparados com pacientes com FA pré-existente. Porém, o uso de anticoagulantes em pacientes ainda sépticos não parece estar associado a redução do risco tromboembólico e está associado a aumento do risco de sangramento [6].
Assim, recomenda-se observar até a recuperação do quadro séptico antes de considerar o início de anticoagulação em pacientes com FA aguda e alto risco tromboembólico.
Controle de FA em paciente críticos
Uma dúvida frequente em pacientes hospitalizados é sobre o controle da FA em pacientes críticos que estão instáveis por outros motivos. Um cenário comum é o de um paciente séptico com episódios de FA de alta resposta.
Nestes casos, o documento orienta as seguintes medidas (veja o fluxograma 1):
- Tratar a doença desencadeante.
- Descontinuar beta-adrenérgicos se possível. Por exemplo, trocar drogas vasoativas para vasopressina e reduzir ou suspender beta-agonistas inalatórios [7].
- Corrigir distúrbios eletrolíticos - principalmente hipo e hipercalemia, hipomagnesemia e hipofosfatemia.
- Considerar controle medicamentoso do episódio de alta resposta.
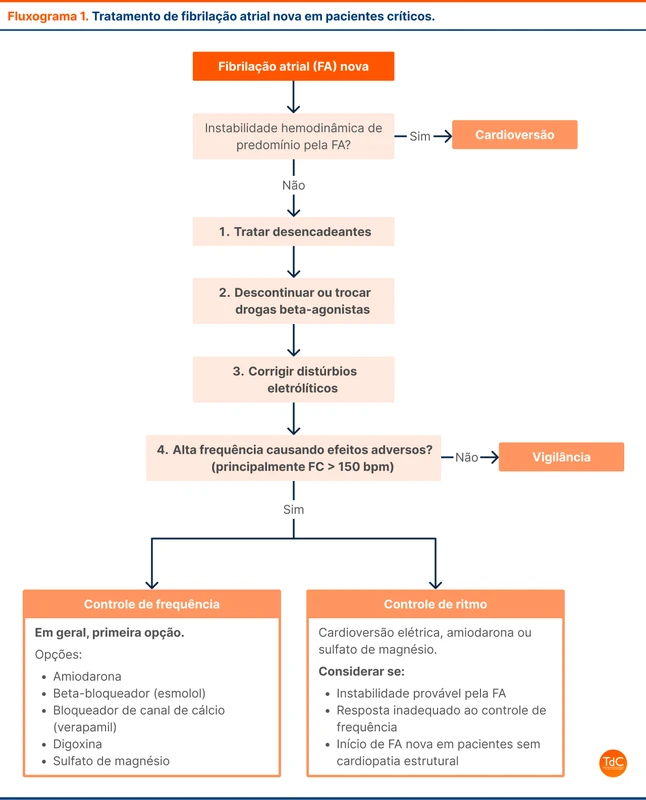
Pode ser adequado aguardar o controle inicial da doença crítica para iniciar tratamento medicamentoso para controle da frequência cardíaca (FC). O episódio de FA de alta frequência pode ser uma resposta compensatória em casos de choque, da mesma maneira que uma taquicardia sinusal secundária à hipotensão.
Por outro lado, frequências muito altas podem gerar um desacoplamento atrioventricular e piorar hemodinâmica. Não há consenso sobre alvo de FC nesse contexto. Alguns especialistas sugerem tolerar FC de até 140 a 150 bpm. Acima destes valores, a frequência deve ser controlada de maneira mais ativa. Se optado pelo controle medicamentoso, manter a FC acima de 100 bpm parece adequado para garantir o balanço hemodinâmico em choques distributivos [8].
A amiodarona é uma das medicações mais utilizadas para controle de frequência no contexto de doenças críticas. Achados observacionais sinalizam uso promissor dos betabloqueadores, com possível melhor do controle de FC e menor mortalidade quando comparado à amiodarona [9, 10]. O esmolol é uma opção adequada de betabloqueador por sua rápida ação e curta duração. Bloqueadores de canal de cálcio (diltiazem) e a digoxina também são opções para controle de frequência (veja tabela 2). O sulfato de magnésio também pode ser usado como adjuvante no controle de frequência.
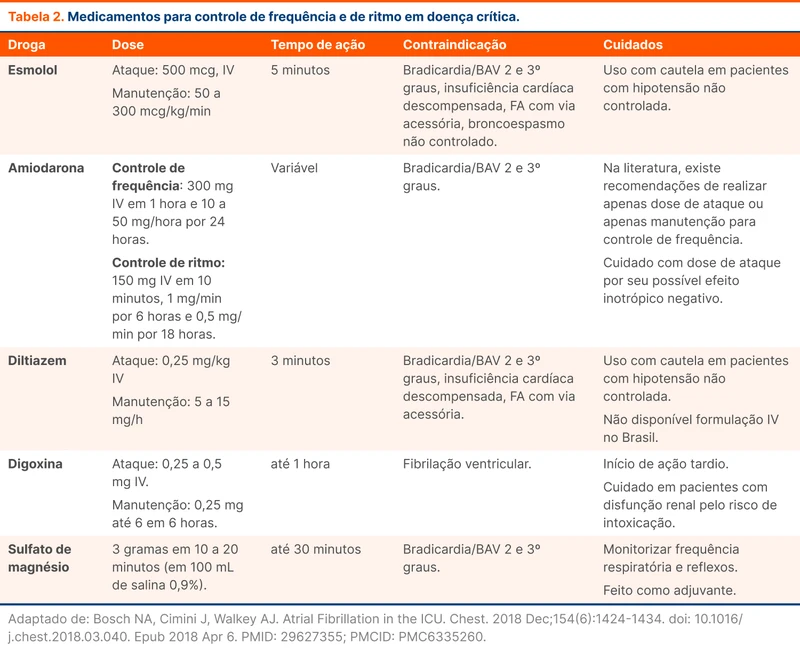
O controle de ritmo é indicado para pacientes com refratariedade ao controle de frequência ou quando a FA é interpretada como a principal causa da instabilidade, especialmente naqueles sem cardiopatia estrutural. A recorrência de episódios de FA é frequente após a cardioversão elétrica em pacientes sépticos. Após o procedimento, é comum iniciar amiodarona ou sulfato de magnésio para tentar evitar a recorrência da arritmia e manter o ritmo.


