Nova Definição de Síndrome do Desconforto Respiratório Agudo (SDRA)
A síndrome do desconforto respiratório agudo (SDRA) é uma das principais causas de internação em UTI. Em julho de 2023 foi proposta uma nova definição global sobre SDRA [1]. Esse tópico explica as mudanças, comentando as vantagens e desvantagens da nova definição.
Qual o novo critério?
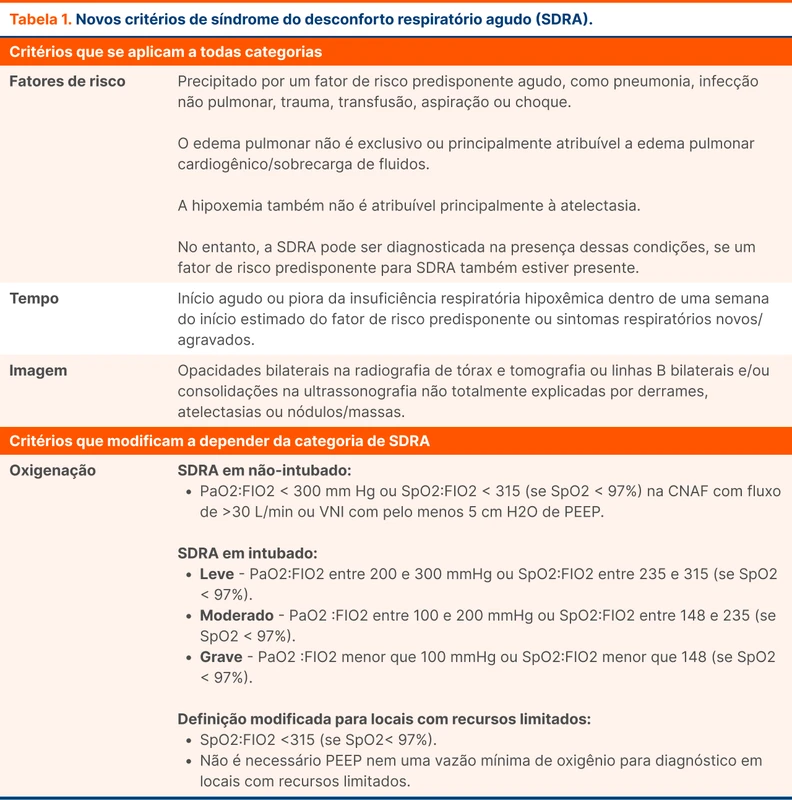
A SDRA é definida por uma lesão pulmonar inflamatória aguda e difusa. Pode ser causada por doenças como pneumonia, infecção com foco fora do pulmão, trauma, transfusão, queimadura, broncoaspiração ou choque. O último critério diagnóstico de SDRA havia sido publicado em 2012 [2], conhecido como critérios de Berlim.
Os critérios de Berlim envolviam quatro fatores:
- Insuficiência respiratória: medida através da relação da pressão parcial de oxigênio pela fração inspirada de oxigênio (PaO2/FiO2). Essa relação deve ser menor ou igual a 300.
- Tempo: a insuficiência respiratória deve ocorrer em menos de uma semana após o início do fator predisponente ou uma semana após a piora dos sintomas respiratórios.
- Difuso: os achados pulmonares devem ser bilaterais, sendo vistos através de radiografia ou tomografia.
- Afastar diagnósticos diferenciais: os sintomas não podem ser totalmente explicados por um quadro cardíaco. O paciente pode ter insuficiência cardíaca, mas deve ter também outro fator causador de SDRA.
A nova definição de SDRA foi criada por um comitê com 32 membros (veja tabela 1) [1]. Esses membros foram escolhidos de diferentes regiões do mundo, com o intuito de aumentar a representatividade.
Um dos objetivos dessa atualização foi facilitar o reconhecimento de SDRA e ajudar que países com poucos recursos também consigam chegar ao diagnóstico. A falta de reconhecimento de SDRA é um problema global. Um trabalho nórdico encontrou que 20% dos pacientes com SDRA grave e até 50% daqueles com SDRA leve não tiveram o diagnóstico de SDRA reconhecido pela equipe [3].
As principais mudanças da nova definição foram:
- Incluir cateter nasal de alto fluxo, com um fluxo mínimo de 30 L/min
- Como alternativa a relação PaO2/FiO2 menor ou igual a 300 mmHg, existe a possibilidade de utilizar a relação saturação periférica (SpO2)/FiO2 menor ou igual a 315
- Uso do ultrassom para confirmar os achados bilaterais em parênquima pulmonar.
Por que a mudança do suporte ventilatório?
O critério de Berlim incluía apenas pacientes com suporte ventilatório com pressão positiva em ventilação mecânica invasiva ou não-invasiva. Era obrigatório que o suporte ventilatório disponibilizasse uma PEEP mínima de 5 cm H2O. Isso excluía o cateter nasal de alto fluxo (CNAF), uma terapia que tem sido mais empregada nos últimos anos.
O CNAF é um dispositivo não invasivo de suporte respiratório, em que é possível controlar o fluxo e a FIO2, porém não é possível garantir uma PEEP. Seu uso tem aumentado principalmente após a publicação do estudo FLORALI [4]. Esse artigo já foi comentado no tópico Uso de Cateter Nasal de Alto Fluxo (CNAF) na Insuficiência Respiratória Aguda.
O FLORALI tem algumas ressalvas, entre elas o fato que 21% dos pacientes tinham achados pulmonares unilaterais, incompatíveis para SDRA. Apesar disso, esse estudo alavancou o uso de CNAF e fez com que o comitê incluísse esse dispositivo nos critérios diagnósticos de SDRA.
Nos critérios atuais, pacientes utilizando cateter nasal de alto fluxo foram incluídos, contanto que estejam sob uso de um fluxo mínimo de 30 L/min. O valor mínimo de 30 L/min é estabelecido porque fluxos com esses valores parecem gerar uma pressão positiva pequena (apesar de não quantificável), principalmente se o paciente estiver de boca fechada [5].
O critério atual também acrescentou uma modificação na definição caso o paciente esteja em local com recursos limitados. Nesses locais, o paciente não precisa de PEEP mínima ou fluxo inspiratório mínimo, contanto que preencha o critério de oxigenação.
Por que a mudança do critério da oxigenação?
Em locais que não possuem acesso à gasometria, não seria possível preencher o critério de Berlim da relação PaO2/FiO2 menor ou igual a 300. Os novos critérios propõem o uso da saturação periférica de O2 (SpO2) para abordar essa limitação. O parâmetro proposto é a razão de SpO2/FiO2 menor igual a 315. Esse critério só pode ser utilizado se a oximetria de pulso estiver menor ou igual à 97%.
Essa alteração é baseada na modificação de Kigali da definição clínica de SDRA [6]. A definição de Kigali sugeria o uso da saturação periférica nos critérios diagnósticos, porém ainda não tinha sido incorporada na definição de Berlim. Pacientes com o critério da saturação possuem características clínicas e desfechos parecidos com os pacientes que preenchem os critérios gasométricos [7].
Em um local com recursos limitados, o paciente preenche o critério de SDRA se estiver utilizando uma máscara não-reinalante (dispositivo que não possui fluxo inspiratório estabelecido e nem PEEP) e possuir uma SpO2/FIO2 menor que 315.
Críticas aos novos critérios
Recentemente, alguns estudos indicaram uma confiabilidade reduzida dos oxímetros de pulsos em pacientes de pele negra. Um trabalho publicado no New England Journal of Medicine em 2020 mostrou que, em 11% dos pacientes negros, o oxímetro mostrou uma saturação acima de 92%, porém o paciente possuía um SatO2 abaixo de 88% quando verificado pela gasometria [8]. Essa discrepância ocorreu em apenas 3% dos pacientes de pele branca.
Outra crítica é que os novos critérios tornaram o diagnóstico de SDRA mais heterogêneo. Isso dificulta a distinção entre pacientes que possuem baixa necessidade de fluxo de oxigênio, em relação àqueles que necessitam de medidas mais invasivas. A população incluída nos estudos tende a ficar mais heterogênea, sendo mais difícil de replicar os achados na prática diária.
Ainda são necessárias validações futuras desse novo critério.