Estatinas e Eventos Adversos
As estatinas são a primeira linha de tratamento farmacológico para o controle da dislipidemia. Existe preocupação quanto aos efeitos adversos dessas medicações. Em setembro de 2023 o British Medical Journal publicou um estudo que comparou a eficácia e segurança de duas estatinas: rosuvastatina e atorvastatina [1]. Este tópico traz um resumo das evidências sobre o assunto e os resultados do artigo.
Quais são as indicações de estatinas?
As estatinas estão indicadas para redução de eventos cardiovasculares através do controle dos níveis de colesterol.
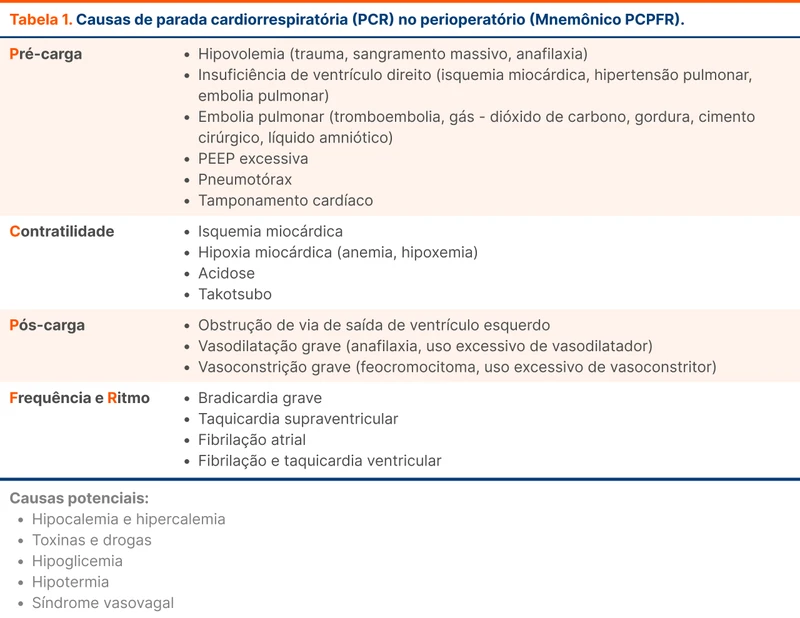
Todos os pacientes que já tiveram um evento cardiovascular devem receber prevenção secundária com estatinas. Pacientes com doença aterosclerótica estabelecida (coronariana, cerebrovascular e/ou doença arterial obstrutiva periférica) têm muito alto risco de novos eventos cardiovasculares. As estatinas de alta potência (tabela 1) são a escolha nesta população e a meta de LDL deve ser menor que 50 mg/dL segundo a diretriz brasileira [2].
Na prevenção primária, o risco de eventos cardiovasculares deve ser calculado com ferramentas validadas. Para a população brasileira, recomenda-se o uso da calculadora de escore de risco cardiovascular global em pacientes sem história de evento cardiovascular e sem características de alto risco (tabela 1) [2].
As metas de LDL e escolha da terapia dependem do risco cardiovascular avaliado e da potência da estatina (tabela 2):
- Alto risco: meta de LDL ≤ 70 mg/dL com preferência para estatina de alta intensidade
- Risco intermediário: meta de LDL < 100 mg/dL com preferência por estatina de moderada intensidade
- Baixo risco: meta LDL < 130 mg/dL, com medidas não farmacológicas. Pode-se considerar terapia farmacológica em pacientes com LDL> 160 mg/dL

O LODESTAR foi um estudo publicado em 2023 que avaliou uma abordagem diferente para a profilaxia de eventos cardiovasculares em pacientes de muito alto risco [3]. Foram randomizados 4400 indivíduos com doença coronariana crônica para uma estratégia convencional ou para terapia guiada por meta. A estratégia convencional consistia em uso de estatina de alta potência independente do LDL. Na terapia guiada por meta, tentava-se titular a dose de estatina começando com doses mais baixas, com objetivo de atingir um LDL entre 50 e 70 mg/dl. A alta potência só era utilizada se a meta não fosse atingida com doses mais baixas. Apenas atorvastatina e rosuvastatina foram usadas no estudo.
Ao final de três anos de acompanhamento, a terapia guiada pelo LDL foi não inferior a estratégia convencional na prevenção do composto de mortalidade, infarto, AVC ou necessidade de revascularização coronariana. Esse estudo ainda não foi incorporado às principais diretrizes, mas pode embasar a conduta de uso de estatinas em doses menores e mais toleradas, desde que a meta de LDL seja atingida.
Quais são os principais efeitos adversos das estatinas?
A maior parte dos pacientes em uso de estatinas tem boa tolerabilidade com a medicação. Os efeitos adversos mais comuns são musculares e podem ter várias apresentações clínicas. Mialgia é a principal queixa muscular. O sintoma pode ser aliviado com a troca da estatina ou alteração da posologia, como discutido no episódios 177 - mialgia por estatina. Miopatia, miosite e rabdomiólise são complicações mais graves, porém mais raras [5].
Hepatotoxicidade é um evento adverso incomum, ocorrendo em menos de 1% dos pacientes. As de alta potência são mais implicadas. Não se recomenda dosagem de transaminases de forma rotineira. As estatinas podem ser prescritas em pacientes com hepatopatia crônica e estável [5, 6].
Alteração do metabolismo glicêmico e um novo diagnóstico de diabetes mellitus (DM) podem ocorrer. Esse efeito preocupa por ser um fator de risco adicional para eventos cardiovasculares [7]. Existe associação com a dose de estatina em uso e a maior incidência de DM. No entanto, estima-se que o número necessário de pacientes expostos para um novo diagnóstico de DM é de 255 em um período de quatro anos [8]. As diretrizes reforçam que o benefício cardiovascular das estatinas supera o risco da alteração no metabolismo glicêmico [5, 8].
O que o estudo mostrou?
O estudo publicado em setembro de 2023 foi uma análise secundária do LODESTAR [1]. Foram avaliados 4400 indivíduos com doença coronariana crônica, em uso de atorvastatina ou rosuvastatina.
O desfecho primário analisado foi a ocorrência de um composto entre mortalidade, infarto agudo do miocárdio, acidente vascular cerebral ou necessidade de revascularização coronariana. Desfechos secundários avaliados foram novo diagnóstico de diabetes, internação por descompensação de insuficiência cardíaca, tromboembolismo venoso, revascularização por doença arterial obstrutiva periférica, necessidade de intervenção aórtica ou surgimento de disfunção renal.
Os pacientes foram acompanhados por três anos, com avaliações na semana 6 e nos meses 3, 6, 12 e 24. Ao final do acompanhamento, não houve diferença na incidência de desfecho primário. Porém, houve discreta redução de LDL no grupo que recebeu rosuvastatina (69,61 mg/ml vs. 73,47 mg/ml; p < 0.001).
Foi observada maior incidência de DM entre os pacientes em uso de rosuvastatina em comparação à atorvastatina (7,1% vs. 5,5%. hazard ratio 1,29. Intervalo de confiança 95% 1,01-1,63; p=0,04). A necessidade de um novo antidiabético também foi maior no grupo em uso de rosuvastatina (7,2% vs. 5,5%. hazard ratio 1,39. Intervalo de confiança 95% 1,03-1,87; p=0,03).
Outro desfecho secundário significativo foi a maior necessidade de correção cirúrgica de catarata entre os pacientes em uso de rosuvastatina (2,5% vs. 1,5%. hazard ratio 1,66. Intervalo de confiança 95% 1,07-2,58; p=0,02). Os demais eventos secundários foram semelhantes entre os grupos.
Nos pacientes em uso de rosuvastatina, o controle do LDL é mais intenso, sem diferença em eventos clínicos em três anos. Em comparação à atorvastatina, existe aumento do risco de desenvolvimento de diabetes mellitus e necessidade de correção de catarata - eventos que devem ser monitorados em pacientes em uso de estatinas. A população estudada foi restrita à Coreia do Sul, o que pode limitar a extrapolação dos resultados a outros grupos.