Tratamento de Hiponatremia e Mielinólise Pontina
Hiponatremia grave sintomática pode ocasionar complicações ameaçadoras à vida através de edema cerebral. Elevações acima de 12 mEq/L em 24 horas foram classicamente associadas com o surgimento da síndrome de desmielinização osmótica e mielinólise pontina [1]. Em setembro de 2023, um estudo retrospectivo lançado na revista NEJM Evidence comparou diferentes estratégias de correção e avaliou mortalidade, tempo de hospitalização e ocorrência de mielinólise pontina [2]. Este tópico revisa o tratamento de hiponatremia grave, mielinólise pontina e os resultados deste estudo.
Definições
A hiponatremia pode ser classificada conforme três parâmetros: valor do sódio, tempo de desenvolvimento e gravidade dos sintomas. Utilizando como parâmetro os valores de sódio no momento do diagnóstico, a classificação é a seguinte [3]:
- Leve: Na entre 130 - 135 mEq/L
- Moderada: Na entre 125 - 129 mEq/L
- Profunda: Na < 125 mEq/L
Quanto menor o valor, maior a mortalidade no paciente hospitalizado e maior o risco para síndrome de desmielinização osmótica no momento da correção.
A classificação por tempo se baseia na duração da hiponatremia:
- Aguda: duração menor que 48 horas
- Crônica: duração maior que 48 horas ou tempo indeterminado

Se a história clínica e anamnese sugerirem uma causa aguda, deve-se considerar classificar o paciente como hiponatremia aguda. Essa diferenciação é feita porque os distúrbios agudos têm maior risco de edema cerebral e sintomas. Na tabela 1, encontra-se um resumo das principais causas de hiponatremias agudas.

Em relação à gravidade dos sintomas, a diretriz europeia divide os sintomas em moderadamente graves e graves. A tabela 2 resume os principais achados clínicos conforme a gravidade. A presença de vômitos é um marcador de gravidade e alerta para o desenvolvimento de edema cerebral.
Tratamento de hiponatremia grave
O tratamento de hiponatremia pode ser guiado pela presença de sintomas e pelo tempo de desenvolvimento. Tanto a diretriz europeia quanto a norte-americana não recomendam a correção de sódio por fórmulas de estimativa de água corporal total, como a fórmula de Adrogue-Madias [4-6]. É proposto uma abordagem mais pragmática, com infusão de bolus de solução NaCl a 3% em casos sintomáticos, principalmente graves, para reversão rápida dos sintomas. A infusão de bolus de NaCl deve ser acompanhada de aferições frequentes dos níveis de sódio.
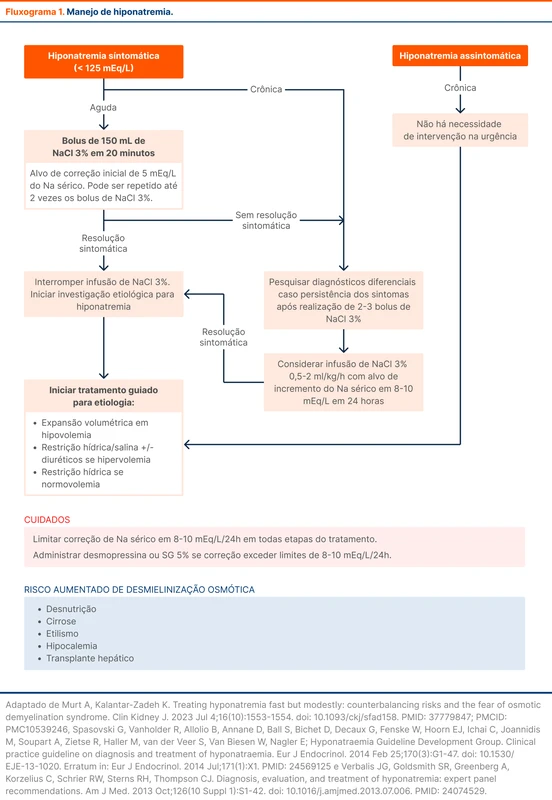
O fluxograma 1 traz um resumo das abordagens comuns a ambas as diretrizes para tratamento de hiponatremias agudas sintomáticas. Em casos de hiponatremia grave, é recomendado consultar um especialista para auxílio na condução do caso. Veja mais sobre abordagem de hiponatremia na emergência em Hiponatremia na Emergência.
Síndrome de desmielinização osmótica e mielinólise pontina
A taxa de correção do sódio está historicamente associada ao risco de síndrome de desmielinização osmótica - definição que inclui tanto mielinólise pontina como extra-pontina [7].
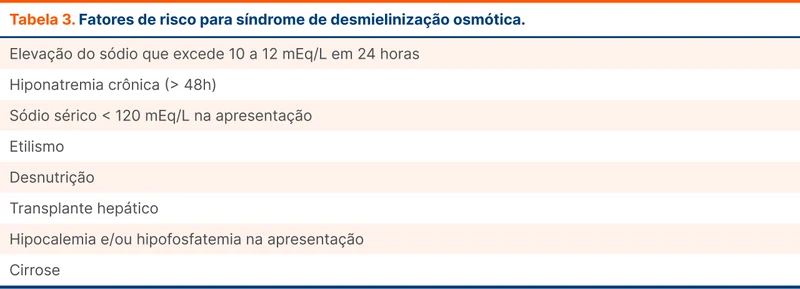
Taxas de correção que excedem 10 a 12 mEq/L nas primeiras 24 horas são consideradas fatores de risco para mielinólise pontina. A maior parte da literatura do tema vem de estudos experimentais em animais e estudos observacionais. Outros fatores de risco implicados no desenvolvimento da síndrome, inclusive em cenários onde não há hipercorreção, estão na tabela 3 [8].
A manifestação da síndrome é tipicamente tardia, entre o 2º e o 7º dia após a correção do sódio. Os sinais incluem encefalopatia e confusão mental, que progridem para sintomas motores como paraparesia, quadriparesia, disartria e disfagia. A clínica pode ser variada, com descrição de ataxias, sintomas parkinsonianos e até quadros mais graves, como a síndrome de locked-in e coma.
A ressonância magnética é o exame de escolha para diagnóstico. Os achados característicos envolvem lesões hipointensas em T1 e hiperintensas em T2 e FLAIR, que acometem a região central da ponte, que pode progredir para o sinal da asa de morcego [9]. O acometimento extra-pontino ocorre na região de núcleo caudado e putâmen bilateralmente, poupando o globo pálido. Os achados de imagem são tardios, geralmente se apresentando após a primeira semana do quadro, mas podem permanecer ocultos por até quatro semanas.
Uma vez com a síndrome instalada, não há evidências fortes de terapias para além do suporte clínico. Os sintomas podem apresentar melhora clínica, porém algumas alterações podem ser irreversíveis [10].
A prevenção dessa complicação envolve identificar os pacientes com alto risco de correção e desenvolvimento da síndrome, onde a terapia de correção do sódio deve ser cautelosa e monitorada frequentemente. Em casos de hipercorreção (> 10-12 mEq/L em 24h) é sugerido iniciar terapia de redução do sódio com o uso de desmopressina ou soro glicosado 5%.
Resultados do estudo
Esse estudo de coorte retrospectiva selecionou 3274 pacientes que apresentavam um sódio admissional menor que 120 mEq/L. Os pesquisadores avaliaram a associação entre a taxa de correção da hiponatremia em 24 horas com mortalidade, tempo de internação e incidência de mielinólise pontina em até 90 dias da hospitalização.
Os pacientes foram divididos em três grupos conforme a velocidade de correção em 24 horas:
- Menos que 6 mEq/L
- Entre 6 e 10 mEq/L
- Mais que 10 mEq/L
O grupo de correção lenta (< 6 mEq/L) teve maior mortalidade dentre os três. Já o grupo com correção mais rápida (> 10 mEq/L) teve menor mortalidade quando comparado ao grupo 6 - 10 meq/L/ e < 6 mEq/L.
A ocorrência de mielinólise pontina foi verificada em sete pacientes (0,2% da coorte). Quatro tinham sódio admissional menor que 110 mEq/L e apenas dois pacientes apresentaram taxas de correções maiores que 10 mEq/L em 24 horas. Seis dos sete pacientes com diagnóstico analisado apresentavam alguma combinação de desnutrição, etilismo, cirrose, hipocalemia e hipofosfatemia.
Os resultados do estudo questionam a força de associação entre a velocidade de correção do sódio e a ocorrência de mielinólise pontina. A menor mortalidade associada aos grupos com maiores taxas de correção do sódio está em concordância com achados de estudos prévios [11-13]. O trabalho enfatiza o papel dos outros fatores de risco (etilismo, desnutrição, distúrbios hidroeletrolíticos concomitantes e cirrose) no surgimento de mielinólise pontina durante o tratamento de hiponatremias.