Tratamento de Angina Estável
Uma das principais indicações de angioplastia em pacientes com doença coronariana crônica é a persistência de angina. No entanto, ainda existem dúvidas sobre a efetividade do procedimento no controle de sintomas. O estudo ORBITA-2, publicado pelo New England Journal of Medicine em dezembro de 2023, avaliou a eficácia da angioplastia no manejo de angina [1]. Esta edição do Guia revisa a terapia antianginosa na doença coronariana crônica e traz os detalhes do estudo.
Terapia medicamentosa inicial para angina estável
O tratamento da angina estável envolve terapias medicamentosas, não-medicamentosas e angioplastia coronariana. O objetivo da terapia medicamentosa é reduzir a angina sem descompensar a doença de base e com o mínimo de efeitos adversos possíveis.
A primeira escolha medicamentosa nesse cenário são os betabloqueadores, que reduzem a demanda miocárdica por oxigênio. Uma meta-análise com 72 estudos evidenciou que os betabloqueadores resultam em menos episódios de angina durante o dia. Pacientes em uso de betabloqueadores apresentam menos descontinuação da droga em comparação a outros antianginosos [2]. A dose do betabloqueador deve ser otimizada até que a frequência cardíaca do paciente atinja 55 a 60 bpm [3].
Os bloqueadores de canais de cálcio (BCC) possuem efeitos similares aos betabloqueadores no manejo de angina, sendo também drogas de escolha nesse cenário. Em pacientes com angina estável e disfunção ventricular esquerda, deve-se escolher um BCC di-hidropiridínico (como o anlodipino), uma vez que os não di-hidropiridínicos (verapamil e diltiazem) podem piorar o desempenho ventricular [4].
Após betabloqueadores e BCC, a próxima opção são nitratos de longa ação. Quando eles são adicionados a um betabloqueador ou BCC, o paciente apresenta menor número de episódios de angina e redução da necessidade de nitrato de resgate.
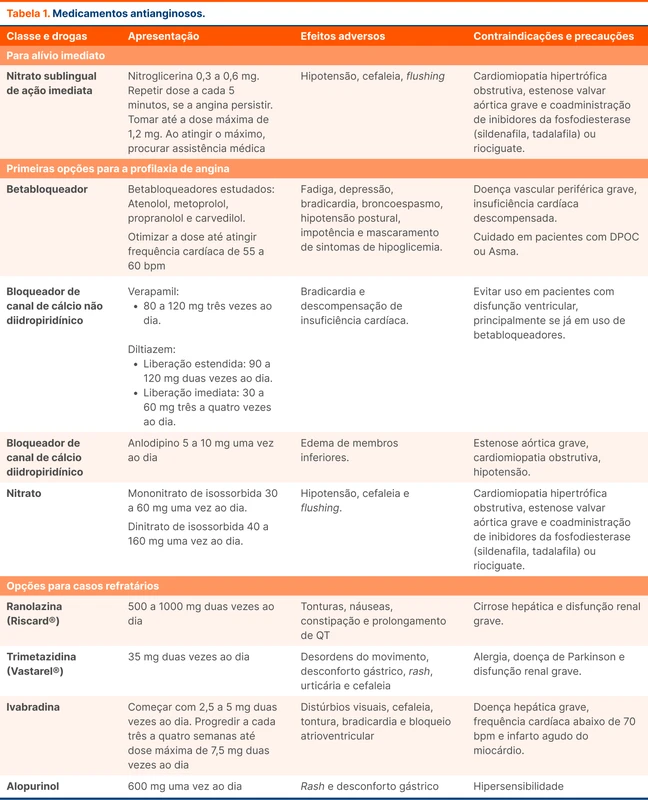
A resposta aos medicamentos deve ser avaliada em duas a quatro semanas [3]. As doses e detalhes dos medicamentos antianginosos estão na tabela 1.
Terapia medicamentosa em pacientes refratários
Existe incerteza sobre a melhor opção medicamentosa em pacientes refratários ou naqueles com contraindicação ou intolerância aos betabloqueadores, BCCs e nitratos.
A trimetazidina foi estudada em 2020 no trabalho ATPCI em pacientes que apresentavam angina após angioplastia coronariana [5]. O estudo não mostrou benefício na redução da dor. Isso colocou em dúvida o seu efeito sobre a angina.
A diretriz da American Heart Association recomenda a ranolazina, um inibidor seletivo da corrente de entrada tardia de sódio. Essa medicação possui evidência de redução de episódios de angina e é aprovada para esse uso [6].
A diretriz europeia coloca como terapias possíveis a ivabradina, trimetazidina e alopurinol [3]. A ivabradina é indicada principalmente para pacientes que não atingem a frequência cardíaca alvo com betabloqueador. O alopurinol possui estudos que sugerem algum benefício em episódios de angina, porém mais trabalhos são necessários para encontrar o papel dessa medicação [7].
Além das medicações antianginosas, o paciente com coronariopatia crônica também deve receber terapia antitrombótica e estatina. Veja mais na revisão sobre a diretriz de doença coronariana crônica de 2023.
Qual o papel da angioplastia no tratamento de angina estável?
Os três principais estudos que avaliaram o papel da angioplastia no paciente com angina estável são COURAGE, ISCHEMIA e ORBITA-1.
O estudo COURAGE foi publicado em 2007 e incluiu 2287 pacientes com angina estável e estenose superior a 70% em alguma coronária à cineangiocoronariografia [8]. Esse trabalho comparou a realização de angioplastia versus terapia medicamentosa e não encontrou diferença em morte ou eventos cardiovasculares. Os pacientes randomizados para cateterismo apresentaram menores taxas de angina após o procedimento.
O ISCHEMIA foi publicado em 2020 randomizando 5179 pacientes para abordagem invasiva (angioplastia ou revascularização cirúrgica) ou tratamento clínico exclusivo da doença coronariana crônica [9]. Foram excluídos pacientes com estenose de tronco coronariano à angiotomografia. Os demais critérios de inclusão eram semelhantes ao COURAGE. O ISCHEMIA também não demonstrou diferença em mortalidade ou incidência de eventos cardiovasculares entre realizar angioplastia ou manter terapia medicamentosa exclusiva. Assim como no COURAGE, os pacientes que realizaram angioplastia apresentaram menores taxas de angina após o procedimento.
Uma das dúvidas geradas por esses estudos é se o cateterismo pode ter reduzido a angina por um efeito placebo, não necessariamente pelo efeito da angioplastia. O ORBITA-1, publicado em 2017, randomizou 200 pacientes com estenose coronariana superior a 70% para o procedimento de cateterismo [10]. Apenas o grupo intervenção realizava a angioplastia, enquanto o grupo controle realizava um procedimento placebo, sem intervenção coronariana. Ambos os grupos receberam terapia antianginosa otimizada. Não houve diferença no desfecho primário entre os grupos, tendo sido avaliado o tempo de exercício até angina.
Após o ORBITA-1, restava a dúvida se os medicamentos antianginosos, utilizados por ambos os grupos, poderiam ter minimizado o benefício da angioplastia no grupo intervenção. Nesse contexto foi idealizado o ORBITA-2, sem medicamentos antianginosos.
O que o estudo ORBITA-2 acrescenta?
O ORBITA-2 é um ensaio clínico randomizado que avaliou se a angioplastia coronariana reduz sintomas em pacientes com angina estável que não estavam em uso de terapia antianginosa [1]. O grupo placebo realizava cateterismo, porém não realizava a angioplastia. Fones de ouvido eram fornecidos para que o paciente não ouvisse nada que pudesse prejudicar o cegamento.
Os pacientes ficavam pelo menos duas semanas sem nenhuma terapia antianginosa, para confirmar a presença de sintomas antes da randomização. Medicações para insuficiência cardíaca que apresentam benefício em mortalidade, como betabloqueadores, eram mantidas. Todos os pacientes realizaram testes para a documentação de isquemia.
O desfecho primário foi redução de angina, avaliado através de um escore que ia de 0 a 79 pontos. O escore leva em conta o número de episódios de angina por dia, a necessidade de medicações para controle de sintomas e eventos clínicos.
Com 301 pacientes randomizados, o trabalho seguiu os participantes por 12 semanas após a randomização. O grupo intervenção teve menores taxas de angina do que o grupo controle - média de escore de angina no grupo intervenção de 2,9 vs 5,6 no controle. Esse grupo também teve melhores escores de qualidade de vida e de tempo de exercício. A média de frequência diária de angina foi 0,3 na intervenção e 0,7 no controle. Alguns pacientes mantiveram angina pós angioplastia, podendo ser atribuída a outros mecanismos, como doença microvascular.
O tempo de seguimento dos pacientes pode ser considerado curto para avaliar eventos adversos, especialmente relacionados à dupla antiagregação plaquetária indicada aos pacientes submetidos à angioplastia.
Apesar dos resultados do ORBITA-2, a indicação da angioplastia na doença coronariana crônica parece restrita ao manejo dos sintomas. Outros estudos não demonstraram benefícios em mortalidade ou incidência de eventos cardiovasculares com a intervenção.
O ORBITA-2 pode embasar a decisão pela angioplastia em pacientes que possuem contraindicações aos medicamentos antianginosos ou que preferem realizar o procedimento em decisão compartilhada.