Diretriz de Síndrome de Guillain Barré
A Síndrome de Guillain Barré (SGB) é a principal causa de paralisia flácida aguda no pronto socorro. Essa condição tem tratamento específico e há risco de falência respiratória e disautonomia grave. Em outubro de 2023, foi publicado no European Journal of Neurology a nova diretriz europeia de diagnóstico e manejo da Síndrome de Guillain-Barré [1]. Esse tópico revisa o tema e aborda essa nova publicação.
Como é o diagnóstico da Síndrome de Guillain Barré (SGB)?
A SGB é uma doença autoimune pós-infecciosa que ocorre semanas após um quadro de diarreia ou infecção respiratória. O agente mais comumente associado é o Campylobacter jejuni como causador de diarreia invasiva. A vacinação também é um fator associado como gatilho de SGB, principalmente as vacinas para influenza e herpes zoster. Até um terço dos pacientes podem não ter um gatilho identificado na história [2].
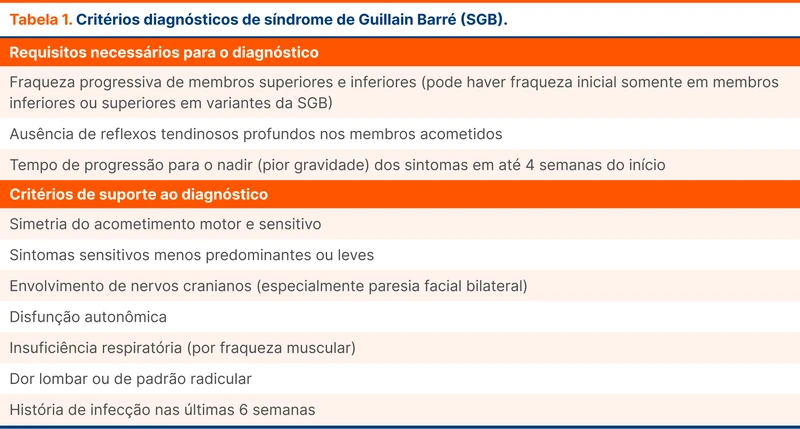
A SGB é uma polirradiculoneuropatia, ou seja, acomete as raízes e os nervos periféricos. O quadro clínico na sua forma clássica é caracterizado por sintomas motores e sensitivos, simétricos, progressivos e geralmente ascendentes (início nos membros inferiores). O principal sintoma é a fraqueza muscular aguda associada a hiporreflexia, padrão conhecido como paralisia flácida.
Parestesia é um sintoma sensitivo comum e disautonomia também pode estar presente. Nervos cranianos podem ser afetados, principalmente na forma de paralisia facial. Na tabela 1 estão os critérios diagnósticos utilizados pela diretriz, assim como outros achados que fortalecem a hipótese diagnóstica de SGB.
A análise do líquor está indicada na investigação de um paciente com paralisia flácida aguda. O achado que sugere SGB é o aumento da proteinorraquia (> 40 mg/dL) com pouco aumento de células no liquor. Cerca de 80% dos pacientes terão celularidade normal (< 5 cél/mm³), mas o limite considerado aceitável para o diagnóstico é de até 50 cél/mm³. Esse padrão de elevação de proteínas com celularidade preservada é chamado de dissociação proteino-citológica. Esse achado chama atenção, já que normalmente espera-se elevação de proteínas com aumento de celularidade.
A eletroneuromiografia não é necessária para o diagnóstico. Em caso de dúvida diagnóstica, o exame pode ajudar mostrando um padrão sugestivo de polineuropatia. Um achado associado à SGB é a relativa preservação do nervo sural (sural sparing) em relação aos outros nervos.
Outra contribuição da eletroneuromiografia para o seguimento da SGB é diferenciar entre os dois subtipos existentes: forma axonal (acute motor axonal neuropathy - AMAN) e forma desmielinizante (acute inflammatory demyelinating polyneuropathy - AIDP). Não há mudança de tratamento entre os subtipos. A diferenciação é útil para o prognóstico, sendo a forma axonal associada a uma progressão mais rápida para o ponto de maior gravidade clínica (nadir).
Como tratar a Síndrome de Guillain Barré?
As duas principais opções de tratamento para SGB são a imunoglobulina intravenosa e a plasmaférese. Estudos não observaram diferença de eficácia entre os dois métodos e a escolha deve se basear em perfil de efeitos adversos e disponibilidade no serviço. A imunoglobulina deve ser realizada na dose de 400 mg/kg/dia por 5 dias, enquanto a plasmaférese é realizada 4 a 5 vezes no período de até 14 dias, comumente em dias alternados.
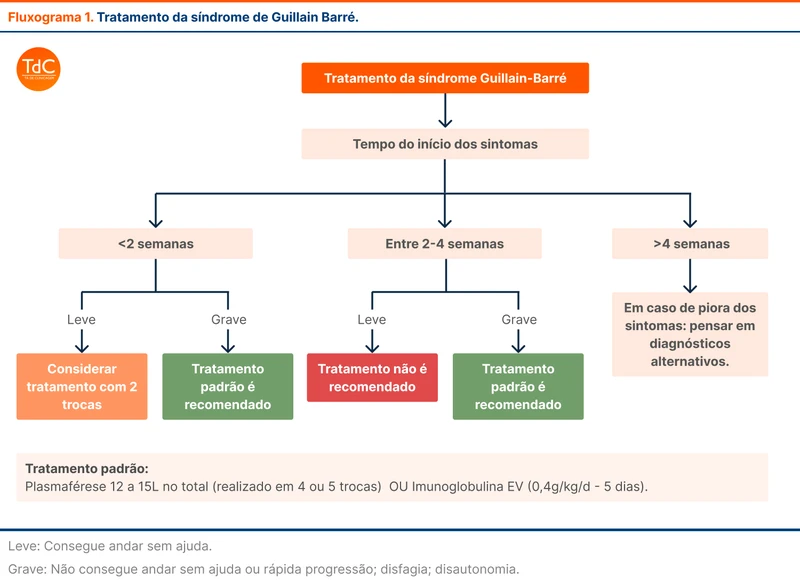
Alguns pacientes com formas leves e início há mais de 2 a 4 semanas podem não ter benefício do tratamento de imunoterapia. A recomendação de tratamento da diretriz está esquematizada no fluxograma 1.
O uso de corticoides não é recomendado para o tratamento de SBG por ausência de benefício.
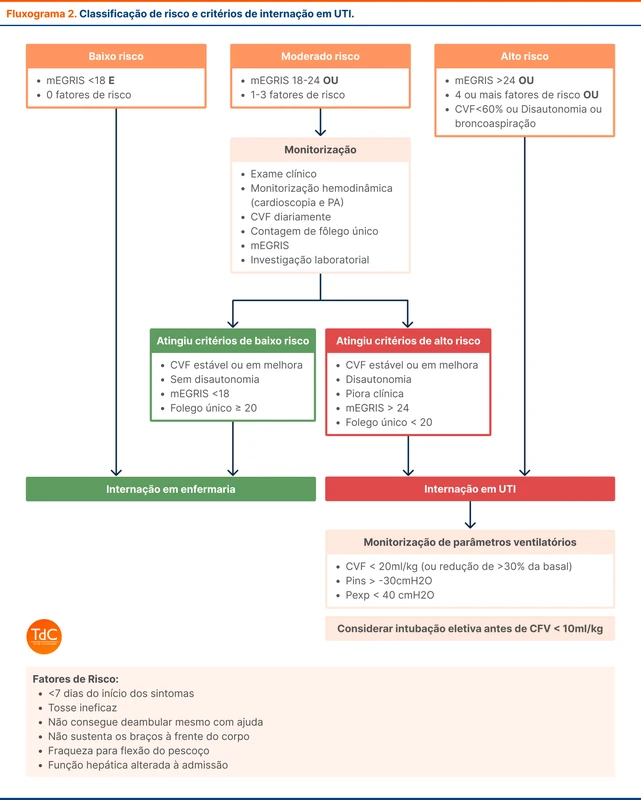
Alguns parâmetros clínicos precisam ser analisados para detectar piora clínica precoce e indicar necessidade de UTI. Essa avaliação é baseada na tríade:
- Escalas de predição de insuficiência respiratória (mEGRIS) [3]
- Avaliação clínica de fatores de risco
- Parâmetros ventilatórios
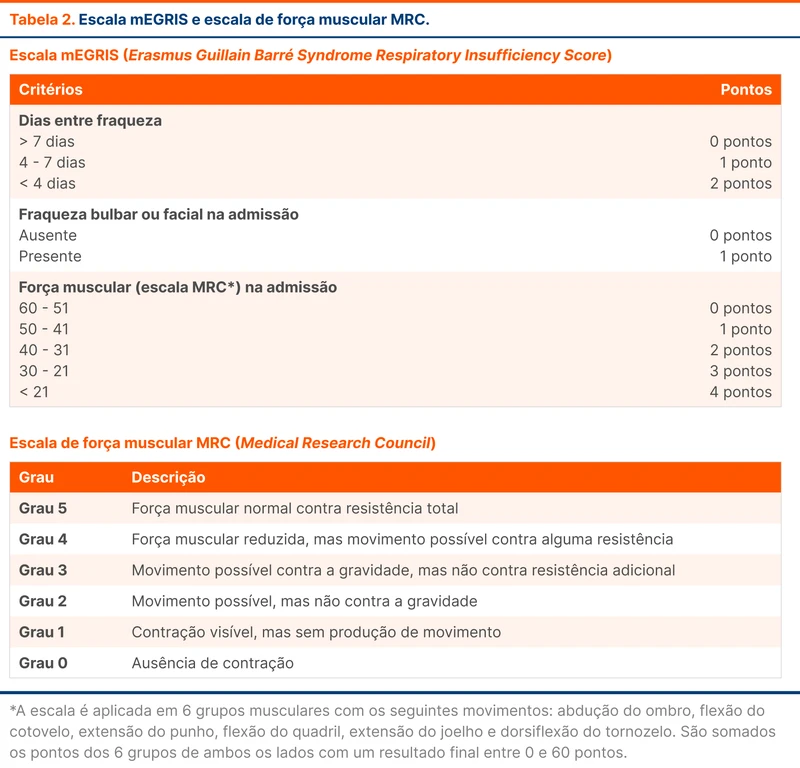
A principal escala preditiva para insuficiência respiratória é a mEGRIS (tabela 2), que deve ser realizada diariamente, assim como a verificação dos principais fatores de risco associados à deterioração clínica e avaliação clínica direcionada (tabela 3). O fluxograma 2 reúne a classificação de risco e conduta baseado nos três parâmetros.

Outras novidades da diretriz de Síndrome de Guillain Barré de 2023?
Além da organização da avaliação e tratamento da SGB, a diretriz se posicionou sobre situações clínicas complexas, com destaque para três situações:
Se o paciente não melhorar, deve-se repetir a imunoterapia?
Não é recomendada a repetição da imunoterapia ou a troca da modalidade de tratamento - plasmaférese para imunoglobulina e vice-versa.
Após melhora inicial, o paciente volta a piorar dos sintomas, deve-se repetir o tratamento?
Pode ser considerada a repetição da imunoterapia, seja na modalidade inicial ou troca do tratamento.
Deve-se iniciar o tratamento de imunoterapia após quatro semanas do início dos sintomas?
Se houver piora clínica, diagnósticos diferenciais devem ser pesquisados. Nesse cenário de piora prolongada dos sintomas, deve-se pensar principalmente em uma forma aguda da Polineuropatia Inflamatória Desmielinizante Crônica (A-CIDP), cujo tratamento e seguimento tem particularidades próprias.
Um destaque é sobre o papel ainda limitado de métodos como a ultrassonografia de nervos e a ressonância magnética de raízes nervosas. Esses exames ainda não possuem indicação formal e estão reservados ao cenário da dúvida diagnóstica.