Bougie e Via Aérea
O bougie ou guia elástico de intubação foi desenvolvido para aumentar a chance de intubar na primeira tentativa. Inicialmente aplicado em vias aéreas difíceis, há quem indique o bougie em toda intubação. Um nova revisão sistemática e metanálise de autores brasileiros avaliando o benefício do bougie foi publicada em fevereiro de 2024 no Annals of Emergency Medicine [1]. Este tópico revisa o tema e os resultados do estudo.
O que é um bougie?
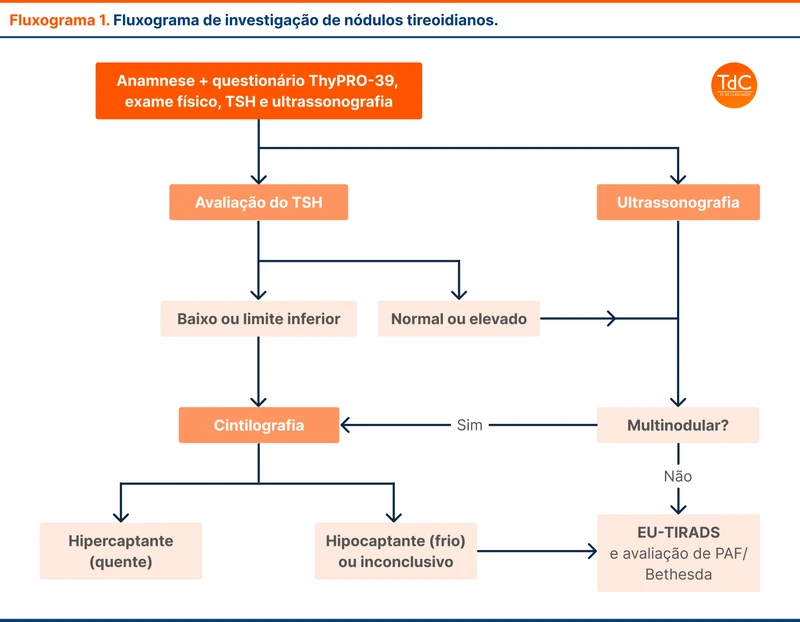
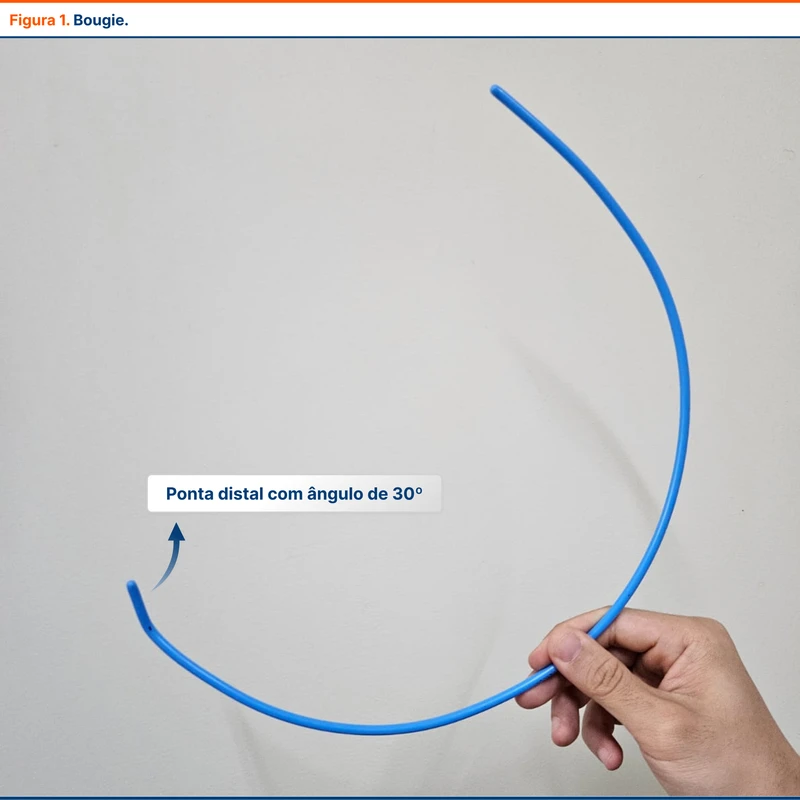
O bougie é um introdutor de tubo orotraqueal flexível com 50 a 70 cm de comprimento (figura 1). Esse instrumento foi inicialmente desenvolvido para facilitar a intubação de vias aéreas com visualização limitada da glote, especialmente aquelas com Cormack-Lehane III. Deve ser introduzido diretamente na traquéia durante a laringoscopia, em seguida o tubo é passado utilizando o bougie como condutor, em uma técnica similar à de Seldinger.
Um bougie é diferente de um fio guia. O fio guia é uma estrutura semi-rígida que já vai introduzida no tubo orotraqueal desde o início. A ideia do fio guia é moldar e conferir rigidez ao tubo, facilitando o direcionamento e passagem do tubo pelas cordas vocais. Uma vez passadas as cordas vocais, o fio guia é retirado e o tubo é introduzido até a profundidade desejada. O fio guia é a escolha preferencial em videolaringoscópios com lâminas hiperanguladas, pois pode se moldar melhor à lâmina e intubar com maior facilidade. Veja mais no tópico sobre videolaringoscopia no doente crítico.
A ponta do bougie tem um leve ângulo de 30º (figura 1). Esse ângulo favorece o direcionamento para a glote, que pode estar escondida atrás da epiglote. Além disso, se o bougie estiver dentro da traqueia, o ângulo aumenta a chance de a ponta do instrumento tocar os anéis traqueais, informando o laringoscopista que a via aérea foi acessada.
Os bougies variam de tamanho, tendo inclusive modelos pediátricos, mas os adultos geralmente aceitam bem tubos de tamanho 6.0 ou maiores. Podem ser feitos de vários materiais e alguns são fenestrados na extremidade distal para permitir oxigenação através do bougie. Alguns bougies podem ser esterilizados e reutilizados, porém podem sofrer mudanças nas suas características com esterilizações sucessivas [2].
Técnica e armadilhas
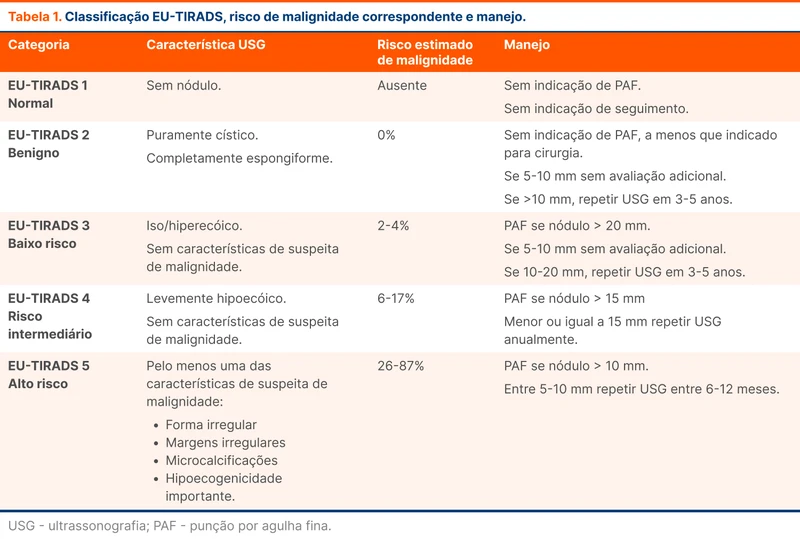
A técnica padrão de intubação com bougie envolve duas pessoas. Após conseguir a melhor visão com a laringoscopia, o bougie é introduzido na traquéia, idealmente com a ponta curva virada para a região anterior. Em seguida, um assistente insere a extremidade distal do tubo na extremidade proximal do bougie e progride o tubo (figura 2). Após a progressão do tubo, o bougie é retirado.

O bougie fornece dois sinais que podem informar que a via aérea foi acessada mesmo na ausência de visualização. O primeiro são os cliques dos anéis traqueais. Por ter a ponta curva, o bougie pode tocar os anéis traqueais durante a introdução e o laringoscopista sentir a vibração. O segundo é o sinal da parada ou "stop sign". Se estiver na via aérea, o bougie irá parar de progredir quando a via aérea reduzir de calibre. Isso não acontece se ele estiver no esôfago.
Existem duas dificuldades comuns durante o aprendizado do uso do bougie:
- Retirar o laringoscópio após a passagem do bougie. Esse é um reflexo habitual de quem não está acostumado a usar o instrumento, já que é o movimento feito quando se passa o tubo orotraqueal diretamente. Tentar passar o tubo pelo bougie sem manter a laringoscopia não é recomendado, já que as partes moles vão ceder, dificultando a introdução e aumentando a chance de trauma na via aérea.
- Dificuldade de introdução por choque do tubo com as aritenóides. Quando isso ocorrer, o recomendado é regredir um pouco o tubo, girar 90 graus no sentido anti-horário e tentar progredir de novo. Esse problema ocorre em média em 7% dos casos [3].
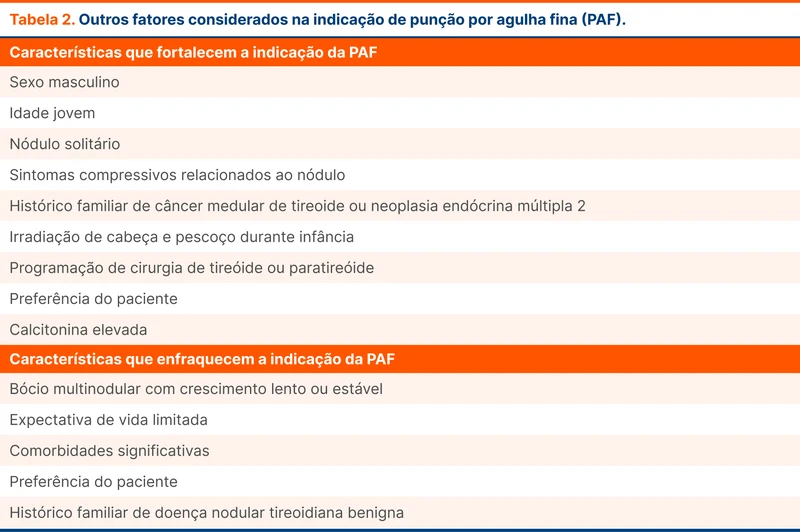
Em um cenário com poucas pessoas para ajudar na intubação, existem técnicas de intubação com bougie sem a necessidade de um auxiliar. Em uma delas, o laringoscopista introduz o bougie na traqueia com o tubo orotraqueal já inserido na parte proximal do bougie (figura 3). Uma vez que o bougie acessou a via aérea, insere-se o tubo que irá percorrer o trajeto do bougie.

O bougie também pode ser utilizado para realização de cricotireoidostomia e para trocar o tubo orotraqueal.
Veja um vídeo da Emergência OMNI exemplificando a técnica de intubação com bougie, os sinais de confirmação da via aérea e as dificuldades mencionadas anteriormente.
Evidência atual
A maior parte da evidência atual é consistente em apontar o benefício do bougie em intubações com visualizações limitadas da glote, especialmente Cormack Lehane III [4-6]. Em outras situações com visualização reduzida (edema, redução da abertura da boca, distorções, imobilização cervical) o bougie também pode auxiliar.
Em pacientes que serão intubados com videolaringoscópio hiperangulado, o bougie não é a melhor opção [7]. A escolha nesses casos é o fio guia, pois pode se moldar melhor à lâmina e intubar com maior facilidade. Veja mais no tópico videolaringoscopia no doente crítico.
O debate atual é se o bougie deveria ser usado de rotina em todas as intubações. O estudo BEAM, publicado em 2018, comparou bougie versus fio guia de rotina para todas as intubações [3]. O trabalho foi realizado em apenas um centro, onde todas as intubações eram realizadas por emergencistas treinados e praticamente todas com videolaringoscópio. Avaliando todas as 750 intubações do estudo, a probabilidade de intubação na primeira tentativa foi maior com o bougie (98% vs 87%). Essa diferença foi maior quando o paciente apresentava pelo menos um preditor de via aérea difícil (96% vs 82%). O tempo de intubação não diferiu significativamente entre os grupos.
O estudo BOUGIE, publicado em 2021, encontrou resultados diferentes [8]. Esse trabalho foi multicêntrico envolvendo 15 locais (UTI e sala de emergência) comparando novamente bougie contra fio guia em todas as intubações. Não houve diferença em intubação na primeira tentativa entre os dois grupos - 80% no grupo bougie e 83% no fio guia. O resultado se manteve mesmo quando analisados apenas os pacientes com preditores de dificuldade ou com visualização limitada da via aérea.
Parte da diferença entre os estudos pode ser explicada pela falta de prática com o instrumento no estudo BOUGIE. Apenas nove dos 15 centros utilizavam o bougie de rotina antes do trabalho e a mediana de uso do bougie por laringoscopista antes do estudo foi de 10.
O novo estudo
Essa revisão sistemática e metanálise feita por autores brasileiros reuniu 18 trabalhos avaliando o bougie, sendo 12 ensaios clínicos (incluindo o BEAM e o BOUGIE). Utilizando os 18 estudos (9150 pacientes) o bougie se associou a maior chance de intubação na primeira tentativa (risco relativo de intubação na primeira tentativa de 1,11). O resultado se manteve favorável ao bougie quando foram analisados apenas os ensaios clínicos e quando foram avaliados métodos diferentes de intubação (laringoscopia direta vs videolaringoscopia) e cenários diferentes (pré hospitalar, emergência, UTI). Quando avaliado apenas as intubações com Cormack Lehane III ou IV, o efeito do auxílio do bougie foi maior (risco relativo de 1,6). O bougie se associou a um pequeno aumento do tempo para intubação - um aumento máximo de 13 segundos nos estudos de sala de emergência.
Essa revisão sinaliza um benefício do bougie em todas as intubações, especialmente aquelas com visualização limitada. Porém, se esse instrumento for reservado apenas para os pacientes com preditores de dificuldade, será que os laringoscopistas terão a facilidade de manuseio necessária quando a hora chegar? Além disso, os preditores de dificuldade são imperfeitos, e vias aéreas desafiadoras ocorrem em muitos pacientes sem sinais prévios de dificuldade. Nessa linha, os achados dessa revisão reforçam o argumento que propõe a adoção do bougie em todas as intubações.