Diretriz de Trombose Venosa Cerebral da AHA/ASA de 2024
A trombose venosa cerebral (TVC) corresponde a até 3% de todos os acidentes vasculares cerebrais. O limiar de suspeição deve ser baixo, já que é uma doença grave e tratável. Esse tópico revisa o tema e traz as novidades da diretriz de 2024 de TVC publicada pela American Stroke Association (AHA/ASA) [1].
Manifestações clínicas e diagnóstico de TVC
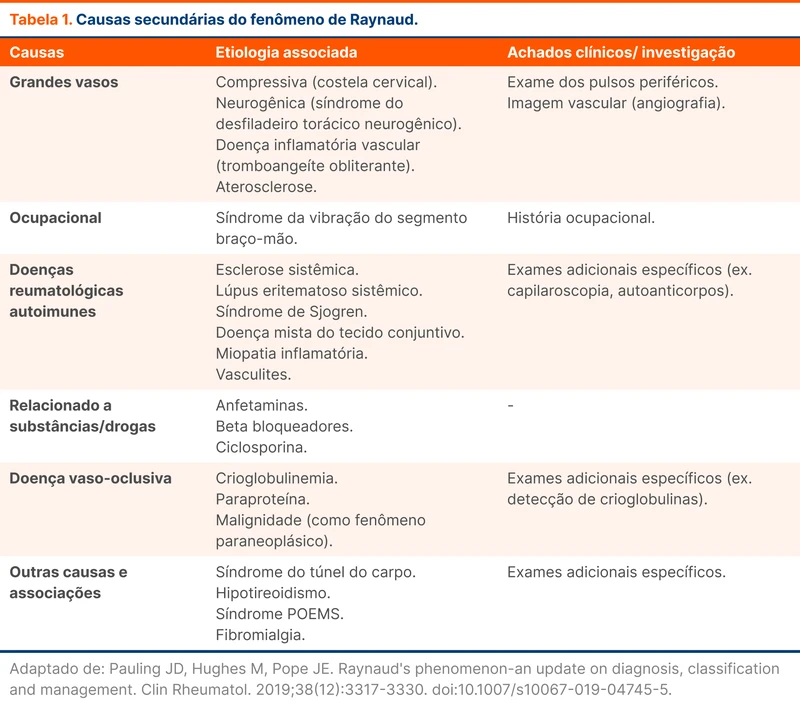
A TVC é uma forma rara de acidente vascular cerebral que ocorre por trombose dos seios venosos e/ou das veias corticais. Os locais mais acometidos são o seio sagital superior e o seio transverso (figura 1). As mulheres representam 2/3 dos casos e os principais fatores predisponentes estão listados na tabela 1.
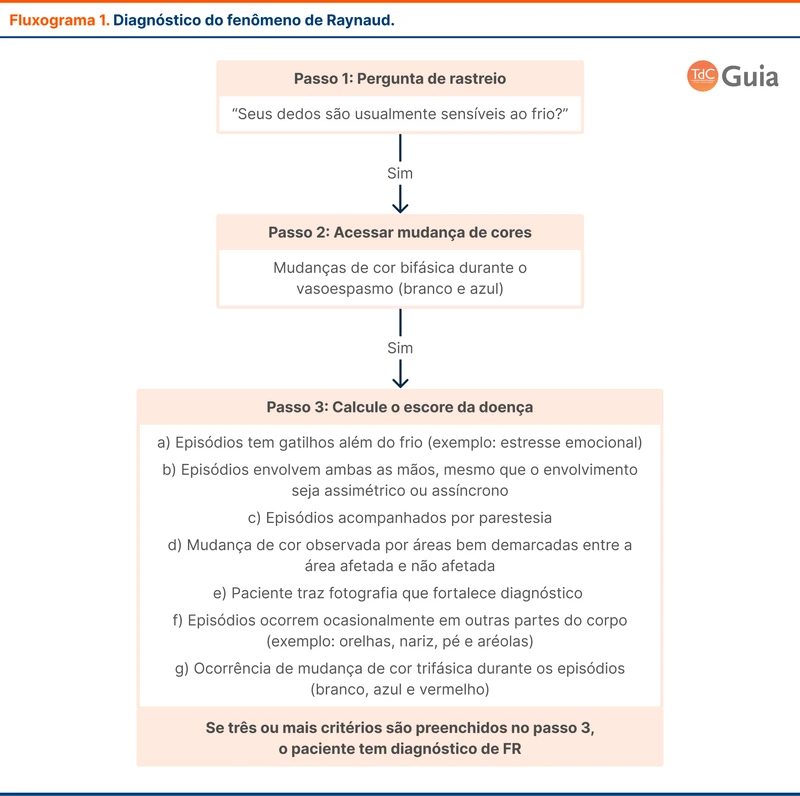
A apresentação clínica é caracterizada pelas três síndromes abaixo:
- Hipertensão intracraniana: a cefaleia é o sintoma mais comum, presente em cerca de 90% dos casos. Outros sintomas de hipertensão intracraniana são perdas visuais transitórias, papiledema, rebaixamento do nível de consciência e diplopia por paralisia do nervo abducente.
- Crises epilépticas: a TVC é o evento cerebrovascular mais relacionado a crises epilépticas, com até 40% dos pacientes com crises à admissão hospitalar. As crises podem ser focais ou tônico-clônicas bilaterais. Aproximadamente 10% dos pacientes permanecem com epilepsia após a fase aguda, com necessidade de tratamento de manutenção com fármacos anticrise.
- Sinais neurológicos focais: os sinais neurológicos focais estão presentes em até 50% dos pacientes e são relacionados à localização da TVC e aos infartos venosos associados. As regiões dos infartos por aumento da pressão venosa são diferentes dos territórios irrigados por artérias. Deve-se suspeitar de TVC na presença de lesões que não respeitam os territórios arteriais.
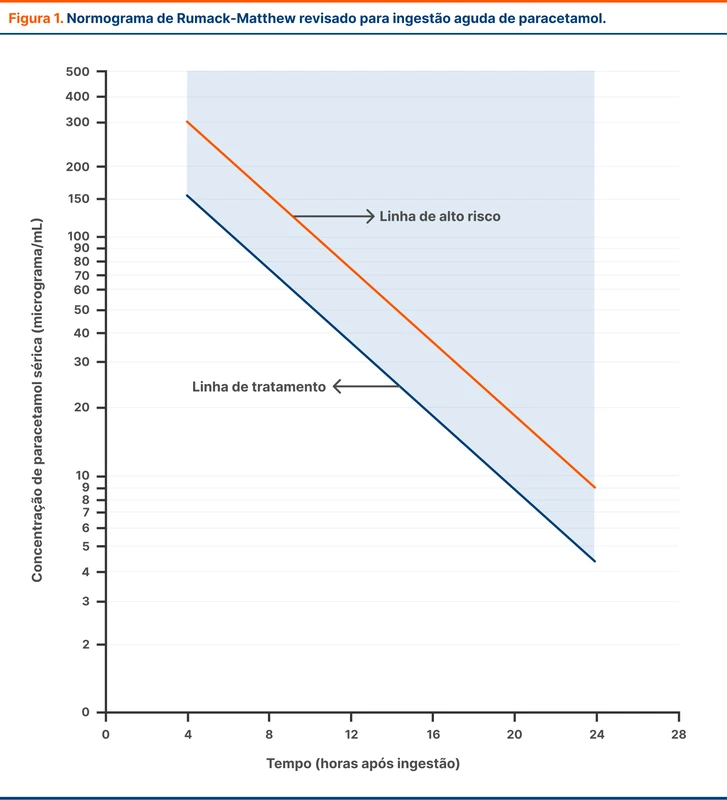
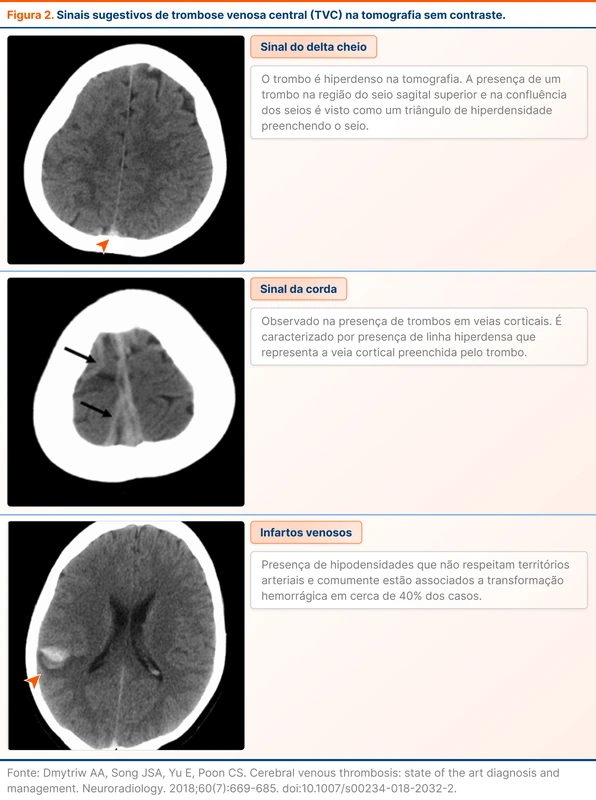
O diagnóstico de TVC é baseado em exames de imagem. O primeiro passo é analisar as imagens sem contraste. A diretriz de 2024 traz um novo dado de sensibilidade de 79% e especificidade de 90% da tomografia sem contraste. Alguns sinais sugestivos do diagnóstico de TVC estão na figura 2.
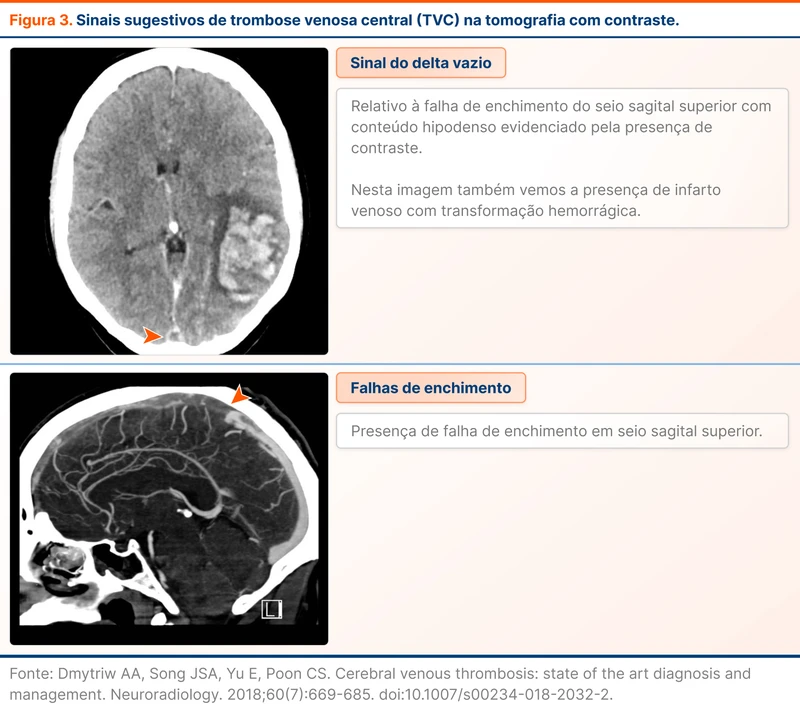
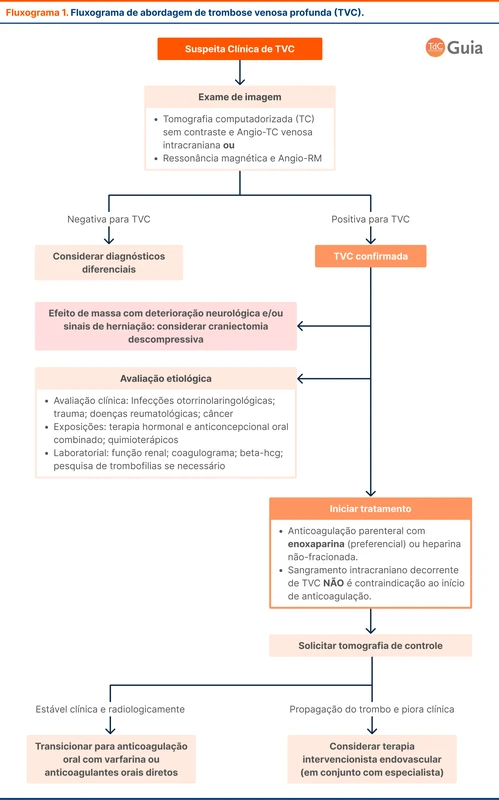
Apesar dos achados da TC sem contraste serem sugestivos, o diagnóstico é confirmado com métodos de visualização direta do sistema venoso. O mais acessível é a angiotomografia venosa intracraniana, em que observa-se principalmente falhas de enchimento. O achado mais conhecido é o sinal do delta vazio, correspondendo à falha de enchimento do seio sagital superior (veja figura 3).
A ressonância magnética, angiorressonância magnética venosa e a angiografia de subtração digital também são métodos utilizados para o diagnóstico, porém menos acessíveis.
Tratamento de TVC
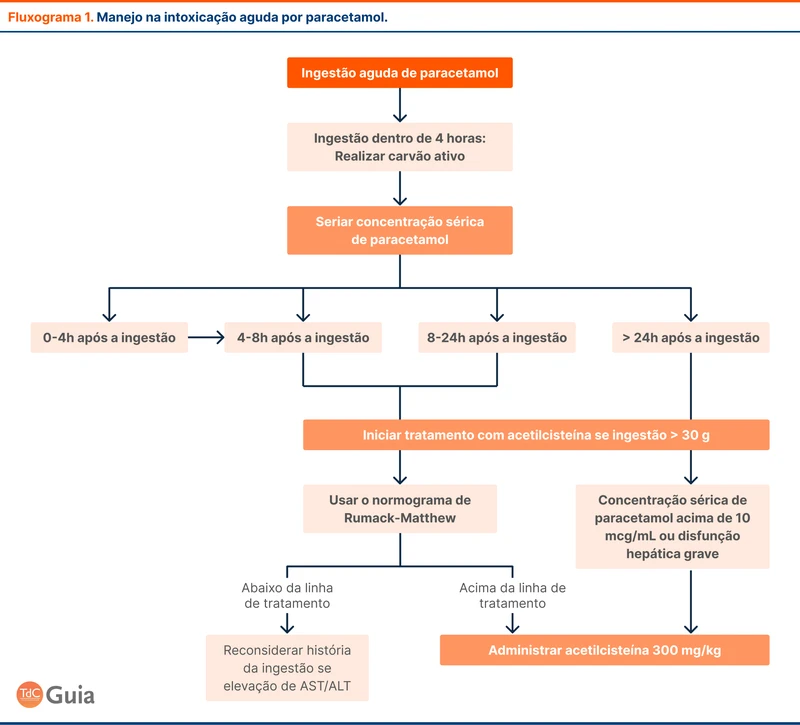
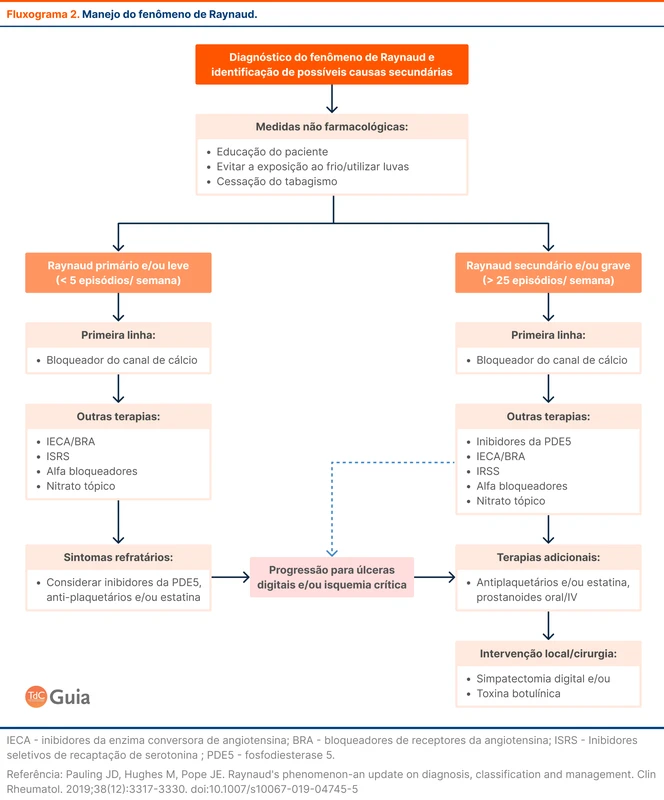
O paciente com TVC deve ser internado para investigação laboratorial e início de tratamento. A base do tratamento é a anticoagulação, com objetivo de impedir extensão do trombo e facilitar a recanalização do seio venoso acometido.
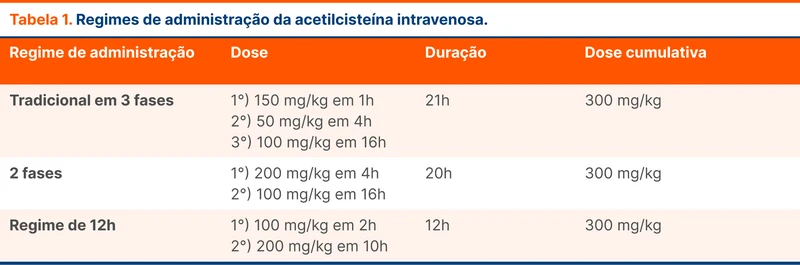
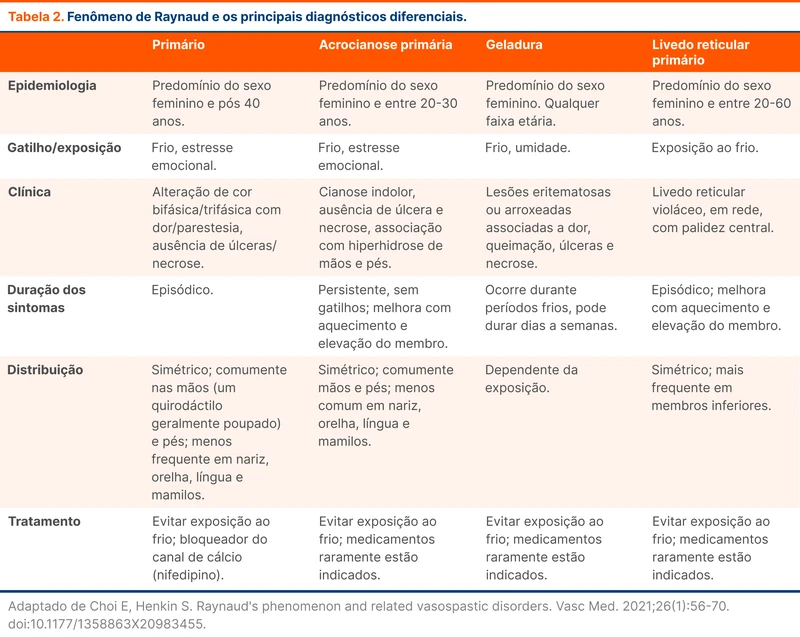
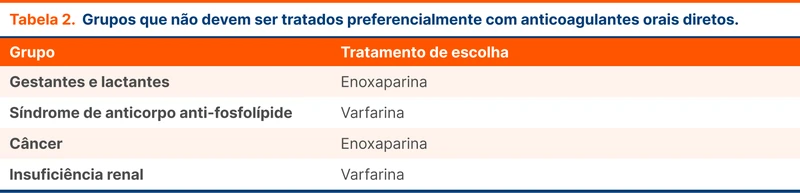
A diretriz recomenda anticoagulação parenteral com heparina, preferencialmente enoxaparina. Em seguida, realiza-se a transição para anticoagulação oral com varfarina ou anticoagulante oral direto (DOAC) entre 5 e 15 dias após o início do tratamento. Dentre os DOAC, os mais estudados são a dabigatrana e a rivaroxabana. Alguns grupos de pacientes não foram representados nos estudos de DOAC e ainda devem ser tratados preferencialmente com outros anticoagulantes, conforme a tabela abaixo (tabela 2).

A presença de sangramento intracraniano por transformação hemorrágica de um infarto venoso é um achado comum e não contraindica o início de anticoagulação.
A anticoagulação deve ser mantida por 3 a 12 meses em casos de fatores predisponentes transitórios como trauma, terapias hormonais ou infecções. Em casos de fatores predisponentes persistentes, como as trombofilias genéticas, a anticoagulação deve ser mantida por tempo indeterminado. Veja mais no tópico sobre investigação de trombofilias.
O risco de recorrência de TVC é baixo e os estudos de prevenção secundária de trombose venosa não tiveram representatividade de pacientes com TVC.
Há indicação de tratamento intervencionista?
O tratamento endovascular pode ser realizado com trombólise intra-seio, trombectomia ou aspiração direta de trombo. A intervenção é uma medida de resgate para situações críticas de progressão e piora sintomática apesar do tratamento ou quando há contraindicação à anticoagulação. Estudos como o TO-ACT avaliaram a trombólise intra-seio, demonstrando não haver benefício em comparação à anticoagulação padrão [2].
Os pacientes com infartos venosos extensos com efeito de massa, desvio de linha média e herniação, são candidatos a craniectomia descompressiva. Não há estudos randomizados sobre o assunto. Em uma revisão sistemática com 483 pacientes, a cirurgia dentro de 48 horas da admissão sugeriu diminuição de mortalidade [3].
Quais as novidades da diretriz de 2024 de TVC?
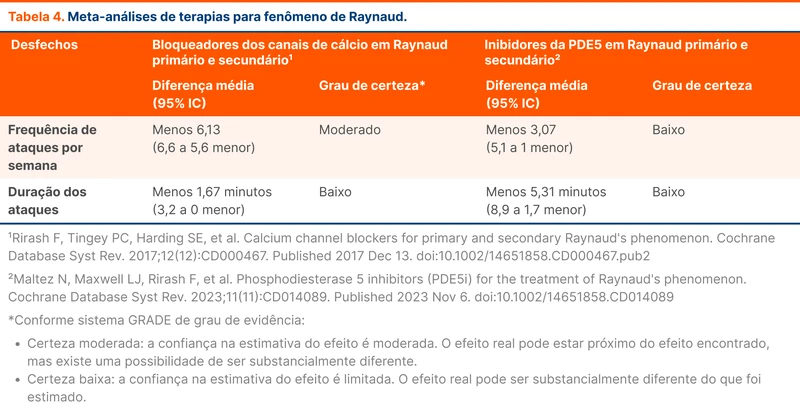
A principal novidade da diretriz foi a incorporação dos estudos que validaram o uso dos DOAC no tratamento da TVC. Os maiores estudos foram o RE-SPECT CVT e o SECRET [4, 5]. Esses estudos utilizaram dabigatrana e rivaroxabana em comparação com a varfarina para tratamento de TVC.
Houve também incorporação dos dados do ACTION-CVT, um grande estudo retrospectivo multicêntrico sobre o mesmo assunto [6]. Esses estudos demonstraram não haver maiores taxas de recorrência de trombose venosa ou sangramento nos pacientes tratados com DOAC, conferindo então a segurança necessária para a recomendação da diretriz.

Um fluxograma com abordagem do paciente com TVC pode ser visto no fluxograma 1.